响应面法优化刺五加高产异嗪皮啶的发酵工艺
张 赫,万 璐,闫佳佳,尤梦瑶,曾伟民,郑春英
(1黑龙江大学/农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院/黑龙江省普通高校微生物重点实验室,哈尔滨 150080)
0 引言
异嗪皮啶为7-羟基-6,8-二甲氧基苯并吡喃-2-酮[1],具有抗肿瘤[2]、镇静催眠[3]、抗炎[4]、抗氧化[5]、冠脉保护[6]等作用,且无毒、口服易吸收[7],是重要的医药原料中间体[8]。异嗪皮啶最先从刺五加等植物中分离得到[9],但得率较低。随着对异嗪皮啶研究的深入开展,采用化学合成制备异嗪皮啶的方法[10]陆续出现,但化学合成过程中,中间产物控制条件严格,使合成的成本和难度增大。因此,如何提高异嗪皮啶产率的问题一直是研究的热点。
微生物发酵法可以大幅提高刺五加中异嗪皮啶的产率[11],笔者在前期工作的基础上[12],选取内生真菌AJ14为发酵菌株,该菌株分离自野生刺五加根部的赭曲霉(Aspergillus ochraceus)[13]。研究发现,赭曲霉可产生多种次生代谢产物[14],并具有抗菌[15]、抗肿瘤活性[16],是备受关注的菌株。植物内生菌与宿主植物之间和谐共生,内生菌会调节或诱导宿主植物已知和未知的生物合成途径,导致宿主植物代谢发生改变[17];反之,宿主亦会选择内生菌并调控其代谢[18]以适应环境。因此,采用内生菌发酵宿主植物,会导致其次生代谢产物发生改变。
本研究以异嗪皮啶含量为指标,采用单因素实验及响应面法对内生真菌AJ14发酵刺五加的工艺条件进行优选,选择发酵时间、初始pH、发酵温度、摇床转速、菌悬液加入量、底物质量浓度为发酵因素进行探究,以期获得内生真菌AJ14发酵刺五加的最佳工艺参数,从而提高异嗪皮啶的利用率,为后续工业化生产异嗪皮啶原料提供参考。
1 材料与方法
1.1 材料与试剂
野生健康刺五加样品(3年生,于黑龙江省帽儿山地区采集);刺五加内生真菌AJ14(Aspergillus ochraceus)由黑龙江大学生命科学学院生物制药专业实验室分离得到;试剂均为分析纯。
PDA、PDB培养基配制方法参阅文献[19];异嗪皮啶(供含量测定用,中国药品生物制品检定院)。
1.2 主要仪器
FL2200型高效液相色谱仪(浙江温岭福立分析仪器有限公司)。
1.3 方法
1.3.1 菌悬液的制备 参阅文献[20]制备1×107CFU/mL内生真菌AJ14菌悬液。
1.3.2 异嗪皮啶含量的测定 测定采用HPLC法,条件参阅文献[21]。
1.3.3 单因素实验
(1)发酵时间对异嗪皮啶含量的影响。取刺五加粉(过40目筛),精密量取20 mL水,置于100 mL三角烧瓶中,按一定的比例制成0.3 g/mL的底物,pH自然,密封,灭菌(121℃,30 min),取出,放冷,作为底物;然后加入4 mL 1.3.1项菌悬液,置于摇床(28℃,120 r/min),分别发酵3、7、11、15、19、23、27、31天,取出,冻干(n=3),按1.3.2项测定异嗪皮啶的含量,考察发酵时间对刺五加发酵后其异嗪皮啶含量的影响。
(2)初始pH对异嗪皮啶含量的影响。在1.3.3(1)条件基础上,调节发酵初始pH 4、pH 5、pH 6、pH 7、pH 8、pH 9,摇床发酵培养19天,考察初始pH对刺五加发酵后其异嗪皮啶含量的影响。
(3)发酵温度对异嗪皮啶含量的影响。在1.3.3(1)条件基础上,设定发酵温度分别为20、24、28、32、36℃,摇床发酵培养19天,考察发酵温度对刺五加发酵后其异嗪皮啶含量的影响。
(4)摇床转数对异嗪皮啶含量的影响。在1.3.3(1)条件基础上,设定摇床转速分别为100、120、140、160、180 r/min,摇床发酵培养19天,考察摇床转数对刺五加发酵后其异嗪皮啶含量的影响。
(5)菌悬液加入量对异嗪皮啶含量的影响。在1.3.3(1)条件基础上,分别加入1.3.1项菌悬液3、4、5、6、7 mL,摇床发酵培养19天,考察菌悬液加入量刺五加发酵后其异嗪皮啶含量的影响。
(6)底物质量浓度对异嗪皮啶含量的影响。依次在不同的100 mL三角烧瓶中,制备底物的质量浓度为0.1、0.2、0.3、0.4、0.5 g/mL,摇床发酵培养19天,其他条件同1.3.3(1),考察底物质量浓度对刺五加发酵后其异嗪皮啶含量的影响。
1.3.4 响应面法实验 在单因素实验分析基础上,选取pH、菌悬液加入量和发酵温度3个因素,以异嗪皮啶含量为响应值,设计Box-Behnken因素、水平(表1)。
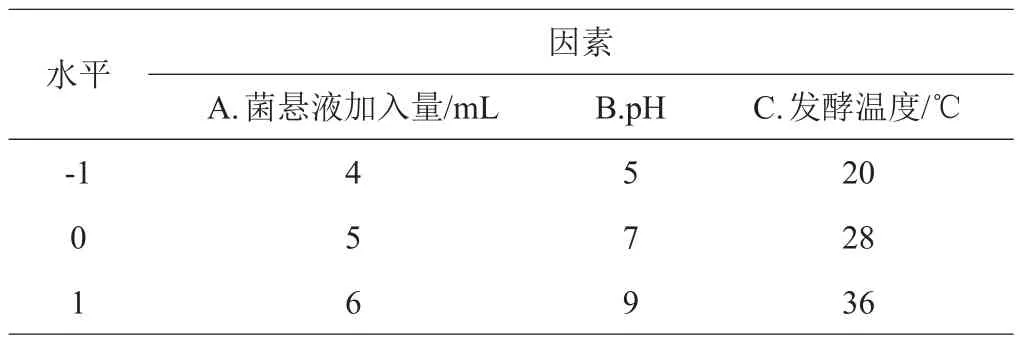
表1 Box-Behnken实验设计
1.3.5 验证实验 根据响应面法优选的刺五加的最佳发酵工艺条件进行3次验证实验,采用1.3.2法测定最佳发酵工艺中异嗪皮啶含量,建立高产、稳定、可控的刺五加发酵工艺条件。
2 结果与分析
2.1 单因素实验结果
2.1.1 发酵时间对异嗪皮啶含量的影响 从图1可知,随着刺五加发酵时间的增长,异嗪皮啶的含量呈现先增高后降低的趋势,当发酵时间为3~19天时,异嗪皮啶的含量逐渐增高,并在19天时达到最大值;自此以后,异嗪皮啶的含量呈现下降趋势,这可能是底物中营养物质被消耗所致。上述结果表明,最适发酵时间为19天。
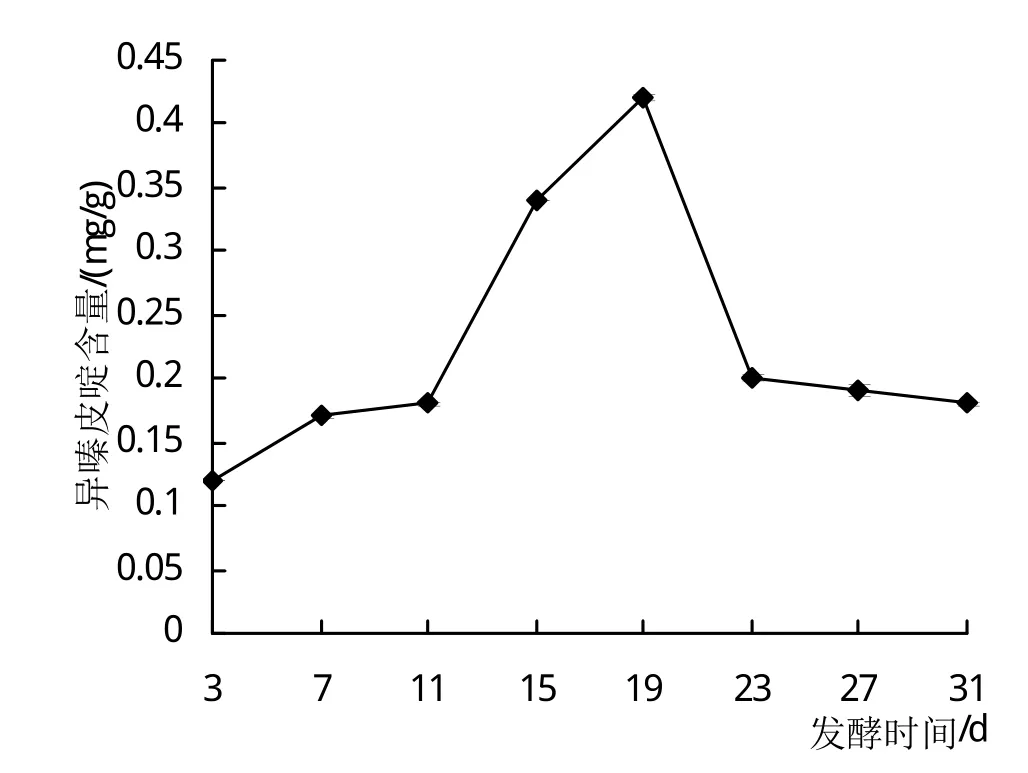
图1 发酵时间对异嗪皮啶含量的影响
2.1.2 初始pH对异嗪皮啶含量的影响 从图2可以看出,pH 4~9的变化范围内,刺五加发酵后其异嗪皮啶的含量呈现先增高后降低的趋势,当pH 7时,异嗪皮啶的含量达到最大。由此可见,酸性或碱性过强都不利于发酵刺五加中异嗪皮啶的产生,最适为pH 7。
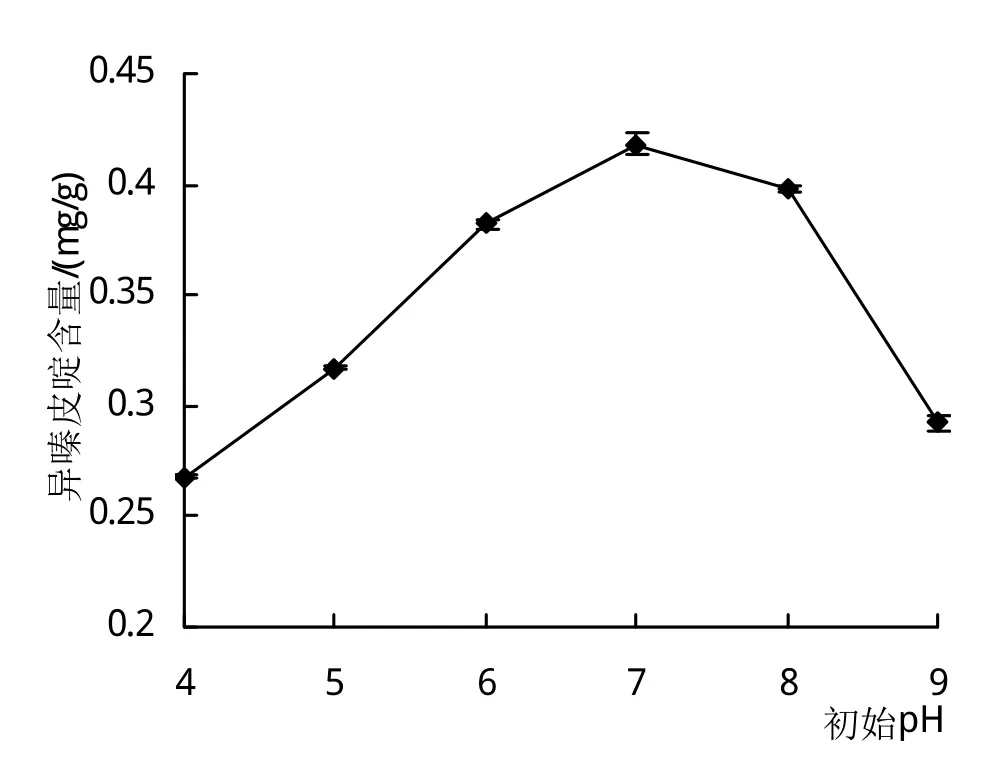
图2 初始pH对异嗪皮啶含量的影响
2.1.3 发酵温度对异嗪皮啶含量的影响 由图3可以看出,当发酵温度在20~36℃范围变化时,刺五加发酵后其异嗪皮啶的含量先随着温度的升高而增高,并在发酵温度为28℃时,其异嗪皮啶含量达到最大值,此后则呈现下降趋势,说明温度增高并不适合刺五加发酵后异嗪皮啶的生物合成,故最适发酵温度为28℃。
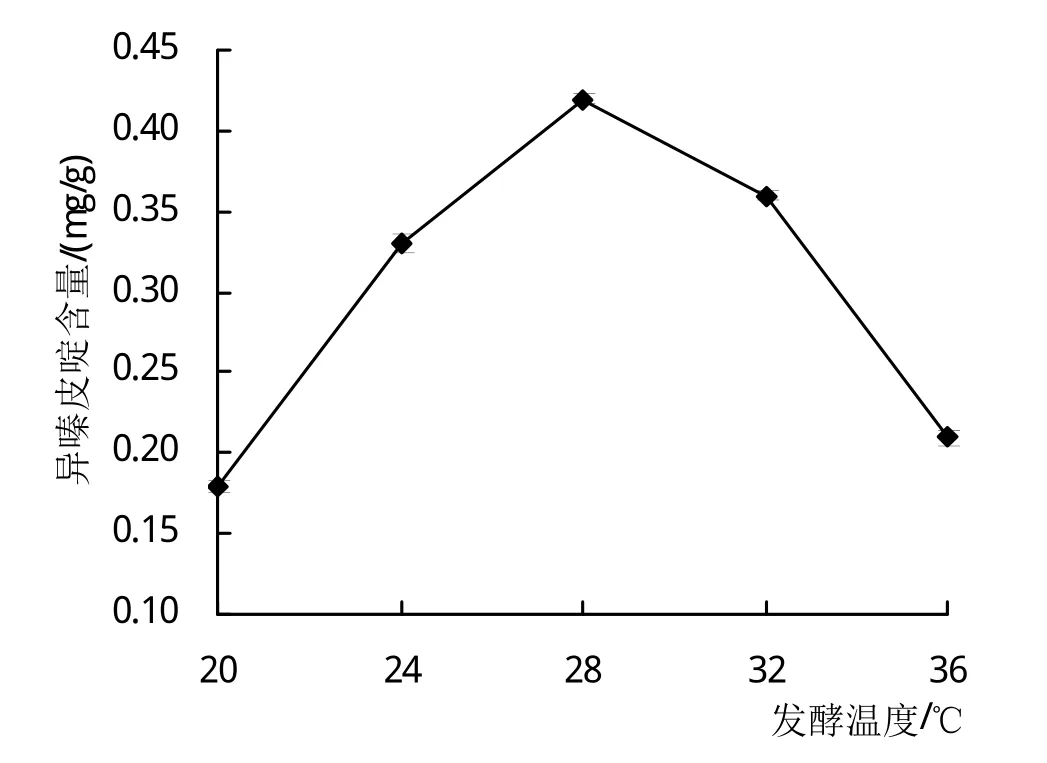
图3 发酵温度对异嗪皮啶含量的影响
2.1.4 摇床转速对异嗪皮啶含量的影响 由图4可见,当摇床转速在100~180 r/min范围时,刺五加发酵后其异嗪皮啶的含量呈现先增高后降低的趋势,当转速为140 r/min时,异嗪皮啶的含量达到最大值,说明该条件下空气中的氧气与培养基中的营养物质能被发酵菌株充分利用。
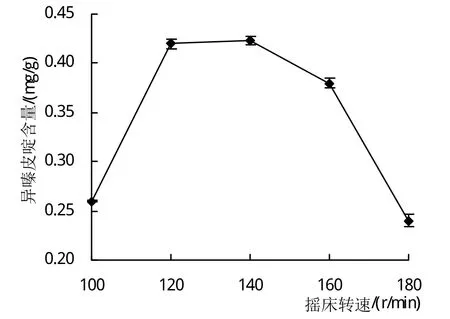
图4 摇床转速对异嗪皮啶含量的影响
2.1.5 菌悬液加入量对异嗪皮啶含量的影响 从图5可知,当发酵菌株菌悬液为1×107CFU/mL时,随着菌悬液加入量的增加,刺五加发酵后其异嗪皮啶含量呈现先增高后降低的趋势,当1×107CFU/mL菌悬液加入量为5 mL时,异嗪皮啶的含量达到最大值。说明菌悬液加入量过低或过高均不适合发酵刺五加中异嗪皮啶的生物转化。因此,最适发酵菌株菌悬液(1×107CFU/mL)加入量为5 mL。
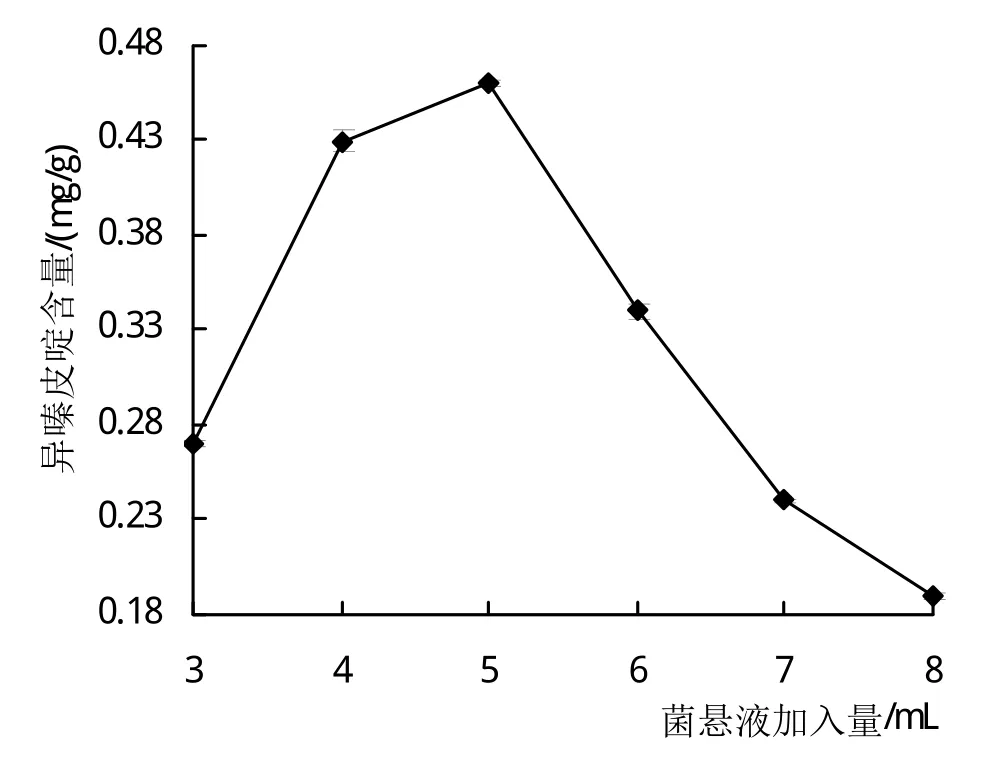
图5 菌悬液加入量对异嗪皮啶含量的影响
2.1.6 底物质量浓度对异嗪皮啶含量的影响 从图6可以看出,底物质量浓度为0.1~0.5 g/mL时,刺五加发酵后其异嗪皮啶的含量表现为先增高后降低,当底物质量浓度为0.2 g/mL时,异嗪皮啶的含量达到了最大值,说明底物质量浓度过高或过低均不适合异嗪皮啶的产生,因此最适底物质量浓度为0.2 g/mL。

图6 底物质量浓度对异嗪皮啶含量的影响
2.2 响应面法实验结果
2.2.1 响应面法实验结果与分析 在单因素实验结果优选的基础上,选择发酵菌株菌悬液(1×107CFU/mL)的加入量、初始pH、发酵温度3个因素,以刺五加发酵后其异嗪皮啶的含量为响应值,进行3因素3水平的响应面优化实验,结果如表2所示,方差分析结果见表3。
对表2实验数据进行多元回归拟合,得到异嗪皮啶(Y)对菌悬液加入量(A)、pH(B)和发酵温度(C)3个因素的二次多项式回归模型如式(1)。
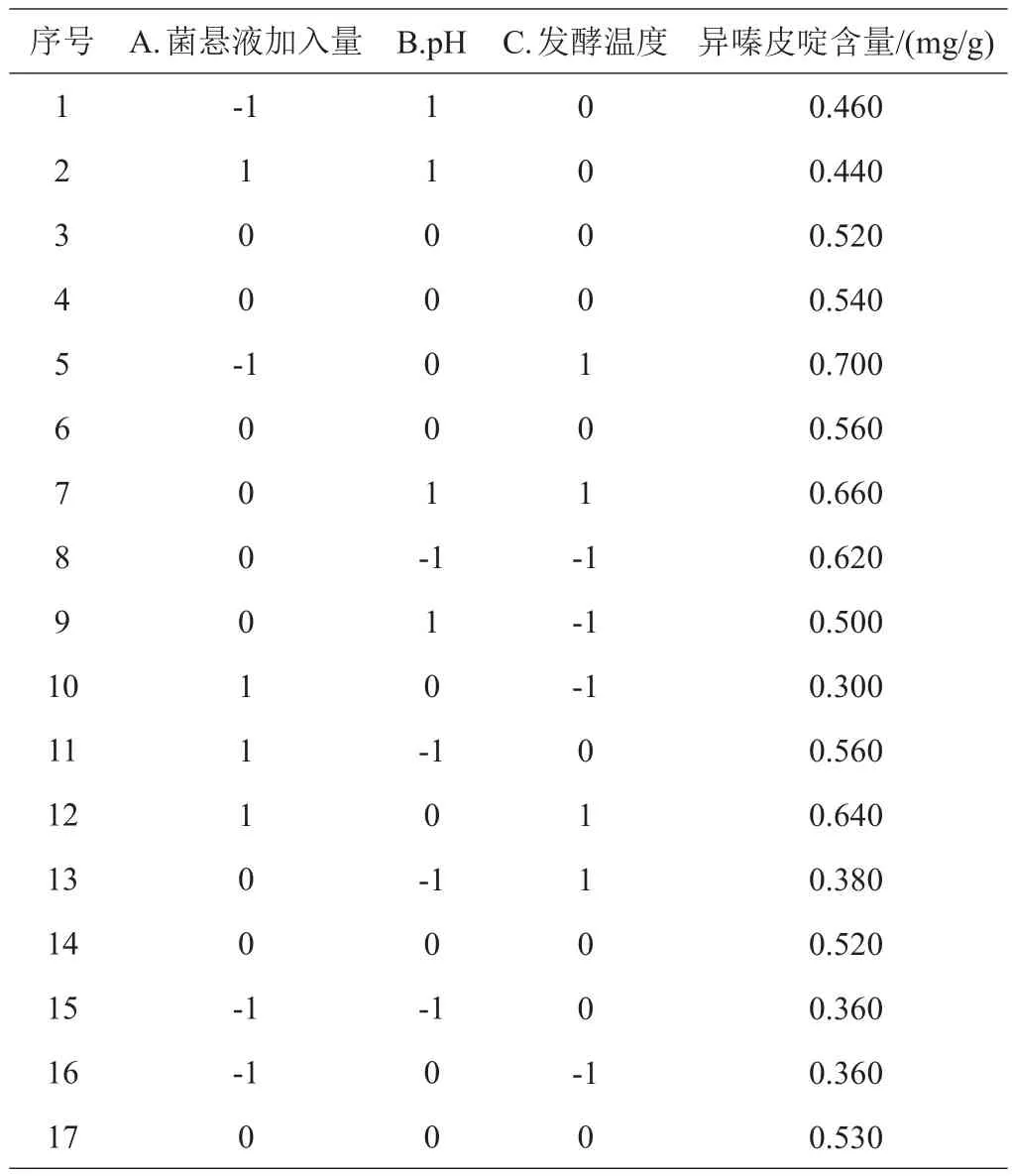
表2 Box-Behnken实验设计与结果
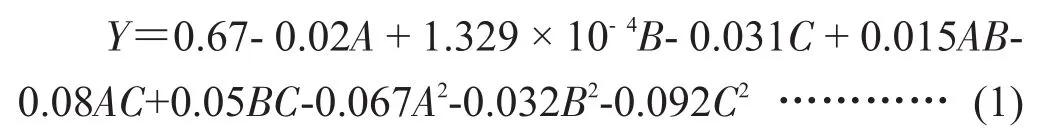
从表3可以看出,该模型F值为15.52,P值远远小于0.01,说明该模型极显著,与实际实验拟合较好。失拟项的F=4.09、P=0.0743,即失拟不显著,说明该方程拟合度良好,与实际情况具有相关性。由F值的大小推断,对刺五加发酵后其异嗪皮啶含量影响效果的顺序为C>A>B,即发酵温度>菌悬液加入量>初始pH。
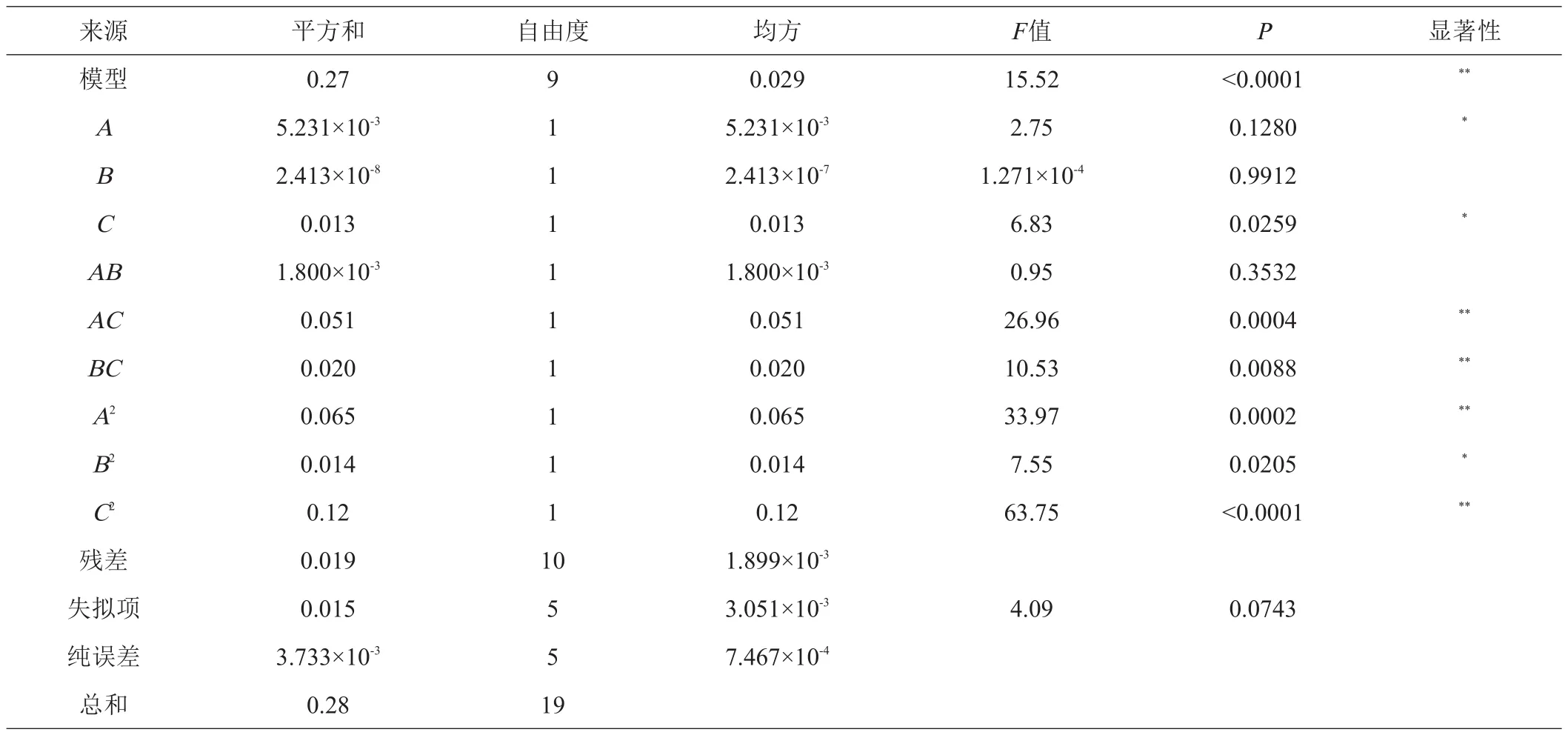
表3 方差分析结果
2.2.2 响应曲面及等高线图 由图7~9可以看出,3个响应曲面均为开口向下,说明响应值(异嗪皮啶含量)存在极高值,等高线形状均接近于椭圆形,说明菌悬液加入量与pH、pH与发酵温度、菌悬液加入量与发酵温度的交互作用均显著。

图7 菌悬液加入量与pH交互作用的响应面及等高线图
2.3 验证实验
通过回归模型预测刺五加发酵高产异嗪皮啶的最佳条件为菌悬液(1×107CFU/mL)加入量6 mL、pH 7.5、发酵温度27℃,在此条件下,异嗪皮啶含量理论值为0.6669 mg/g。采取上述工艺进行3次重复实验,测得异嗪皮啶含量为(0.6629±0.0007)mg/g,比理论值接近,表明该工艺是可行的。
3 结论
在单因素实验的基础上,采用响应面法对影响刺五加发酵过程中异嗪皮啶产率的3个重要因素(初始pH、发酵温度、菌悬液加入量)进行了筛选。结果表明,发酵菌株AJ14菌悬液加入量、初始pH和发酵温度对刺五加发酵过程中异嗪皮啶产率影响极显著,各因素两两间的交互效应对异嗪皮啶含量亦有极显著影响。本研究得到的最佳发酵工艺条件为发酵菌株AJ14菌悬液(1×107CFU/mL)加入量6 mL、pH 7.5、发酵温度27℃。上述方法稳定性好,成本较低,可为今后采用微生物发酵法生产异嗪皮啶及产品开发提供参考。
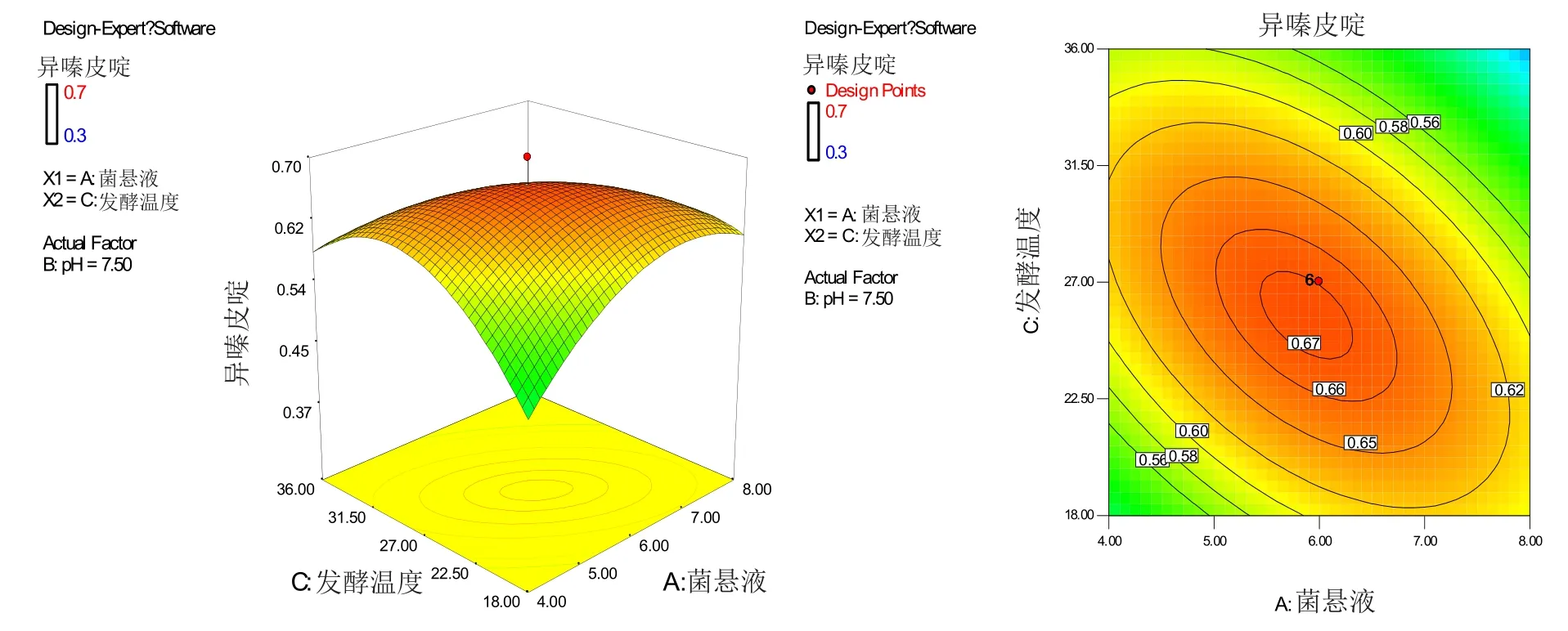
图8 菌悬液加入量与发酵温度交互作用的响应面及等高线图
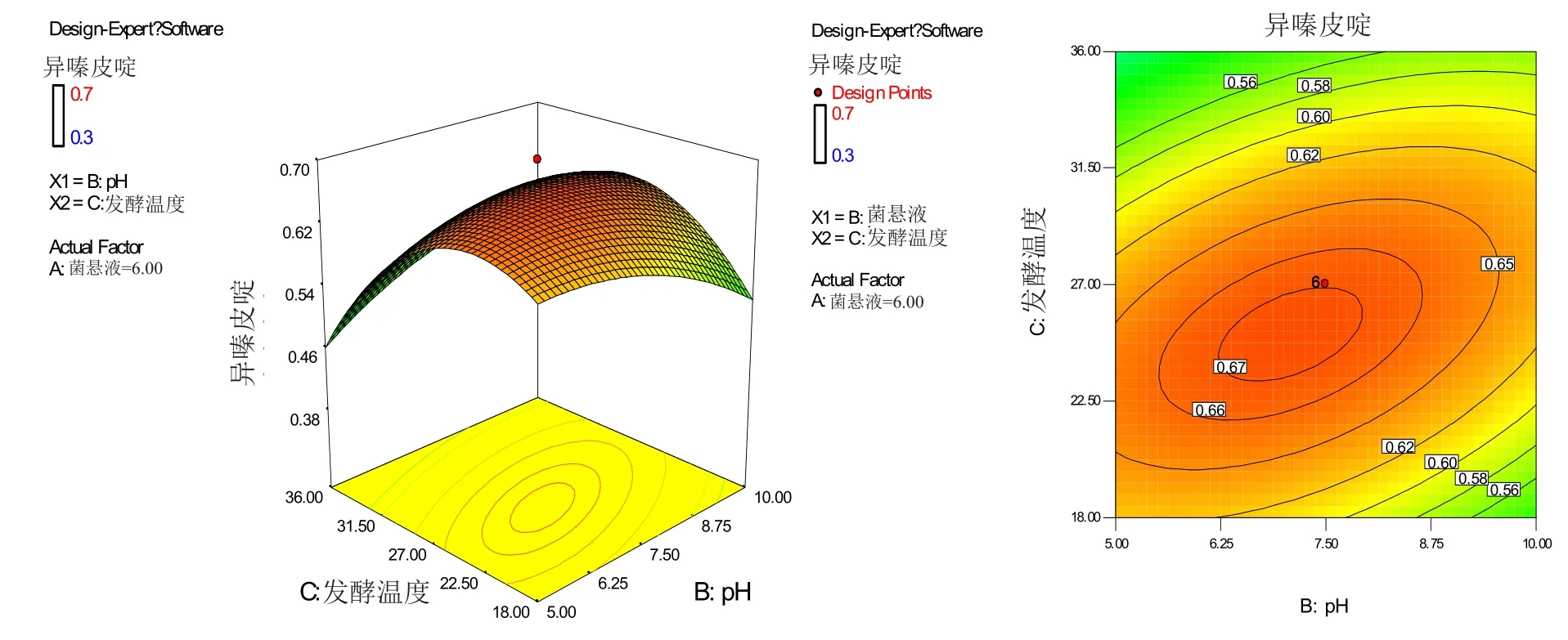
图9 pH与发酵温度交互作用的响应面及等高线图
4 讨论
关于刺五加的发酵,大多集中在采用微生物发酵法提高刺五加中黄酮[22]、多糖[23]及刺五加苷[24]等成分含量,但作为刺五加膏的指标性成分异嗪皮啶[25],虽有报道采用微生物发酵法提高其含量,但并未对其进行发酵工艺的优选,而提高发酵产物得率的重要方法是对其发酵工艺进行优化[26],虽然采用单因素实验结合正交实验法可以对发酵工艺中的影响因子进行优化,但正交实验结果往往不能超过其所设计的范围,不能进一步指明最佳发酵工艺的走向,具有一定的局限性;而微生物发酵是一种非结构化、曲线的复杂过程[27],响应面法通过Box-Behnken实验设计,采用回归方程和直观图形分析,合理预测响应值的最优值[28],在一定程度上满足了各种工业生产对工艺参数的需求,现已成为时下研究的应用热点,并被广泛应用于食品[29]、医药[30]、化工[31]、生态学[32]等领域。
笔者采用单因素实验结合响应面法对刺五加发酵工艺中重要工艺参数进行优选,并对所筛选的工艺进行实验验证,结果表明,最佳发酵工艺能显著提高发酵刺五加中异嗪皮啶的含量,在该工艺条件下,异嗪皮啶含量可达(0.6629±0.0007)mg/g,是已有工艺[12]的3倍。

