大兴安岭森林凋落物的活性真菌及其代谢产物研究
邱天艺,徐 悦,甄锦程,司 璐,于洪佳,穆玉婷,徐利剑
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
现在地球上已知的真菌已经超过14万种[1],真菌是重要的天然资源,可以应用在抗菌和纤维素降解等领域[2-5]。在森林中有大量的凋落物,凋落物的降解依赖于凋落物真菌及其他微生物,所以森林凋落物也被认为是良好的真菌栖息地。在大兴安岭森林凋落物中有着丰富的且未被开发利用的真菌资源,本研究力求为这些资源的利用打下基础。
森林凋落物包括植物枯根、树林下枯死的一年生二年生草本植物和整个森林中树木干枯的树枝、败叶、树皮和其他繁殖器官[6]。凋落物给真菌提供有机质,真菌可以将有机质分解。大兴安岭地处中国高纬度寒区,属于多年冻土带南部,是中国保存最好、面积最大的原始森林[7]。刘博洋等[8]利用颗粒法在大兴安岭森林凋落物分离了40株真菌,其中有6株为未培养过真菌,有2株真菌的发酵产物具有抗细菌活性,还有2株真菌的提取物具有DPPH清除自由基活性。李泽宇等[9]在大兴安岭地区多年冻土样品中分离得到可培养真菌66株,隶属于55个分类单元,有5株为耐冷真菌,6株表现出抗菌活性,有1株表现出抗氧化活性和纤维素降解活性,并首次发现了Seltsamia属真菌具有抗氧化和纤维素降解活性。张哲栋等[10]在大兴安岭地区中分离了88株真菌,测试了18株ITS相似性≤97%的真菌的抗菌活性,从KNFL008和KNFL040中分离到4个化合物,其中2个化合物是第一次在真菌中分离得到。纤维素是植物的重要组成成分,广泛分布在自然界中,是地球重要的可再生资源[11]。纤维素作为大分子有机物经过简单的燃烧,利用率极低同时污染环境;若有效的将其降解不仅可以能源再利用,还可以减少环境污染[12-14]。最常被报道的3种可以降解纤维素的真菌分别为:青霉(Penicillium)属、木霉(Trichoderma)属和曲霉(Aspergillus)属,相比之下新发现的真菌很少被报道纤维素降解活性[9]。
在大兴安岭森林凋落物有着丰富的真菌资源,而且真菌具有抗菌活性和纤维素降解活性,本研究目的在于为大兴安岭真菌资源的利用提供备选菌株。以大兴安岭凋落物为研究对象,尝试对来自凋落物中的未培养真菌进行分离鉴定,筛选出具有抗菌或降解纤维素活性的菌株,并且分离活性真菌的代谢产物,为其进一步深入的研究打下基础。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 森林凋落物样品来源于中国东北部大兴安岭林区(位于53°19′N,124°31′E),该批样品于2019年9月采集,利用5点采样法[15]进行样品的采集,将该采集地自下而上分为3层,分别为分解层、半分解层和未分解层[16],每层深度为3~5 cm。采集后放入提前灭菌的信封中。
1.1.2 试验试剂 马铃薯葡萄糖固体培养基(PDA),200 g土豆煮沸20 min滤液,20 g葡萄糖,17 g琼脂,加入蒸馏水定容至1 L;LB液体培养基(LB),10 g胰蛋白胨,5 g氯化钠,5 g酵母浸粉,加入蒸馏水定容1 L;马铃薯葡萄糖液体培养基(PDB),200 g土豆煮沸20 min滤液,20 g葡萄糖,加入蒸馏水定容至1 L;LB固体培养基
(LBA),10 g胰蛋白胨,5 g氯化钠,5 g酵母浸粉,17 g琼脂,加入蒸馏水定容至1 L;酵母浸提物蔗糖培养基(YES),150 g蔗糖,20 g酵母浸粉,0.5 g七水硫酸镁,0.01 g七水硫酸锌,0.005 g五水硫酸铜,加入蒸馏水定容至1 L。羧甲基纤维素钠培养基(CMC-Na),15 g羧甲基纤维素钠,10 g蛋白胨,5 g氯化钠,5 g酵母浸粉,1 g磷酸二氢钾,0.2 g七水硫酸镁,琼脂20 g,加入蒸馏水定容至1 L。
1.1.3 供试微生物 抗菌活性测试所用微生物为:水稻黄单胞水稻致病变种(Xanthomonas oryzaepv.Oryzae),青枯劳尔氏菌(Ralstonia solanacearum)和串珠镰刀菌(Fusarium moniliforme)。
1.2 试验方法
1.2.1 样品处理 称取10 g凋落物样品,粉碎后用无菌水清洗离心3次,再加入30 mL的无菌水混悬,将颗粒悬浮液加入稀释4倍PDA培养基中;涂布均匀后,放置于恒温培养箱中培养,每12 h观察一次,在体式显微镜下挑出萌发出的真菌菌落,转接到60 mm PDA培养基上培养纯化。
1.2.2 真菌分子生物学初步鉴定 利用CTAB法提取分离得到的真菌总DNA,然后扩增其内部转录间隔区(Internal Transcribed Spacer,ITS)的序列,以 ITS1 和ITS4作为引物,其中PCR扩增的体系和条件参见Liang等[17]的方法。ITS序列利用BLAST[Basic Local Alignment Search Tool,(https://blast.ncbi.nlm.nih.gov/)]工具与数据库中的菌种序列进行比对分析。再利用Mega X软件对真菌DNA序列进行系统发生学分析。利用Clustal W工具进行序列比对。测试最优模型后,利用最大似然法(Maximum Likelihood,ML)进行系统发生分析。
1.2.3 菌株的发酵及其粗提物的制备 将菌丝块接种于PD液体培养基中,在180 r/min,27℃条件下振荡培养4天。按照3%的接种量将发酵液接种于YES+蛭石培养基,在27℃培养箱中静止放置培养21天。待发酵结束后,加入1.5倍体积的乙酸乙酯,浸没静止放置12 h。乙酸乙酯滤液减压浓缩得到提取物,加入1 mL 10%的二甲基亚砜(Dimethyl sulfoxide,DMSO),放入4℃冰箱中保存。
1.2.4 抗菌活性测定 抗菌活性筛选均采用打孔药剂扩散法[18],在合适温度下,将10 mL测试菌液加入到无菌培养基中,摇匀倒入培养基中,冷却凝固后,用无菌打孔器均匀的打6个孔。在每个孔中加入10 μL的金霉素(阳性对照)、提取物液或10%DMSO水溶液(溶剂对照)。放入27℃培养箱中,3次重复。对于抗丝状真菌活性的筛选,把带有测试菌液的固体培养基换成无菌的PDA培养基,然后在培养基的正中央接入丝状真菌,以两性霉素b为阳性对照。
1.2.5 纤维素活性降解初步筛选 采用刚果红染色法[19]对真菌的纤维素酶降解活性进行了初步筛选。将菌饼接种至羧甲基纤维素钠(CMC-Na)培养基正中间,将其置于27℃生化培养箱中培养96 h后,再倒入15 mL的1 mg/mL刚果红溶液对CMC-Na培养基染色60 min后倒出染液,并用蒸馏水冲洗,再加入15 mL的1 mol/L NaCl溶液静置40 min,以达到脱色的目的。观察菌落生长情况、水解圈的大小和透明程度,并用D(cm)表示水解圈的直径,d(cm)表示菌落的直径,以D/d表示纤维素降解活性的能力大小。
1.2.6 活性物质分离 对目标菌株进行大量发酵,发酵体积为2 L,并制备乙酸乙酯提取物,称取和提取物相同重量的100~200目硅胶与其搅拌均匀,烘干。称取粗提物20倍重量的200~300目硅胶填装在正相硅胶柱中,然后干法上样。使用二氯甲烷和甲醇进行梯度洗脱,每个梯度分别洗脱1 L,减压浓缩后得到正相硅胶柱分离组分。对正相硅胶柱分离组分进行活性追踪。然后,葡聚糖凝胶柱(Sephadex-LH20)分离,洗脱液为二氯甲烷和甲醇1:1。再使用半制备型高效液相制备单体化合物。将单体化合物进行核磁共振分析(Nuclear Magnetic Resonance,NMR),结合相关文献,推定化合物的结构。
2 结果与分析
2.1 菌株鉴定分离结果
本研究一共分离得到76株真菌,经过GenBank上的ITS序列比对,发现76株真菌的最相近菌隶属于3个门,9个纲,15个目,25个科,59个分类单元。其中有覆盖率在99%及以上的、相似度在98.5%以下的真菌有21株,见表1。
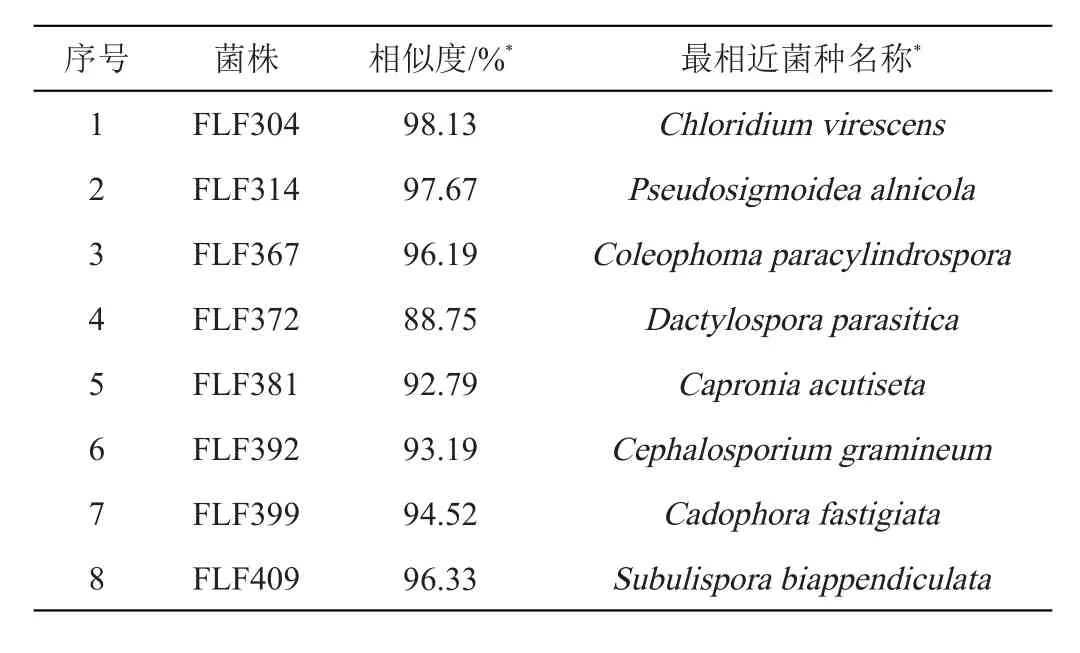
表1 真菌相似度
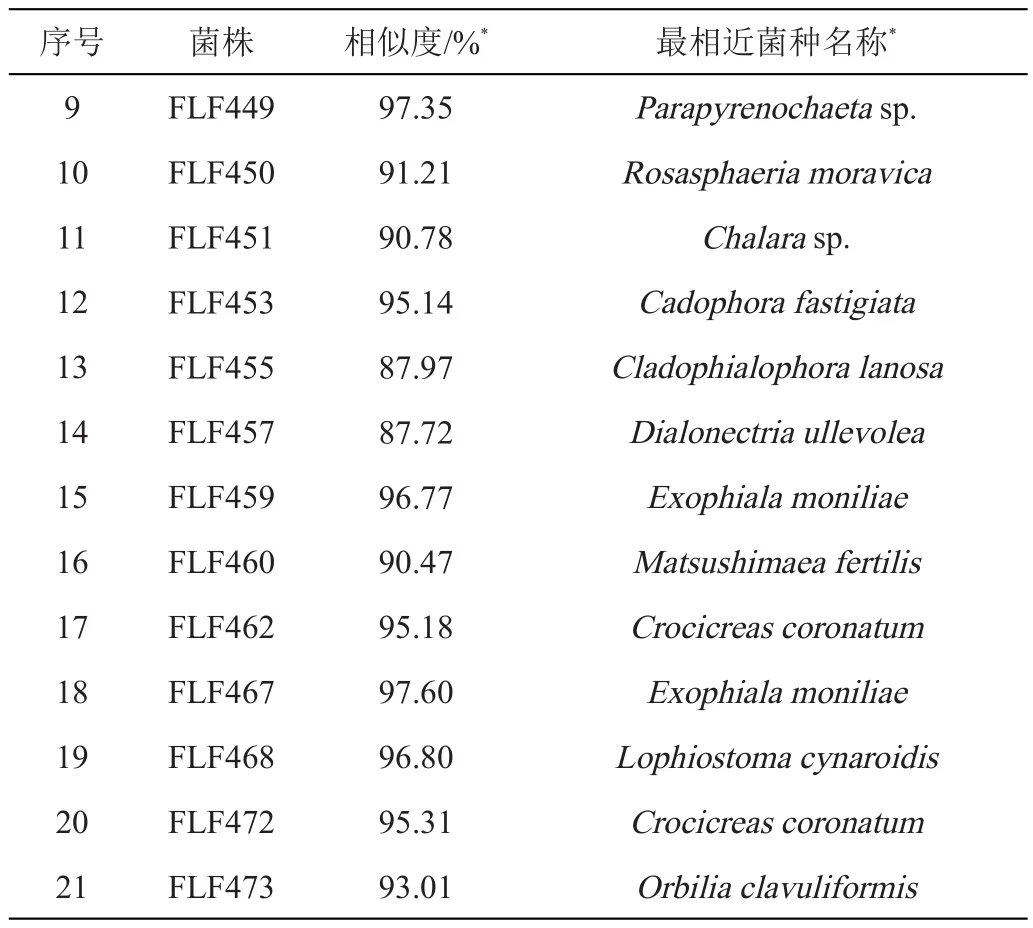
续表1
2.2 菌株提取物活性测试
对21株ITS相似性≤98.5%菌种的乙酸乙酯提取物进行抗菌活性测定,其中7株真菌表现出至少对1株测试菌表现出抑菌活性,如表2。通过对比发现FLF409的提取物对水稻黄单胞水稻致病变种和青枯劳尔氏菌都有较强的活性;因此,选择FLF409进行高效液相色谱分析进行单体化合物的分离与纯化。
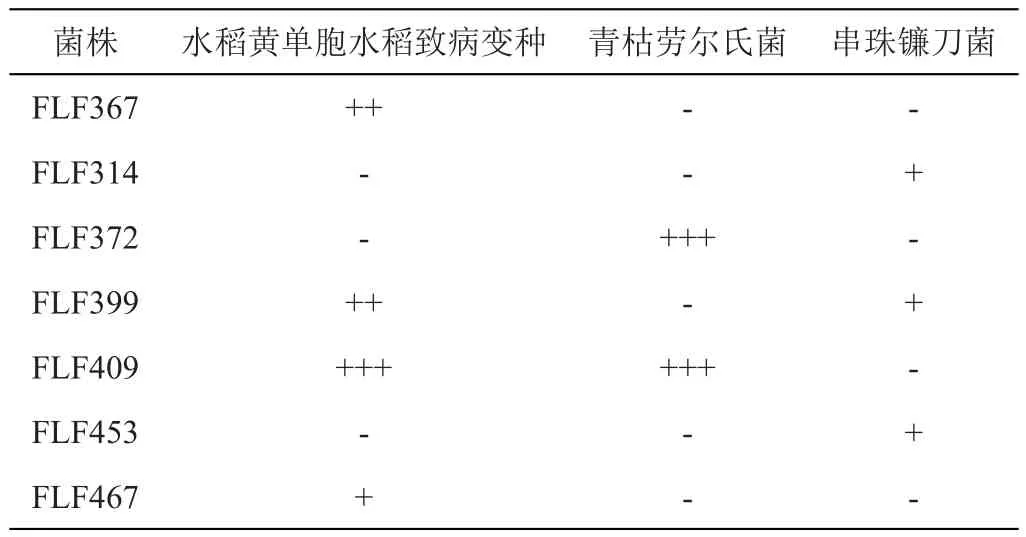
表2 菌种粗提物抗菌活性筛选
2.3 真菌纤维素降解活性初筛
利用刚果红染色法对分离得到的21株新型真菌进行降解纤维素活性的定性测试,形成的降解圈较明显清晰,其菌落直径、水解圈直径大小和降解能力见表3,说明4株真菌具有纤维素降解活性。FLF468的降解纤维素活性最好,降解圈与菌落直径比值为1.87,FLF367和FLF449次之。
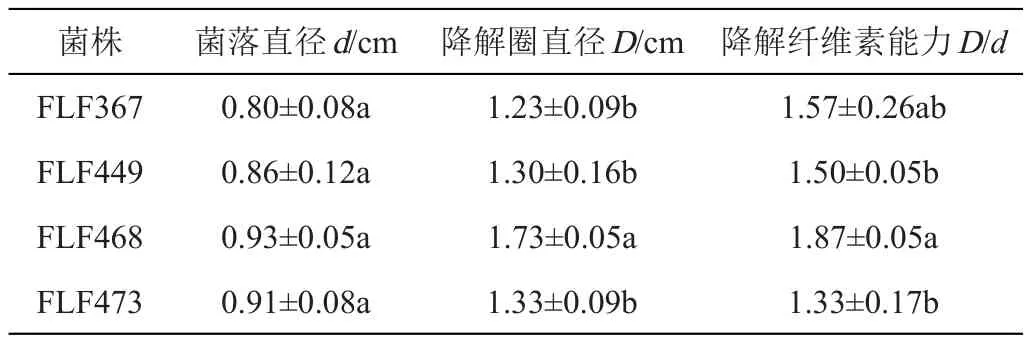
表3 真菌降解纤维素的活性
2.4 代谢物的分离与鉴定
2.4.1 菌株FLF409代谢物的分离与鉴定 FLF409的最相近菌种为子囊菌门的Subulispora biappendiculata。将得到的8 g乙酸乙酯提取物,经正向硅胶柱层析洗脱,共得到16个组分,利用TLC和HPLC分析结果,对分离组分进行合并。组分经过Sephedax LH-20柱层析分离和半制备型高效液相色谱分离,得到了1个单体化合物,记为FLF409A。
FLF409A是白色晶体,易溶于二氯甲烷、甲醇和氯仿等有机试剂。其碳谱的化学位移值为:δ 135.37、132.19、117.55、75.97、73.69、67.74、56.00、54.77、43.78、43.49、42.82、40.4、39.49、39.23、37.15、33.09、32.98、30.88、27.91、22.90、22.06、21.12、19.95、19.65、18.85、17.59、12.34。通过和文献中的波谱数据进行对比后,发现该化合物的1H-NMR、13C-NMR与文献[20]中的波谱数据基本一致,推定FLF409A为6,9-表氧基-7,22-烯-3-麦角甾醇(分子式为C28H44O2),其结构如图1所示。
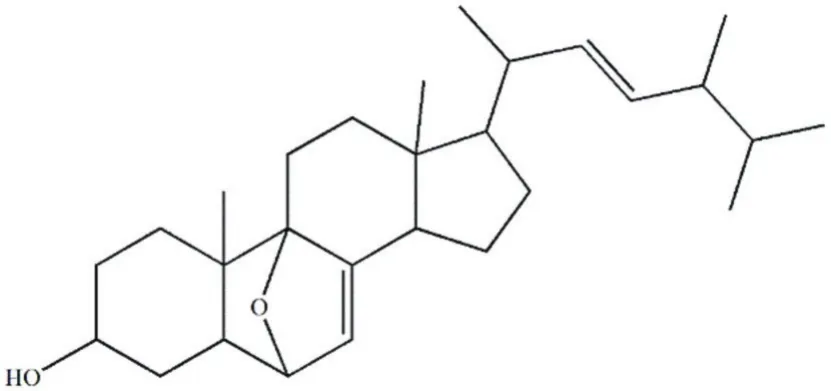
图1 化合物FLF409A的结构图
2.4.2 菌株FLF449代谢物的分离与鉴定 FLF449菌隶属于Parapyenchaeta属,经文献查阅至今为止该属尚未被分离鉴定过代谢物。所以本研究尝试对其主要代谢物进行分离纯化。经大量发酵,得到乙酸乙酯提取物5 g。经过分离和纯化后,鉴定了1个单体化合物,记为FLF449A。
FLF449A是白色晶体,易溶于甲醇。其碳谱的化学位移值为:δ 170.46、158.8、157.40、140.23、135.70、106.57、100.85、81.33、69.48、60.87、18.12。通过和文献中的波谱数据进行对比后,发现该化合物的1HNMR、13C-NMR与文献[21]中的波谱数据一致,推定FLF449A为4,6,8-三羟基-7-甲氧基-3-甲基二氢异香豆素(分子式为C11H12O6),结构如图2所示。

图2 化合物FLF449A的结构图
2.5 FLF449号菌株的鉴定
该菌的形态学特征与其ITS最相近菌属Parapyenchaeta菌属特征描述吻合。Parapyenchaeta属建立于2018年,目前该属包含2个物种:P.acaciae和P.protearum[22]。
FLF449菌株在PDA培养基上,培养14天,菌落直径23 mm;菌落表面为白色到灰色,菌落背部为黄色至白色,有橄榄色的斑块(如图3);菌落呈圆形,扁平及羊毛状,具有不规则凹槽,边缘规则,有气生菌丝,分生孢子器呈黑色至深棕色在菌丝内,分生孢子椭圆形至圆柱形。刘博洋[23]分离并研究的SGSF130具有以下特征:在PDA培养基上,SGSF130菌落正面灰白色或绿白色,背面深绿色;而分生孢子器为深棕色球形,卵圆形或近圆柱形分生孢子。FLF449和SGSF130相似而又不同,从形态学上看它们是同为一个属的不同真菌。同时,进行了系统发生分析(如图4),FLF449与Parapyenchaeta属2个已知物种的最为相近,位于它们形成的单系群的基部,获得了81%的支持率,结合FLF449号菌株的分生孢子器以及菌落特点,推断FLF449号菌株可能为Parapyenchaeta属新物种。
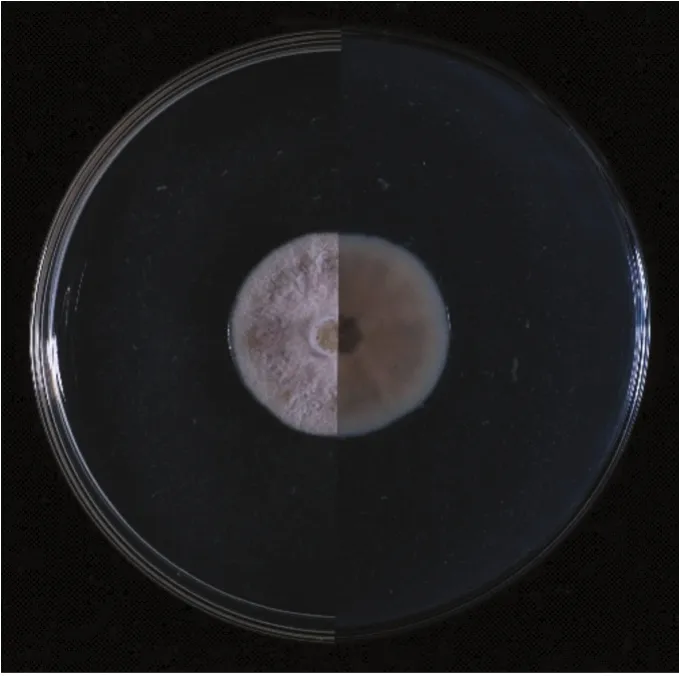
图3 FLF449菌落形态(PDA培养基正反面)
3 讨论与结论
前人有关兴安岭凋落物真菌的研究[8,10,23],多集中在对其抗菌活性的研究,而本研究在测定抗菌活性的同时,增加了纤维素降解活性的研究,发现了1株真菌(FLF367)同时具有抗菌与纤维素降解活性。本试验尝试分离鉴定2株凋落物真菌FLF409与FLF449的次生代谢产物,共得到2个单体化合物。FLF409最相近菌种为Subulispora biappendiculata,未见有关该菌种的次生代谢的报道,本研究为首次分离该物种的代谢物。6,9-表氧基-7,22-烯-3-麦角甾醇,该天然产物最初分离于石斛小菇中[24],也曾在韧革菌(Stereumsp.)和蜜环菌(Armillaria mellea)的相关研究中发现该天然产物[25-26]。菌株FLF449最相近菌种是Parapyenchaeta acaciae。Parapyenchaeta属建立于2018年,目前包含两个物种。刘博洋[23]也曾在大兴安岭凋落物中分离过Parapyenchaeta属真菌,说明大兴安岭凋落物中富含该属真菌,但FLF449在ITS序列及其分生孢子器的形态上与刘博洋发现的真菌及两个该属已知物种不同,说明FLF449为该属新发现菌株。目前未见Parapyenchaeta属的代谢物的相关研究。本研究首次研究Parapyenchaeta属的天然产物,从其发酵物中分离到聚酮类化合物4,6,8-三羟基-7-甲氧基-3-甲基二氢异香豆素,该化合物首次分离于柱顶孢霉(Scytalidium)属真菌,被命名为lignicol[27]。同时本研究测试了21株新型真菌的纤维素降解活性,发现了4株具有纤维素降解活性。本研究发现Lophiostoma属、Coleophoma属、Parapyrenochaeta属和圆盘属(Orbilia)有降解纤维素的活性。其中Parapyrenochaeta属真菌的纤维素降解活性为首次发现。
本研究共分离得到76株真菌,其中有21株为疑似新菌种。7株有抗菌活性,4株具有纤维素降解活性,共分离得到2个单体化合物。本研究说明大兴安岭凋落物中可培养真菌资源丰富,其中不乏具有活性的可培养真菌,通过进一步的研究,有望为真菌资源的开发利用提供备选菌株。

