外源茉莉酸甲酯对盐胁迫下菜用甘薯生长生理的影响
王建伟 许光龄 陈艳丽 朱国鹏 陈玥 刘金伟










摘 要:为探讨盐胁迫下叶面喷施茉莉酸甲酯对菜用甘薯生长生理的影响,以海大7791菜用型甘薯为试验材料,在水培条件下,以150 mmol·L NaCl模拟盐胁迫,设置浓度分别为0(CK)、75、150、225 μmol·L茉莉酸甲酯(MeJA)4个处理。结果表明,与对照相比,75和150 μmol·L MeJA处理的甘薯叶干质量、茎干质量、茎尖产量及叶绿素a、b和总含量,以及抗氧化酶SOD、POD、CAT活性均显著提高,而叶片相对电导率和丙二醛含量显著下降;其中,150 μmol·L MeJA处理的甘薯叶片F/F、可溶性蛋白、可溶性糖和脯氨酸含量均显著提高。综合分析表明,叶面喷施75、150 μmol·L MeJA的菜用甘薯分别在生长和生理表现较优,应用隶属函数客观评价,叶面喷施150 μmol·L-1 MeJA缓解菜用甘薯盐胁迫的效果最好。
关键词:菜用甘薯;茉莉酸甲酯;盐胁迫;生长生理
中图分类号:S531 文献标志码:A 文章编号:1673-2871(2022)06-069-07
Exogenous methyl jasmonate affects growth and physiology of leafy sweet potato under salt stress
WANG Jianwei, XU Guangling, CHEN Yanli, ZHU Guopeng, CHEN Yue, LIU Jinwei
(Key Laboratory for Quality Horticultural Plants of Hainan Province/Horticulture College of Hainan University, Haikou 570228, Hainan, China)
Abstract: In order to explore the effect of foliage spraying methyl jasmonate (MeJA) on the growth and physiology of leafy sweet potato under salt stress, HD 7791 were used as materials under hydroponic environment containing 150 mmol·L NaCl. Four treatments included 0, 75, 150, 225 μmol·L MeJA. The results showed that, compared with the control, leaf dry weight, stem dry weight, yield, content of chlorophyll a and b, antioxidant enzyme activities were significantly increased for 75 and 150 μmol·L MeJA treatments, and the content of malondialdehyde and relative conductivity of leaves were significantly reduced. The content of soluble protein, soluble sugar, proline and F/F were significantly increased for 150 μmol·L MeJA treatment. Comprehensive analysis showed that leafy sweet potato treated with 75 μmol·L MeJA had better growth, and treated with 150 μmol·L MeJA had better physiological responses. The 150 μmol·LMeJA treated leafy sweet potato grow the best under salt stress by membership functions analysis.
Key words: Vine-vegetable sweet potato; Methyl jasmonate; Salt stress; Growth and physiology
甘薯[Ipomoea batatas (L). Lam.]是旋花科甘薯属一年生作物,其用途广泛,可作为粮食、蔬菜、饲料、工业原料和生物能源。菜用型甘薯以茎蔓顶端生长点以下长15 cm左右鲜嫩部分为食用部分,包括叶片、叶柄、嫩茎,富含维生素、粗纤维、蛋白质、矿質元素和多酚等,其营养价值和保健价值高于大多数叶菜[1]。随着人们生活水平的提高和消费观念的转变,菜用甘薯越来越受到人们的青睐,市场需求也日趋增大。菜用甘薯生长快且适应性强,扩大菜用甘薯种植规模对于缓解海南夏秋季(高温,高湿,间有台风侵袭)蔬菜生产困难、供应紧张等局面具有重要意义。
海南岛部分沿海滩涂由含盐量高导致农业土地利用率低,夏秋季多台风暴雨,海水倒灌时有发生,土地盐渍化问题突出。土地盐渍化是限制植物生产力的决定性环境因素之一[2]。土壤中过多的盐分影响植物的光合作用[3-4],对植物造成渗透胁迫[5-6]、离子毒害和营养失衡[7-8]以及氧化伤害[9]等,从而抑制植物的生长发育。茉莉酸甲酯(MeJA)是一种新型的植物生长调节剂,与植物的抗逆性密切相关[10],能通过保护植物的光合系统[11]、提高抗氧化酶活性[12-13]和提高渗透调节物质的含量[14]等缓解植物受到的逆境伤害。Manan等[15]研究表明,MeJA能显著增加盐胁迫下番茄叶片叶绿素含量,并显著提高其光合作用效率;山雨思等[16]研究表明,MeJA能显著提高盐胁迫下颠茄的可溶性糖、可溶性蛋白和脯氨酸等渗透调节物质的含量。Labiad等[17]研究表明,叶面喷施MeJA能显著促进水培NaCl胁迫下海茴香对营养元素钾、钙的吸收。Ji等[18]研究指出,外源MeJA能显著提高盐胁迫下玉米叶片抗氧化酶活性,降低活性氧的产生速率,维持氧化还原稳态。
前人对外源物质如褪黑素[19]、脱落酸[20]、钙[21]等提高甘薯耐盐性有一定的研究,但有关MeJA对菜用甘薯耐盐性的研究尚未见报道。笔者以菜用甘薯海大7791为材料,在浓度为150 mmol·L-1 NaCl的水培环境下,探究叶面喷施MeJA对菜用甘薯生长生理的影响,以期为利用MeJA缓解非生物胁迫损伤提供科学依据,为提高菜用甘薯非生物抗性提供新的技术手段,也为有效地利用海南岛沿海滩涂和盐碱地进行菜用甘薯规模高效栽培生产提供理论依据和技术指导。
1 材料与方法
1.1 材料
供试材料为菜用甘薯品系海大7791,由海南大学甘薯研究团队选育。
1.2 方法
试验于2020年12月在海南大学园艺学院教学基地锯齿形温室大棚进行。采用水培方式,水培容器为66 cm×41 cm×18 cm的32孔塑料箱,覆盖带有小孔的泡沫板,孔距8 cm×8 cm,每孔种植1株甘薯苗,以自然光提供光源,营养液选用日本园试通用配方。选取长势基本一致的健壮茎尖苗,留取幼苗3叶1心,定植于小孔中,培养15 d后,向营养液中添加150 mmol·L NaCl,同时,每天08:00和18:00,叶面喷施分别为0(对照)、75、150、225 μmol·L的MeJA溶液进行处理,喷至叶面湿润即可,各处理3次重复,每次重复为1个水培箱,随机区组排列。连续喷施3 d后,取样测定。试验过程中使用充氧泵进行人工充氧,每3 d更换1次营养液,以保持营养液中盐浓度的一致性。
1.3 测定指标及方法
用1/1000天平称量植株干鲜质量;剪取茎尖以下12 cm部分用1/100天平称量茎尖产量。
采用乙醇研磨法[22]测定叶绿素含量;利用PAM-2500便携式调制叶绿素荧光仪测定幼苗第4位叶(由上至下)的叶绿素荧光参数,各参数的意义及计算参照PAM-2500使用手册。采用电导率仪法[23]测定相对电导率;采用硫代巴比妥酸比色法[22]测定丙二醛(MDA)含量。采用紫外吸收法[22]测定过氧化氢酶(CAT)活性;采用愈创木酚法[22]测定过氧化物酶(POD)活性;采用NBT还原法[22]测定超氧化物歧化酶(SOD)活性。采用蒽酮比色法[22]测定可溶性糖含量;采用考马斯亮蓝法[22]测定可溶性蛋白含量;采用酸性茚三酮比色法[22]测定游离脯氨酸(Pro)含量。
1.4 数据分析
使用Microsoft Excel 2019和SPSS 22对数据进行整理和方差分析(Duncan’s新复极差法),并用隶属函数法对各处理菜用甘薯的耐盐性进行综合评价。隶属函数值计算公式:F(X)=(X-X)/(X-X);若某一指标与菜用甘薯产量呈负相关(相对电导率、丙二醛含量),则使用反隶属函数值计算公式:F(X)=1-(X-X)/(X-X)。式中,F(X)表示隶属函数值,X表示i指标的平均值,X表示i指标的最大值,X表示i指标的最小值,累加每个指标的隶属函数值并计算平均值,隶属函数值越大,耐盐能力越强。
2 结果与分析
2.1 外源MeJA对盐胁迫下菜用甘薯干、鲜质量和茎尖产量的影响
由表1可以看出,与对照相比,75 μmol·L MeJA处理甘薯的根鲜质量、叶干质量、茎干质量、根干质量均显著增加,150 μmol·L MeJA处理甘薯的叶干质量、茎干质量均显著增加,225 μmol·L MeJA处理甘薯的各组织干鲜质量与对照无显著性差异;其中75 μmol·L MeJA处理甘薯在叶干质量、根鲜质量和干质量均显著高于150 μmol·L MeJA处理,在根鲜质量、叶和茎干质量均显著高于225 μmol·L MeJA处理,而150和225 μmol·L MeJA处理的各组织干鲜质量均无显著性差异。
由图1可知,盐胁迫下,外施MeJA处理的甘薯茎尖产量均高于对照组,其中75、150 μmol·L MeJA处理与对照组相比差异显著,分别比对照提高10.13%、13.66%,但二者之间无显著性差异,而225 μmol·L MeJA处理的甘薯茎尖产量与各处理无显著性差异。
2.2 外源MeJA对盐胁迫下菜用甘薯葉绿素含量和叶绿素荧光特性的影响
由表2可以看出,盐胁迫下,随着外施MeJA浓度的增加,各处理叶绿素含量均呈现先上升后下降的趋势。与对照组相比,75、150 μmol·L MeJA处理的甘薯叶片中叶绿素a含量显著增加,分别比对照增加38.27%、20.99%,各处理甘薯叶片中叶绿素b含量及叶绿素总量均显著增加。其中75 μmol·L MeJA处理的甘薯叶片中的叶绿素a、叶绿素b及叶绿素总量最高,且显著高于150、225 μmol·L MeJA处理,而150、225 μmol·L MeJA处理之间叶绿素a、叶绿素b及叶绿素总量均无显著性差异。
由表3可以看出,与对照组相比,150 μmol·L MeJA处理显著提高了PSⅡ最大光能转换效率F/F,但与75、225 μmol·L MeJA处理均无显著性差异;各处理的初始荧光F、最大荧光F、可变荧光F、PSⅡ潜在活性F/F与对照组差异不显著。
2.3 外源MeJA对盐胁迫下菜用甘薯叶片相对电导率和丙二醛含量的影响
由图2~3可以看出,随着外施MeJA浓度的增加,各处理甘薯叶片的相对电导率和丙二醛含量均呈先下降后上升的趋势。与对照相比,75、150 μmol·L MeJA处理的甘薯叶片相对电导率显著降低,外施MeJA各处理的甘薯叶片中丙二醛含量显著下降;其中150 μmol·L MeJA处理的甘薯叶片相对电导率和丙二醛含量最低,且显著低于225 μmol·L MeJA处理,而与75 μmol·L MeJA处理无显著性差异。
2.4 外源MeJA对盐胁迫下菜用甘薯抗氧化酶活性的影响
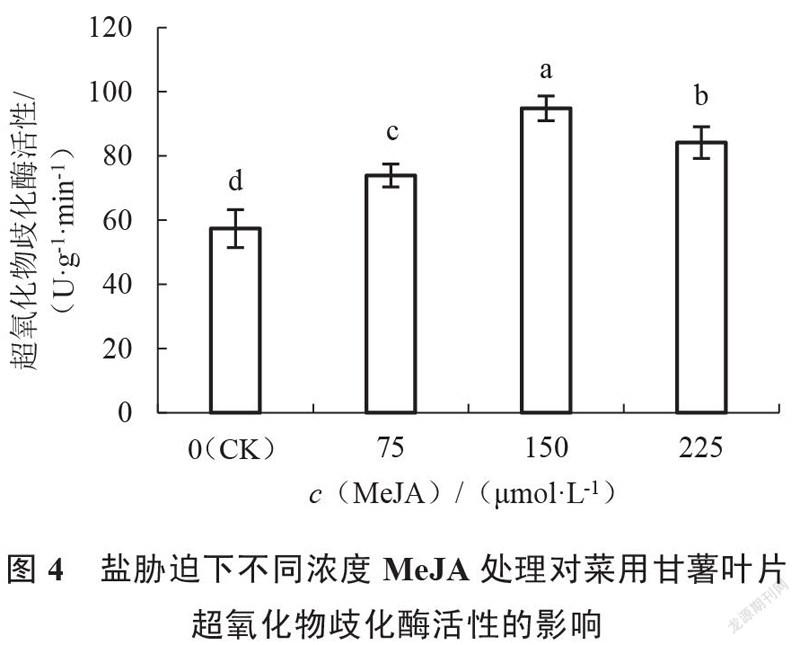
由图4~6可以看出,随着外施MeJA浓度的增加,各处理甘薯叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)活性均呈现先上升后降低的趋势,过氧化氢酶(CAT)活性呈现一直上升的趋势。与对照组相比,外施MeJA各处理的甘薯叶片中超氧化物歧化酶、过氧化物酶、过氧化氢酶活性均显著提高,其中150 μmol·L MeJA处理的甘薯叶片中超氧化物歧化酶和过氧化物酶活性均最高,且显著高于75、225 μmol·L MeJA处理;225 μmol·L MeJA处理的甘薯叶片中过氧化氢酶活性最高,但与75、150 μmol·L MeJA处理差异不显著。
2.5 外源MeJA对盐胁迫下菜用甘薯渗透调节物质含量的影响
由表4可以看出,盐胁迫下,外施MeJA处理增加了甘薯叶片中可溶性蛋白、可溶性糖和脯氨酸含量。与对照组相比,150 μmol·L MeJA处理的可溶性蛋白、可溶性糖和脯氨酸含量均显著增加,分别比对照提高39.42%、36.92%、22.04%,且脯氨酸含量显著高于75、225 μmol·L MeJA处理。
2.6 外源MeJA对菜用甘薯的隶属函数耐盐性评价
由表5可以看出,应用隶属函数法对所测各项指标进行综合分析,对各处理菜用甘薯耐盐能力大小的评定结果为150 μmol·L>75 μmol·L-1>225 μmol·L>0 μmol·L。其中,外施150 μmol·L MeJA處理的综合评价值最高,总值为12.70,75 μmol·L MeJA处理的综合评价值次之,为12.61。
3 讨论与结论
高盐胁迫下,植物体内积累了大量的Na和Cl,对植物产生毒害并破坏膜系统,导致植株失水,渗透压平衡被破坏,形成渗透胁迫;同时还存在氧化胁迫、活性氧代谢紊乱等情况,影响植物的正常生长发育。
光合作用是植物生长和发育的基础,为植物提供物质和能量。盐胁迫通过减少植物体内光合色素含量[24],破坏叶绿体功能,降低光合反应活性[25],光合作用受到抑制,导致植物不能正常生长与发育。植物体内叶绿素含量及叶绿素荧光参数与光合作用过程密切相关,前者是植物光合作用的重要基础,将捕获的光能转化为化学能;后者则反映了植物光合过程中电子传递情况及光化学活性等。叶绿素荧光参数中Fo的大小与色素含量及PSⅡ的损伤情况有关[26],F反映了通过PSⅡ的电子传递情况,F/F反映了PSⅡ的潜在光合活性,F/F反映了最大PSⅡ的光能转换效率且与逆境胁迫显著相关。本试验结果表明,叶面喷施MeJA显著提高了盐胁迫下菜用甘薯叶片叶绿素含量,其中75和150 μmol·L MeJA处理下的菜用甘薯叶片中叶绿素a、叶绿素b含量均显著增加,有效保护了菜用甘薯光合作用的基础,这与Manan等[15]和Yoon等[27]在番茄和大豆上的研究结果基本一致;其中,150 μmol·L MeJA处理下的Fv/Fm显著提高,有利于提高盐胁迫下菜用甘薯PSⅡ的光能利用效率,促进了有机物的合成和积累。75、150 μmol·L MeJA处理的叶干质量、茎干质量以及茎尖产量均显著增加,且75 μmol·L MeJA处理的根鲜质量和干质量也显著增加,与Labiad等[17]研究结果基本一致。
高盐胁迫下,植物体内活性氧(ROS)的产生与清除稳态遭到破坏,细胞ROS水平升高,膜脂氧化程度加剧,导致有毒产物丙二醛的积累和细胞膜损伤[28],改变膜透性,造成电解质外渗,相对电导率升高,严重时导致细胞死亡。SOD、POD、CAT是清除ROS的重要酶系统,并能减少羟基自由基的形成。本研究结果表明,叶面喷施MeJA后菜用甘薯叶片中SOD、POD、CAT活性均显著高于对照,其中150 μmol·L MeJA处理下的菜用甘薯叶片的SOD、POD活性最高。本试验条件下,各处理菜用甘薯叶片丙二醛的含量均显著降低,75、150 μmol·L MeJA处理甘薯叶片相对电导率显著降低,这与前人在玉米[18]、刺槐[29]、小麦[30-31]、白刺[32]上的研究结果基本一致。MeJA有利于维持体内氧化还原稳态,降低膜质过氧化程度,减少有毒物质的积累,保护细胞膜的结构和功能稳定,缓解了盐胁迫对菜用甘薯的伤害。
對于渗透胁迫,植物通常会积累一些如脯氨酸、可溶性糖、可溶性蛋白等[33]物质,在高浓度且不损害细胞正常生理状态的情况下降低胞内渗透势,保护生物大分子结构稳定。其中,可溶性糖能为植物生长发育提供能量;脯氨酸可以保护细胞结构和酶代谢等,防止质膜通透性变化、保护质膜完整和稳定膜结构;可溶性蛋白含量与酶活性密切相关,还能起到保护生物膜的作用。本试验结果表明,150 μmol·L MeJA处理下的菜用甘薯叶片中可溶性蛋白、可溶性糖和脯氨酸含量显著高于对照,这与前人在颠茄[16]、豌豆[34]上的研究结果类似。此外,由可溶性蛋白、可溶性糖和脯氨酸含量的增加幅度可以看出,各物质在渗透调节中的调节能力表现为可溶性蛋白>可溶性糖>脯氨酸,这与前人在水分胁迫下对各渗透物质调节能力大小的研究结论基本一致[35-36]。
本研究结果表明,外施MeJA能减轻盐胁迫对菜用甘薯光合系统的伤害、提高抗氧化酶活性和渗透调节物质含量,有利于维持体内活性氧代谢和渗透调节平衡,促进菜用甘薯有机物的积累,从而提高产量。盐胁迫下,外施75 μmol·L MeJA处理的甘薯各组织干鲜质量和叶绿素含量均高于150 μmol·L MeJA处理,其中叶干质量、根鲜质量和干质量、叶绿素含量差异达到显著性水平,而150 μmol·L MeJA处理的甘薯SOD、POD酶活性和脯氨酸含量显著高于75 μmol·L MeJA处理。植物耐盐的本质是盐胁迫下保持植物生长发育的能力,其耐盐机制复杂,单一方面的生长或生理指标都无法准确评价出各处理菜用甘薯的耐盐能力,而隶属函数法能在多个测定指标的基础上科学、客观地综合评价各处理菜用甘薯的生长发育状况,反映出各处理菜用甘薯的耐盐水平,因此采用隶属函数法综合分析生长和生理各项指标,结果表明,150 μmol·L MeJA处理的菜用甘薯综合耐盐能力最高。
参考文献
[1] 杨汉,黄志谋,刘伟,等.中国菜用甘薯开发利用现状与展望[J].湖北农业科学,2017,56(17):3201-3204.
[2] 范王涛.土壤盐碱化危害及改良方法研究[J].农业与技术,2020,40(23):114-116.
[3] JANDA T,DARKO E,SHEHATA S,et al.Salt acclimation processes in wheat[J].Plant Physiology and Biochemistry,2016,101:68-75.
[4] JIANG C Q,ZU C L,LU D J,et al.Effect of exogenous selenium supply on photosynthesis,Na+ accumulation and antioxidative capacity of maize(Zea mays L.)under salinity stress[J].Scientific Reports,2017,7:42039.
[5] RAHNAMA A,JAMES R A,POUSTINI K,et al.Stomatal conductance as a screen for osmotic stress tolerance in durum wheat growing in saline soil[J].Functional Plant Biology,2010,37(3):255-263.
[6] GEILFUS C M,TENHAKEN R,CARPENTIER S C.Transient alkalinization of the leaf apoplast stiffens the cell wall during onset of chloride salinity in corn leaves[J].Journal of Biological Chemistry,2017,292(46):18800-18813.
[7] WAKEEL A,FAROOQ M,QADIR M,et al.Potassium substitution by sodium in plants[J].Critical Reviews in Plant Sciences,2011,30(4):401-413.
[8] GARDNER W K.Sodium,calcium and magnesium ratios in soils of NW Victoria,Australia may restrict root growth and crop production[J].Journal of Plant Nutrition,2016,39(9):1205-1215.
[9] MILLER G,SUZUKI N,CIFTCI-YILMAZ S,et al.Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J].Plant,Cell & Environment,2010,33(4):453-467.
[10] ZHANG H,ZHANG Q,ZHAI H,et al.Transcript profile analysis reveals important roles of jasmonic acid signalling pathway in the response of sweet potato to salt stress[J].Scientific reports,2017,7:40819.
[11] FATMA M,IQBAL N,SEHAR Z,et al.Methyl jasmonate protects the PS II system by maintaining the stability of chloroplast D1 protein and accelerating enzymatic antioxidants in heat-stressed wheat plants[J].Antioxidants,2021,10(8):1216.
[12] KAYA C,UGURLAR F,ASHRAF M,et al.Methyl jasmonate and sodium nitroprusside jointly alleviate cadmium toxicity in wheat(Triticum aestivum L.)plants by modifying nitrogen metabolism,cadmium detoxification,and AsA-GSH cycle[J].Frontiers in Plant Science,2021,12:654780.
[13] CUI H W,YANG F F,LI Y F.Exogenous methyl jasmonate enhances lipid production in isochrysis galbana under nitrogen deprivation and high light[J].Algal Research-Biomass Biofuels and Bioproducts,2021,58:102406.
[14] REPKINA N,IGNATENKO A,HOLOPTSEVA E,et al.Exogenous methyl jasmonate improves cold tolerance with parallel induction of two Cold-Regulated(COR)genes expression in Triticum aestivum L.[J].Plants-Basel,2021,10(7):1421.
[15] MANAN A,AYYUB C M,PERVEZ M A,et al.Methyl jasmonate brings about resistance against salinity stressed tomato plants by altering biochemical and physiological processes[J].Pakistan Journal of Agricultural Sciences,2016,53(1):35-41.
[16] 山雨思,代欢欢,何潇,等.外源茉莉酸甲酯和水杨酸对盐胁迫下颠茄生理特性和次生代谢的影响[J].植物生理学报,2019,55(9):1335-1346.
[17] LABIAD M H,GIMENEZ A,VAROL H,et al.Effect of exogenously applied methyl jasmonate on yield and quality of salt-stressed hydroponically grown sea fennel(Crithmum maritimum L.)[J].Agronomy-Basel,2021,11(6):1083.
[18] JI B,LI Z,GU W,et al.Methyl jasmonate pretreatment promotes the growth and photosynthesis of maize seedlings under saline conditions by enhancing the antioxidant defense system[J].International Journal of Agriculture and Biology,2018,20(6):1454-1462.
[19] YU Y C,WANG A M,LI X,et al.Melatonin-stimulated triacylglycerol breakdown and energy turnover under salinity stress contributes to the maintenance of plasma membrane H+-ATPase activity and K+/Na+ homeostasis in sweet potato[J].Frontiers in Plant Science,2018,9:256.
[20] 肖強,王刚,衣艳君,等.外源脱落酸增强甘薯幼苗耐盐性的作用[J].植物营养与肥料学报,2016,22(1):201-208.
[21] 王刚,肖强,衣艳君,等.甘薯幼苗对NaCl胁迫的生理响应及外源钙的缓解效应[J].植物生理学报,2014,50(3):338-346.
[22] 李合生,陈翠莲,洪玉枝,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[23] 刘娅.LED补光与根际温度调控对越夏水培生菜再生生长的影响[D].海口:海南大学,2018.
[24] STEPIEN P,JOHNSON G N.Contrasting responses of photosynthesis to salt stress in the glycophyte arabidopsis and the halophyte thellungiella: role of the plastid terminal oxidase as an alternative electron sink[J].Plant Physiology,2009,149(2):1154-1165.
[25] APEL K,HIRT H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[26] 王正航,武仙山,昌小平,等.小麦旗叶叶绿素含量及荧光动力学参数与产量的灰色关联度分析[J].作物学报,2010,36(2):217-227.
[27] YOON J Y,HAMAYUN M,LEE S K,et al.Methyl jasmonate alleviated salinity stress in soybean[J].Journal of Crop Science & Biotechnology,2009,12(2):63-68.
[28] 段文学,张海燕,解备涛,等.甘薯苗期耐盐性鉴定及其指标筛选[J].作物学报,2018,44(8):1237-1247.
[29] JIANG M Q,XU F L,PENG M,et al.Methyl jasmonate regulated diploid and tetraploid black locust(Robinia pseudoacacia L.)tolerance to salt stress[J].Acta Physiologiae Plantarum,2016,38(4):106.
[30] QIU Z B,GUO J L,ZHU A J,et al.Exogenous jasmonic acid can enhance tolerance of wheat seedlings to salt stress[J].Ecotoxicology and Environmental Safety,2014,104:202-208.
[31] AVALBAEV A,ALLAGULOVA C,MASLENNIKOVA D,et al.Methyl jasmonate and cytokinin mitigate the salinity induced oxidative injury in wheat seedlings[J].Journal of Plant Growth Regulation,2020,40(4):1741-1752.
[32] GAO Z Q,GAO S,LI P X,et al.Exogenous methyl jasmonate promotes salt stress-induced growth inhibition and prioritizes defense response of Nitraria tangutorum Bobr.[J].Physiologia Plantarum,2020,172(1):162-175.
[33] RAHDARI P,TAVAKOLI S,HOSSEINI S M.Studying of salinity stress effect on germination,proline,sugar,protein,lipid and chlorophyll content in purslane(Portulaca oleracea L.)leaves[J].Journal of Stress Physiology & Biochemistry,2013,8(1):182-193.
[34] FEDINA I S,TSONEY T D.Effect of pretreatment with methyl jasmonate on the response of Pisum sativum to salt stress[J].Journal of Plant Physiology,1997,151(6):735-740.
[35] 蔡昆爭,吴学祝,骆世明.不同生育期水分胁迫对水稻根叶渗透调节物质变化的影响[J].植物生态学报,2008,32(2):491-500.
[36] 张智猛,戴良香,宋文武,等.干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响[J].作物学报,2013,39(1):133-141.

