重复经颅磁刺激治疗脑卒中后失眠疗效的meta分析
覃彬 高文 覃惠洵 覃城 杨明秀






[摘要]目的采用系统评价的方法评估重复经颅磁刺激(rTMS)对脑卒中后失眠(PSI)的有效性及安全性,以期为rTMS治疗PSI患者提供临床证据。方法计算机检索中国知网知识发现网络平台、万方医学数据库、维普网平台、PubMed和EMBASE数据库,检索时限均从建库至2021年7月31日,纳入关于rTMS治疗PSI的随机对照试验(RCTs)。由两名系统评价员独立筛选相关文献文题、根据数据提取表对符合文献提取数据,并对符合文献的方法学进行风险评估。采用RevMan5.3软件对符合的文献资料进行meta分析。结果最终纳入7项RCTs共纳入485例患者,其中rTMS组243例,对照组242例。meta分析结果显示:rTMS治疗组PSQI减分显著高于对照组[MD=-2.84,95%CI(-3.33,-2.35),P<0.00001];在不良反应发生率方面,rTMS治疗组与对照组比较,差异无统计学意义[OR=1.65,95%CI(0.31,8.83),P=0.56]。亚组分析结果显示,患者是否共病抑郁症及疗程不同时,rTMS组的PSQI减分均显著高于对照组,差异有统计学意义(P<0.05),与总体分析结果相同。结论rTMS可以改善PSI患者的睡眠质量,且安全性较好,值得临床推广应用。
[关键词]卒中;失眠症;经颅磁刺激;meta分析
[中图分类号]R743
[文献标识码]A
[文章编号]2095-0616(2022)11-0043-07
世界卫生组织(World Health Organization,WHO)发布的《2019年全球卫生估计报告》显示,脑卒中已成为全球第二大死亡和致残原因,约占总病死率的11%。脑卒中继续增加全球疾病负担,并对受影响的个人及其家人造成沉重经济和精神负担,脑卒中幸存者通常会遭受长期的后遗症,包括言语、吞咽、记忆、视觉空间和知觉的功能缺损、情感问题、日常活动困难和身体残疾[1-2]。脑卒中还会增加一些继发性疾病的风险,包括痴呆、骨折、心肌梗死、心律失常和心脏骤停[3-4],尤其是精神健康问题,如抑郁、焦虑和失眠[5-7]。失眠的常见临床表现主要有进入睡眠困难、维持睡眠困难、早醒、睡眠质量减低和睡眠总时间缩短,并伴有与睡眠相关的日间功能损害。脑卒中后失眠(post-stroke insomnia,PSI)是脑卒中患者中常见的并发症。最近的一项荟萃分析显示,PSI在脑卒中后极为常见,采用标准化的失眠诊断标准进行评估,脑卒中患者中PSI约占32.21%;如果仅评估失眠症状,这一比例会上升到40.70%[7]。此外有证据表明,脑卒中和睡眠之间存在双向关系[8]。失眠与脑卒中患者的病死率升高和生活质量显著降低有关[9],睡眠不良是脑卒中的风险因素,会恶化脑卒中预后[10]。在以前的研究中,患有慢性失眠的脑卒中患者比未患慢性失眠的脑卒中患者更容易出现抑郁、焦虑和致残,严重的失眠症状与抑郁和焦虑共病密切相关[7,11]。缺血性脑卒中会破坏睡眠结构和内源性昼夜节律,这也进一步表明脑卒中和睡眠是双向相关的。由于失眠是一个潜在的可改变的风险因素,因此解决PSI问题对于改善脑卒中预后非常重要。
药物为PSI的常见治疗方式。两项研究表明,最广泛使用的助眠药唑吡坦可能发挥神经保护作用并改善脑卒中恢复[12]。然而,在慢性脑卒中动物模型中的研究发现,它中和睡眠依赖性神经的可塑性[13],甚至增加了缺血性腦卒中的风险,特别是在大剂量用药时[14]。同样,苯二氮类等常见的助眠药在停药后也会出现各种副作用、依赖性和反弹症状。尽管失眠的认知行为疗法是一线非药物治疗,但对某些患者无效或不可用。因此,治疗PSI需要更有效和安全的治疗手段。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)作为非侵入性神经刺激和神经调节治疗技术,其主要原理是通过携带脉冲发生器产生的短暂且快速变化的强电流刺激线圈施加到目标皮质区域,因此,线圈内流动电流产生的强大磁场穿透颅骨并在颅内诱发电流,导致神经元或其轴突去极化,改变神经营养因子的表达,同时也对神经递质的释放产生重要影响,最终造成神经营养因子及神经内分泌系统发生改变,大脑形态变化和功能连接变化,甚至基因调控[15]。经rTMS已被应用于一些神经精神系统疾病,如抑郁症、帕金森病、焦虑症等,取得了较好的疗效。先前的研究发现rTMS对失眠症也有良好疗效。然而,rTMS在PSI的疗效目前尚存在争议,仍需进一步验证。因此,研究拟应用meta分析的方法对rTMS在治疗PSI的临床疗效和相关的安全性进行系统评价及分析,以期为PSI临床治疗提供依据。
1资料与方法
1.1研究类型
随机对照试验(randomized controlled trial,RCT)。
1.2研究对象
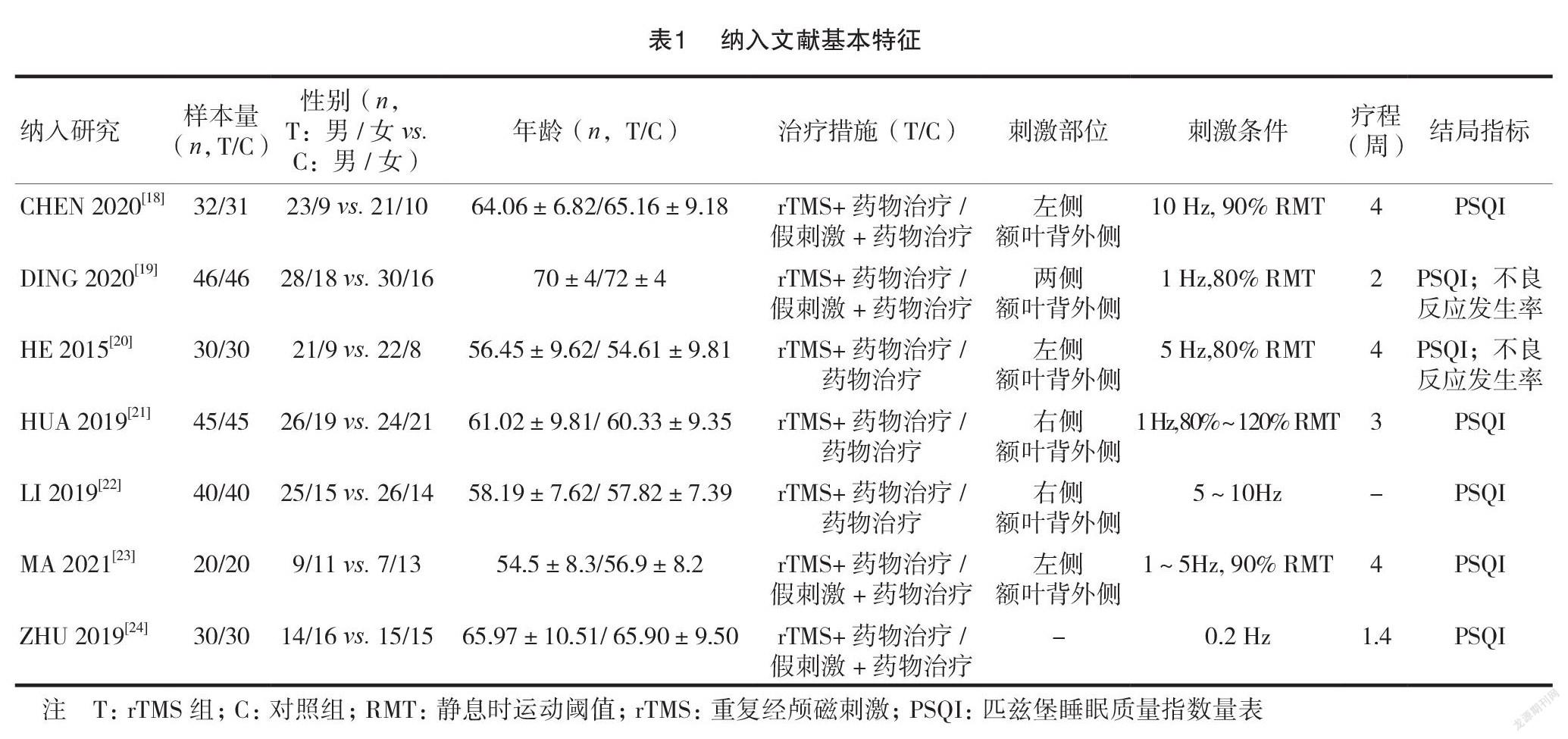
纳入的患者需符合第四届全国脑血管病会议制定的脑卒中诊断标准[16],且符合失眠症诊断标准的成年人(年龄>18岁),其性别、种族不限。1.3干预措施
rTMS组为rTMS单独或联合药物治疗,药物治疗包括助眠药及脑卒中基础药物治疗。对照组为假刺激或空白对照,可联合助眠药及脑卒中基础药物治疗。
1.4结局指标
1疗效指标:治疗前后采用匹兹堡睡眠质量指数量表(pittsburgh sleep quality index,PSQI)评估患者的睡眠质量,PSQI量表由19个自评和5个他评条目构成,总分为0~21分,>7分即为有睡眠障碍,得分越高表示睡眠质量越差[16];2不良反应,在整个研究过程中出现的任何不良情况(如头晕、头痛、恶心、心悸、乏力等)。
1.5排除标准
1中、英文以外语种的文献;2不同文题但来自同一研究结果的文献;3结果数据未提供或部分缺失,联系原作者也无法获取相关结果数据;4安装心脏起搏器、自动电复律除颤器、功能性神经刺激器、心脏支架、人工心脏瓣膜、动脉瘤术后金属夹或体内有其他金属植入者;5有特定睡眠疾病的患者;6其他不适合rTMS治疗或不能配合完成结果评估者。
2文献检索策略
计算机检索中国知网知识发现网络平台、万方医学数据库、维普网平台、PubMed和EMBASE数据库,搜集有关rTMS治疗PSI的RCTs,检索时限均从建库至2021年7月31日。通过查找纳入文献的参考文献条目,以补充获取是否有符合相关文献。检索方式应用自由词和主题词相结合的方式进行。中文检索词包括:“经颅磁刺激”“中风”“脑卒中”“脑梗死”“脑出血”“失眠”“睡眠障碍”等;英文检索词包括:“Transcranial Magnetic Stimulation”“TMS”“rTMS”、“stroke”“insomnia”“sleep”等。
2.1文献筛选与数据提取
由两名系统评价员独立筛选所获得的文献、提取资料及评估文献质量并交叉核对。如果两名系统评价员提取的数据存在不一致,则通过相互讨论协商或与第三位系统评价员讨论评判解决。文献资料初筛时先是查阅所获得的文献题目及摘要,在去除明显不符合的文献后,再深入仔细阅读初筛符合文献的全文以评估是否符合纳入标准。如必要时,通过电子邮件、电话联系文献主要作者或是通讯作者获得与本研究相关的一些重要资料及数据。文献数据提取表主要信息包括:1纳入文献的基本资料:文题、发表年份、作者信息、刊登的期刊名称等;2研究对象的一般特征资料和主要的干预措施及对照条件;3纳入研究的文献偏倚风险评估;4研究的主要结局指标和结果数据。
2.2纳入研究的主要偏倚风险评估
由2名系统评价员依据Cochrane手册5.1.0推荐的RCT偏倚风险评估工具独立评价纳入研究的偏倚风险,主要包含随机方法、分配隐藏、盲法、完整性数据报道、选择性报告、其他偏倚等,并交叉核对评估结果。2.3统计学分析
本研究应用统计分析软件Review Manager5.3软件对纳入研究的结果数据进行meta分析。二分类变量使用比值比(odd ratio,OR)作为评估效应的统计量,并提供其95%可信区间(confidence interval,CI)。连续性变量使用加权均数差(weighted mean difference,WMD)及95%可信区间(CI)进行统计分析。各研究间的异质性评估,本研究将使用χ2检验进行分析,当各研究间异质性低,即具同质性时(P≥0.05),采用固定效应模型(fixed effect model)的meta分析;当各研究间同质性差,即具有异质性时(P<0.05),则采用随机效应模型(random effect model)进行meta分析。若各研究结果间具有明显的异质性,则采用亚组分析(如是否共病抑郁症及不同疗程等)进一步分析异质性来源,并采用逐一剔除单个纳入RCT的方法进行敏感性分析检验研究结果的可靠性。
3结果
3.1文献筛选流程及结果
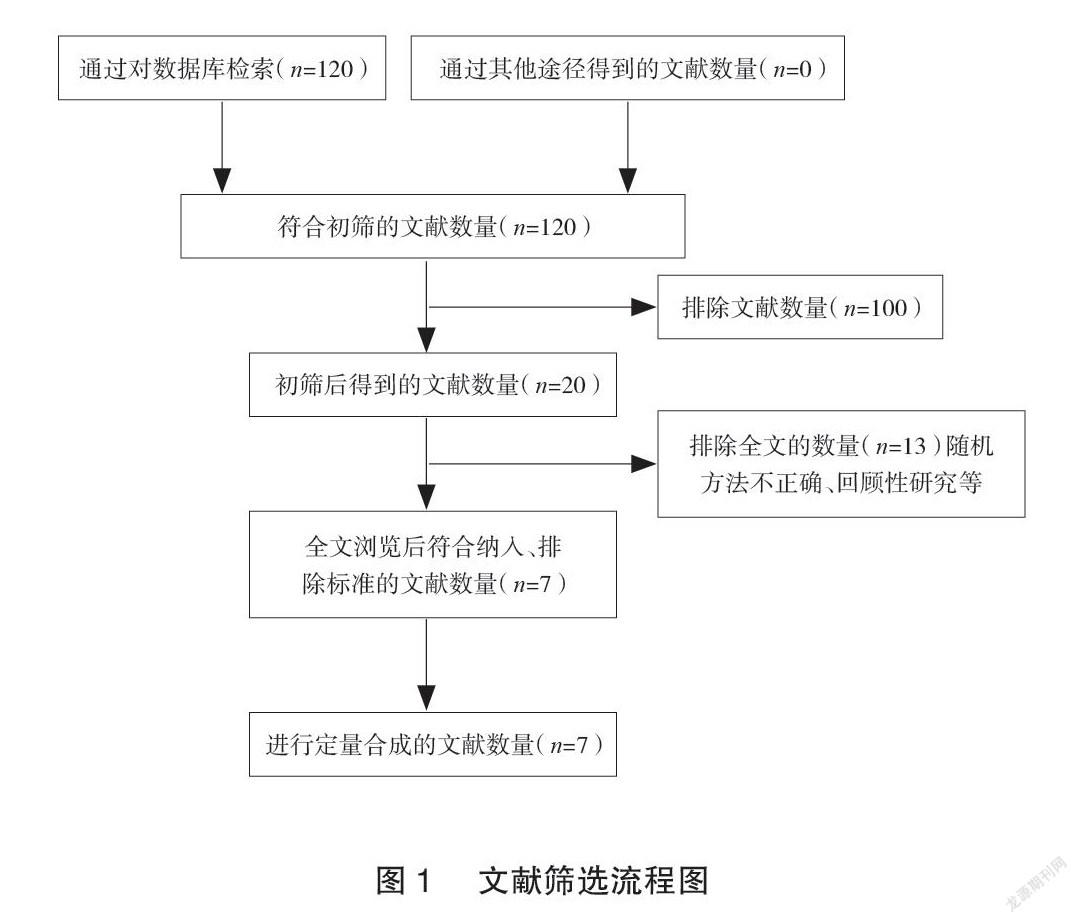
初步检出文献120篇,阅读文题及摘要后排除100篇不相关文献,进一步阅读初筛符合文献的全文后排除不符合纳入标准的文献13篇,排除的文献主要因为随机方法不正确、缺乏疗效评估结果、回顾性研究等,最终纳7项研究[17-24]。具体文献筛选流程,见图1。
3.2纳入研究的基本特征与偏倚风险评价结果
7项RCTs共纳入485例患者,其中rTMS组243例,对照组242例。纳入研究样本量40~92例,男女性别比为1.5∶1,年龄54~72岁。治疗时间1.4~4.0周。纳入的7项研究均说明为随机分组,其中6篇描述了具体的随机方法;纳入文献均为描述具体分配隐藏方案;两项研究描述为双盲的研究;选择性报告及数据完整性,多数研究未提供具体信息。因此,纳入研究质量水平多为中等质量。rTMS治疗参数及详细地纳入研究的基本特征见表1,偏倚风险评价详细结果见图2。
3.3meta分析结果
3.3.1PSQI评分共有7项研究[17-23]报道了两组治疗前后的PSQI评分,异质性检验提示:I2=29%,P=0.20,表明各研究之间无明显异质性,采用固定效应模型进行meta分析,结果提示:rTMS组的PSQI减分显著高于对照组[MD=-2.84,95%CI(-3.33,-2.35),P<0.00001]。见图3。
3.3.2不良反应仅两项研究报道了不良反应数据,主要不良反应为头晕、头痛、恶心及心悸等,异质性检验提示:I2=0,P=0.37,表明各研究之间无异质性,采用固定效应模型进行meta分析,结果表明rTMS组不良反应发生率与对照组比较差异无统计学意义[OR=1.65,95%CI(0.31,8.83),P=0.56]。见图4。
3.3.3亚组分析根据患者是否共病抑郁症及疗程进行亞组分析,结果显示:患者是否共病抑郁症及疗程为1~3周和4~8周时,rTMS组的PSQI减分均显著高于对照组,两组PSQI减分的差异有统计学意义(P<0.05),与总体分析结果相同,分组后各亚组的异质性并未明显降低,提示本文所分亚组并非纳入研究异质性的全部来源,见图5~6。
3.3.4敏感性分析采用逐一剔除单个纳入RCT的方法进行敏感性分析,结果显示,剔除单个RCT后结果均未发生方向性改变,与总体结果方向一致,提示本研究所得的结果较为稳定。3.3.5发表偏倚对研究对象的PSQI减分率进行倒漏斗图分析,结果显示各点分布是不完全对称,提示以上研究有一定的偏倚,这可能归因于各研究对象的入选时间差异、治疗参数差异以及影响的一些阴性因素存在,见图7。
4讨论
脑卒中呈高发病趋势,且具有极高的致残率,相对较高的病死率,而失眠为脑卒中患者较为多见的临床表现之一。失眠可增加脑卒中的风险,而脑卒中也会引起失眠。失眠一方面可加重脑卒中病患的病情,延缓患者症状恢复及严重降低病患的生活质量,另一方面失眠还会提高脑卒中复发风险、严重瘫痪或残疾发生、情感障碍的风险[24]。因此,有效改善脑卒中相关失眠症状对患者的预后具有重要意义。PSI的发病机制目前还不明确,发病早期的失眠可能与脑卒中引起的脑结构损伤,脑卒中发病时出现脑组织肿胀引发脑细胞受挤压有关,从而造成大脑功能出现异常影响正常睡眠结构及节律[25]。还有研究者认为可能与大脑神经递质,如5-羟色胺等多种递质水平在脑内失衡有关系[25]。rTMS治疗手段可以改变大脑局部结构和远隔大脑皮层,实现大脑皮层功能区域性重新构建连接,从而影响大脑兴奋性[26],目前rTMS治疗已经成为目前临床治疗神经精神科疾病的重要治疗手段及相关科学研究手段。
本研究發现rTMS治疗PSI患者能够明显降低PSI患者PSQI评分,与对照组相比治疗前后PSQI减分差值有明显统计学差异性,rTMS明显提高PSI患者的睡眠质量。先前曾有研究发现,rTMS会引发神经突触可塑性发生改变,是疗效较好且安全性较好的诱导慢波睡眠的非药物干预手段之一[27]。脑电慢波睡眠是一项可以评估睡眠质量及睡眠效率的重要精准指标,与神经突触可塑性及学习记忆能力关系紧密,既往研究发现,失眠患者的慢波睡眠时间较正常组相比明显减少,两组间比较差异有统计学意义[28]。另外,有研究发现rTMS主要通过提高5-羟色胺和γ-氨基丁酸的释放,抑制交感神经节前神经元,削弱脑干网状结构的突触相互联系,抑制脑干腹侧中心部分神经细胞和神经纤维相混杂结构的上行网状激活系统功能[29-30];使得褪黑色素分泌量增加,增加大脑5-羟色胺及去甲肾上腺素浓度,影响机体睡眠-觉醒周期节律。Jiang等[31]报道rTMS治疗2周后,明显促进患者III期睡眠和整个快速动眼睡眠周期。因此,这些研究的理论基础也支持本研究结果。
本研究中仅有2个RCTs提供rTMS治疗过程可能出现头昏、头痛、恶心及心悸等不良反应,发病率为5.26%,研究中被试者没有因不良反应退出研究,且文献中表明患者不良反应轻微,大多数可自行缓解。说明rTMS治疗PSI具有较好的安全性,但因为研究数量少,样本量小,结论仍需更大样本研究进一步验证。
本研究的局限性:1由于纳入研究在纳入人群、rTMS参数和疗程等方面存在差异,可能造成研究间一定的异质性,但本研究总体异质性不高,且亚组分析未发现明显异质性来源,敏感性分析提示本研究结果稳定,因此本研究结果仍是较为可靠的;2本研究以PSQI评分和治疗过程不良反应发生率为结局指标,由于缺乏数据未能对睡眠结构进行更具体分析,结果精确性可能存在一定不足;3纳入研究总体质量一般,多数纳入研究提供关于分配隐藏、具体是否盲法等相关资料,可能造成选择、实施、测量等偏倚。
综上所述,rTMS可以明显改善PSI患者的睡眠质量,具有较好的安全性。对于上述入选meta分析的研究对象可能因研究质量、数量、治疗方法的差异等限制存在偏差,故仍需要更多高质量的临床研究进一步验证。
[参考文献]
[1] Singh RJ, Chen S, Ganesh A, et al. Long-term neurological, vascular, and mortality outcomes after stroke[J].Int J Stroke,2018,13(8):787-796.
[2] Wray F,Clarke D. Longer-term needs of stroke survivors with communication difficulties living in the community: a systematic review and thematic synthesisof qualitative studies[J].BMJ Open,2017,7(10): e017944.
[3] Kapral MK,Fang J,Alibhai SM,et al. Risk of fractures after stroke: results from the Ontario Stroke Registry[J]. Neurology,2017,88(1):57-64.
[4] Chen Z,Venkat P,Seyfried D,et al. Brain-heart interaction: cardiac complications after stroke[J]. Circ [16] Res,2017,121(4):451-468.
[5] Hackett ML,Pickles K. Part I: Frequency of depressionafter stroke: an updated systematic review and meta- analysis of observational studies[J].Int J Stroke,2014,9 (8):1017-1025.
[6] Rafsten L,Danielsson A,Sunnerhagen KS. Anxietyafter stroke: a systematic review and meta-analysis[J].J Rehabil Med,2018,50(9):769-778.
[7] Baylan S,Griffiths S,Grant N,et al. Incidence andprevalence of post-stroke insomnia: a systematic reviewand meta-analysis[J].Sleep Med Rev,2020,49:101222.
[8] Pérez-Carbonell L, Bashir S.Narrative review of sleep and stroke[J].J Thorac Dis,2020,12(suppl):S176-190.
[9] Li LJ,Yang Y,Guan BY,et al. Insomnia is associatedwith increased mortality in patients with first-ever stroke:a 6-year follow-up in a Chinese cohort study[J].StrokeVasc Neurol,2018,3(4):197-202.
[10] Duss SB,Brill AK,Bargiotas P,et al. Sleep-wake disorders in stroke increased stroke risk and deteriorated recovery? An evaluation on the necessity for preventionand treatment[J].Curr Neurol Neurosci Rep,2018,18 (10):1-15.
[11] Glozier N,Moullaali TJ,Sivertsen B,et al.The courseand impact of poststroke insomnia in stroke survivors aged 18 to 65 years: results from the Psychosocial Outcomes In StrokE (POISE) Study[J].Cerebrovasc Dis Extra,2017,7(1):9-20.
[12] Oh MK,Yoon KJ,Lee YT,et al.Effect of zolpidem on [24] functional recovery in a rat model of ischemic stroke[J].J Int Med Res,2018,46(1):249-257.
[13] Seibt J,Aton SJ,Jha SK,et al.The non- benzodiazepine hypnotic zolpidem impairs sleep dependent cortical plasticity[J].Sleep,2008,31(10): 1381-1391.
[14]HuangWS,TsaiCH,LinCC,etal.Relationshipbetweenzolpidemuseandstrokerisk:aTaiwanesepopulation-basedcase-controlstudy[J].JClinPsychiatry,2013,74(5):e433-438.
[15]NodaY,SilversteinWK,BarrMS,etal.Neurobiologicalmechanismsofrepetitivetranscranialmagneticstimulationofthedorsolateralprefrontalcortexindepression:asystematicreview[J].PsycholMed,2015,45(16):3411-3432.
[16]中华医学会第四届全国脑血管病学术会议.各项脑血管病诊断要点[J].中华神经内科杂志,1996,29(6):379.
[17]OliveiraGDP,VaqoERL,PradoGFD,etal.Thecriticalinfluenceofnocturnalbreathingcomplaintsonthequalityofsleepafterstroke:thePittsburghSleepQualityIndexandSTOPBANG[J].ArqNeuropsiquiatr,2017,75(11):785-788.
[18]陳丽萍,傅思媚,古智文,等.高频重复经颅磁刺激治疗卒中后抑郁伴失眠的临床研究[J].广州医药,2020,51(6):28-32.
[19]丁玲,肖波,陈旭,等.重复经颅磁刺激对卒中后睡眠障碍患者睡眠结构及脑源性神经营养因子的作用[J].实用医技杂志,2020,27(2):153-156.
[20]何予工,李鹏.重复经颅磁刺激对脑卒中后抑郁患者抑郁情绪、睡眠障碍及日常生活活动能力的影响[J].中华物理医学与康复杂志,2015,37(5):361-364.
[21]华强,夏文广,郭伏玲,等.重复经颅磁刺激联合右佐匹克隆片治疗脑梗死后睡眠障碍的临床研究[J].神经损伤与功能重建,2020,15(5):267-270,295.
[22]李翠.经颅磁电刺激联合氯硝西泮治疗脑卒中睡眠障碍的临床效果[J].实用临床医学,2019,20(11):14-15,65.
[23]马式意,李柄佑,王蕊,等.米氮平联合重复经颅磁刺激治疗缺血性脑卒中后抑郁的疗效观察[J].中华物理医学与康复杂志,2021,43(6):520-522.
[24]朱明跃,刘元标,黄娟娟,等.超低频经颅磁刺激治疗缺血性脑卒中患者失眠的临床疗效[J].神经疾病与精神卫生,2019,19(5):462-466.
[25]陈刘翠,袁梅,刘锋.脑卒中相关失眠的研究进展[J].卒中与神经疾病,2020,27(3):402-405.
[26]陈亮,陈洁,金戈,等.低频重复经颅磁刺激治疗卒中后抑郁疗效的Meta分析[J].中国医学物理学杂志,2019,36(6):736-744.
[27] Wang HY,Crupi D,Liu J,et al. Repetitive transcranial magnetic stimulation enhances BDNF-TrkB signalling in both brain and lymphocyte[J].J Neurosci, 2011,31(30):11044-11054.
[28] Massimini M,Tononi G, Huber R.Slow waves, synaptic plasticity and information processing: insights from transcranial magnetic stimulation and high-density EEG experiments[J].Eur J Neurosci,2009,29(9): 1761-1770.
[29]唐雷,马朝阳,游菲,等.低频电穴位刺激对脑卒中后失眠患者血浆5-HT及NE的影响[J].中国针灸,2015,35(8):763-767.
[30] Morgan Peter T,Pace-schott Edward F,Mason Graeme F,et al.Cortical GABA levels in primary insomnia[J].Sleep,2012,35(6):807-814.
[31] Jiang CG,Zhang T,Yue FG,et al.Efficacy of repetitive transcranial magnetic stimulation in the treatment of patients with chronic primary insomnia[J]. Cell Biochem Biophys,2013,67(1):169-173.
(收稿日期:2021-11-29)

