不同厂家蒲黄药材中异鼠李素-3-O-新橙皮苷和香蒲新苷的含量分析
付国辉, 黄丽杰, 岳 磊, 刘娜娜, 闫懿高
(1.河南医学高等专科学校药学院,郑州 451191;2.郑州市食品药品检验所,郑州 450000)
蒲黄为香蒲科植物水烛香蒲TyphaangustifoliaL.、东方香蒲TyphaorientalisPresl或同属植物的干燥花粉[1]。临床多用于吐血、衄血、咯血、崩漏、外伤出血、经闭通经、胸腹刺痛、跌扑肿痛[2]、血淋涩痛[3]等病症。蒲黄主产于我国江苏、浙江、安徽、山东、河南、湖北、内蒙古、黑龙江等地[4]。《中国药典》规定同属多种植物的花粉皆可作中药使用,因此蒲黄资源极其丰富[5]。蒲黄的性状为粉质,无臭无味,性状特征不明显[6],易掺假,因此对蒲黄的质量应严格把控。蒲黄的有效成分多为黄酮类、止血成分鞣质、甾类、烷烃类、糖类等[7]。近年来,对蒲黄的化学成分、药理活性及临床应用研究逐渐深入[8-13]。参考2020年版《中国药典》一部蒲黄的质量控制标准,香蒲新苷和异鼠李素-3-O-新橙皮苷为含量测定项下的两个指标性成分,本研究主要对不同来源处的蒲黄中这两种指标性成分进行含量测定并比较,考察其差异性,为临床评价和鉴定蒲黄提供参考。
1 仪器、试剂与药材
1.1 仪器 高效液相色谱仪为Agilent1260,二极管阵列检测器(国安捷伦科技有限公司);XS205十万分之一电子分析天平(METTLER TOLEDO);水浴锅型号HH-S(巩义市英峪予华仪器厂)。
1.2 试剂与药材 娃哈哈纯净水;甲醇、乙腈均为色谱纯(Merck公司);磷酸(含量98%,AR,洛阳昊华化学试剂有限公司);异鼠李素-3-O-新橙皮苷对照品(批号:111571-201806,含量以93.0%计)、香蒲新苷对照品(批号:111573-201806,含量以96.5%计)均来自中国食品药品检定研究院;蒲黄药材来源及含量测定结果见表1。
2 实验方法
2.1 色谱条件与系统适用性试验[1]色谱柱:ZORBAX Eclipse XDB-C18 Analytical(4.6 mm×250 mm,5 μm);流动相:乙腈-0.05%磷酸溶液(15:85);检测波长:254 nm;柱温:30 ℃;流速:1 mL·min-1;进样量:20 μL;理论板数:按异鼠李素-3-O-新橙皮苷峰计,应不低于5 000。
2.2 供试品溶液的制备 取不同来源处的蒲黄约0.5 g,精密称定,放置于具塞的锥形瓶中,加甲醇50 mL,精密称定重量,冷浸12 h,加热回流1 h,取出,放至室温,精密称定重量,用甲醇补足减少的重量,摇匀后滤过,取续滤液,即为供试品溶液。
2.3 对照品溶液的制备 取异鼠李素-3-O-新橙皮苷对照品约10 mg,精密称定后置于100 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,精密量取5 mL置于10 mL容量瓶中,用甲醇稀释至刻度,摇匀,即得异鼠李素-3-O-新橙皮苷对照品溶液;同法制得香蒲新苷对照品溶液。
3 方法学试验验证
分析方法验证的目的是证明建立的方法适合于相应检测要求[14]。验证的实验指标有专属性、重复性、稳定性、精密度等,通过各种验证证明该实验结果准确可靠。
3.1 专属性试验的验证 按照“2.2”项下制备供试品溶液和阴性对照溶液(无样品,其余实验操作完全一致),按照“2.3”项下制备对照品溶液,取混合流动相溶液作为空白溶液,按照“2.1”项下,吸取空白溶液、阴性对照溶液、对照品溶液和供试品溶液各20 μL(仪器自主精密吸取)注入色谱仪,查看图谱并记录谱峰的面积。见图1-4。色谱图中色谱基线稳定,供试品溶液中两个化合物香蒲新苷和异鼠李素-3-O-新橙皮苷色谱峰与邻近色谱峰分离度良好,空白溶液和阴性对照溶液色谱图显示均无干扰。
3.2 重复性试验的验证 精密称取蒲黄样品(编号10),按照“2.2”项下平行制备6份样品溶液,精密吸取6份平行样品,按照“2.1”项下条件进样,记录2个指标性化合物异鼠李素-3-O-新橙皮苷和香蒲新苷的色谱峰面积并计算其含量。异鼠李素-3-O-新橙皮苷和香蒲新苷含量的RSD值分别为0.5%和0.6%,表明该方法验证良好,该方法重复性良好。
3.3 精密度试验的验证 在不同日期,使用不同的高效液相色谱仪器和不同的色谱柱[1.见“2.1”项下的色谱条件;2.美国沃特世公司的Waters Alliance e2695型高效液相色谱仪,2489 UV/Vis Detecter,色谱柱:Welch Ultimate LP-C18(4.6 mm×250 mm,5 μm);3.赛默飞世尔科技有限公司 DIONEX U-3000,UltiMate 3000 Variable Wavelength Detector,色谱柱:ZORBAX Eclipse Plus C18 Analytical(4.6 mm×250 mm,5 μm)],由不同的实验人员按照“2.1”和“2.2”项下相同的方法制备对照品溶液和供试品溶液,注入高效液相色谱仪,记录2个指标性化合物的色谱峰面积,并计算其含量,考察验证该方法的中间精密度。结果显示,香蒲新苷和异鼠李素-3-O-新橙皮苷含量的相对标准偏差(RSD)值分别显示为0.5%和0.6%、0.5%和0.4%、0.6%和0.3%。验证结果表明,该方法中间精密度良好。
3.4 稳定性试验的验证 精密称取蒲黄样品(编号10),按照“2.2”项下进行样品溶液的制备,分别在0、2、4、8、12、24和48 h时注入高效液相色谱仪,记录色谱峰面积并计算其含量,香蒲新苷和异鼠李素-3-O-新橙皮苷的峰面积的RSD值显示为0.5%和0.9%,含量的RSD值分别为0.3%和0.4%,验证结果证明,溶液在48 h内稳定可使用,验证结果表明,可以作为稳定的供试品溶液进行试验。
3.5 加样回收率试验的验证 精密称取6份相同重量的已知含量的蒲黄样品(编号10),按1∶1的比例精密加入与已知含量蒲黄样品相同比例含量的两种化合物的对照品溶液,按照“2.2”项下进行供试品溶液的制备,按照“2.1”项下进样,记录谱峰,测定6份供试品溶液中异鼠李素-3-O-新橙皮苷和香蒲新苷的含量,计算回收率。异鼠李素-3-O-新橙皮苷和香蒲新苷的平均回收率分别为102%和99%,RSD值分别为1.4%和0.8%。试验证明该方法的加样回收率符合要求,该方法的准确度良好。
4 实验测定及结果
4.1 测定法 取异鼠李素-3-O-新橙皮苷和香蒲新苷的对照品溶液及供试品溶液,注入高效液相色谱仪,进样量均为20 μL,记录色谱峰面积,按外标法分别计算含量。色谱图见图1-4。

图2 异鼠李素-3-O-新橙皮苷对照品色谱

图3 香蒲新苷对照品色谱
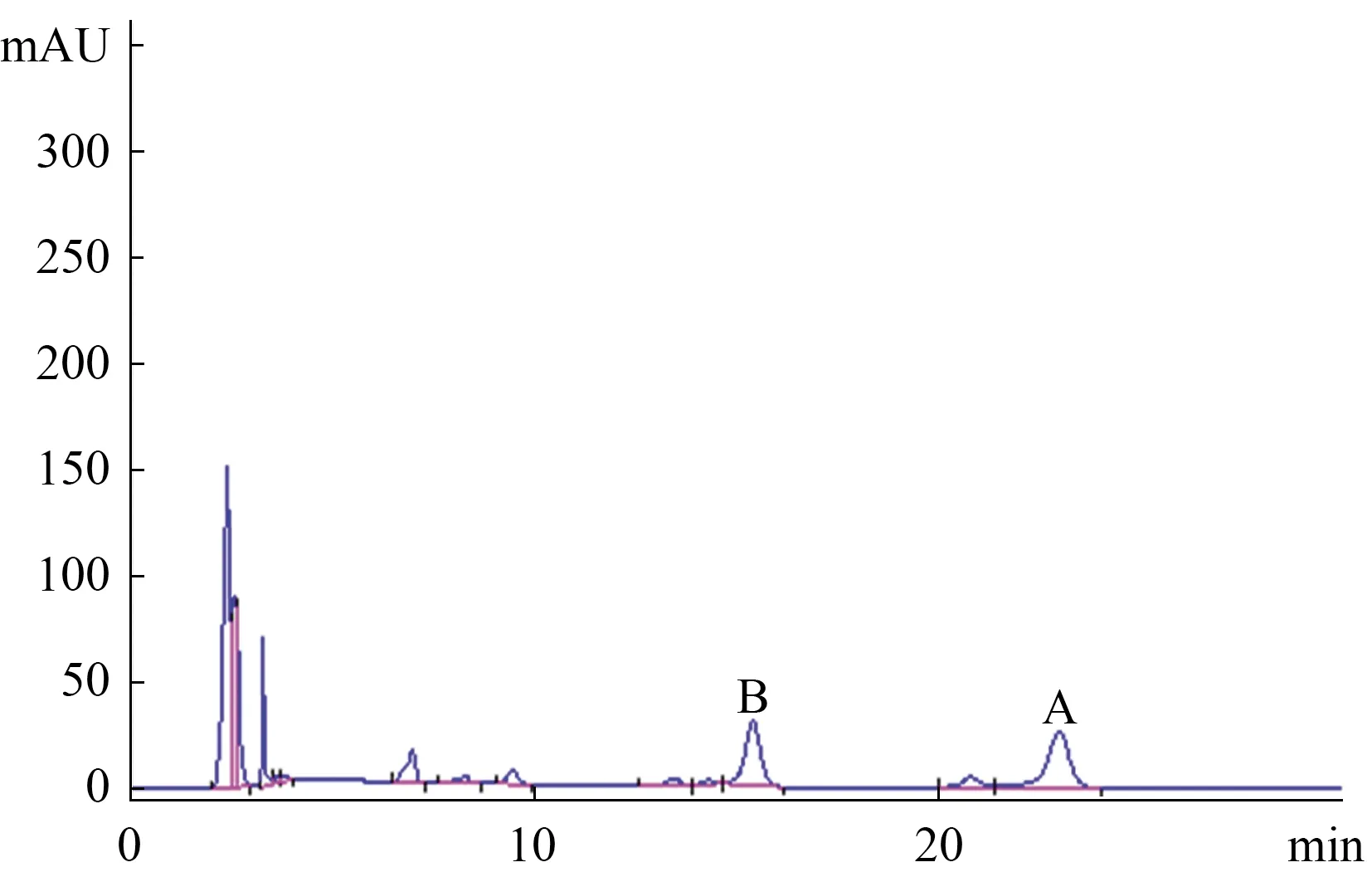
图4 编号10的样品色谱
4.2 理论板数 按异鼠李素-3-O-新橙皮苷峰计算均未低于5 000。
4.3 样品测定结果 见表1。
5 讨论
5.1 蒲黄药材掺伪品现象及非法添加 由于蒲黄的药用标准为同属多种植物的花粉,范围较大,虽药用资源较为丰富,但蒲黄花粉为粉质,无臭无味,曾有因外观类同而误用的事故发生,如以松花粉误以蒲黄使用。蒲黄药材极易出现掺伪品,常见有掺入淀粉、矿物质细粉,甚至出现用矿物质细粉加黄色染料伪制蒲黄的现象,因此在蒲黄药材的检验中增加了检查非法添加物金胺O的项目。蒲黄的质量问题还有掺杂,在蒲黄的生产过程中不可避免会带入原本来自香蒲雄花序的杂质,而《中国药典》规定杂质限度为不得超过10.0%,且因蒲黄药材性状的特殊性,人为区分蒲黄和杂质较困难,因此关于杂质检验的相应问题,需要进一步研究解决。刘亚萍等[15]研究了蒲黄净制前后,蒲黄样品中黄酮类化合物含量的变化情况,结果表明,蒲黄样品经过七号筛净制后,花粉粒中所含的黄酮类化合物成分含量最高。
5.2 蒲黄药理作用研究进展 蒲黄所含化学成分众多,主要有黄酮、有机酸、烷烃、挥发油等,此外还含有无机元素及其他化学物质[16]。蒲黄中药理作用的主要成分为黄酮类,黄酮类成分中的黄酮醇类含量相对较高,主要以化合物香蒲新苷和化合物异鼠李素-3-O-新橙皮苷为主[17-18]。在止血方面,陈佩东等[19]的研究结果显示,包括香蒲新苷和异鼠李素-3-O-新橙皮苷在内的6种黄酮类化合物均可使家兔体外血浆凝血酶原时间和血浆凝血酶时间缩短;在化瘀方面,对于蒲黄具有的化瘀行滞、祛瘀止痛的作用,冯绪强等[20]研究发现,60%乙醇洗脱部位镇痛作用显著,对其进行的化学成分分析显示有黄酮苷类、香蒲新苷等;在通淋方面,蒲黄可利尿通淋,多用于血淋、小便淋涩疼痛而有尿血者[21]。蒲黄显示的多种药理作用使其在临床应用上备受青睐,因此对其质量的把控应更为严谨。
5.3 流动相选择及探索 通过查阅现有文献[22-26]及探索,本实验考查了乙腈-水、乙腈-0.1%甲酸和甲醇-0.4%磷酸等流动相,考察结果显示,最佳流动性条件还是以《中国药典》蒲黄含量测定项下色谱条件中的乙腈-0.05%磷酸溶液(15:85)为最优,具有试剂经济易得、溶液易配制、色谱基线稳定、出峰时间适宜等优点。
5.4 结果分析 由表1含量测定结果可知,《中国药典》规定蒲黄按干燥品计算,含异鼠李素-3-O-新橙皮苷和香蒲新苷的总量不得少于0.50%。实验所用16批药材中异鼠李素-3-O-新橙皮苷和香蒲新苷的总量均大于0.50%,说明药材良好。除编号16中异鼠李素-3-O-新橙皮苷含量和香蒲新苷含量相差较大之外,其余批次两种化合物的含量差别不大;不同批次之间异鼠李素-3-O-新橙皮苷含量和香蒲新苷的含量有差异,编号11中异鼠李素-3-O-新橙皮苷和香蒲新苷的总量最低,编号16总含量最高,差异产生的原因可能有多个。地域分布和品种差异,水烛香蒲主产于江苏、浙江、山东和安徽等地,东方香蒲主产于贵州、山东、山西及东北各省[27],地域分布不同,药材受到土壤、温度、光照、空气、水分等外在因素的影响不同,从而产生不同品质的药材,多品种来源的药材在质量检验中也会显示出差异;采收时间,蒲黄为花粉入药,采收时间不同会严重影响药材的质量和产量,过早采收花粉产量低,过迟采收花粉自然脱落,产量和质量均不佳;植物内生菌和土壤微生物,植物内生菌可影响宿主植物次生代谢相关基因的表达和物质代谢,土壤微生物可提高土壤肥力和改善土壤结构,从而为药材提供良好的生长条件。目前蒲黄并无道地药材,因其使用广泛,其质量控制标准也更需进一步完善,如严格把握药材产地来源、采收时间、保证药材规范化和规模化种植,探索蒲黄药材的道地产区,提高蒲黄药材的栽培技术,甚至创造蒲黄药材特定的生长条件等,为更好地保障临床合理、规范和有效使用蒲黄药材奠定基础。

