一株小麦赤霉病生防菌的鉴定及其生防机制初探
张 震,邱海萍,柴荣耀,郝中娜,王教瑜,王艳丽,孙国昌
(浙江省农业科学院植物保护与微生物研究所/省部共建农产品质量安全危害因子与风险防控国家重点实验室/浙江省国家农作物品种抗性鉴定试验站,杭州 310021)
赤霉病是我国长江中下游流域小麦生产上最为主要的病害之一,由其造成的产量损失一般在 10%~15%,大流行年份甚至可以达50%以上[1]。发病麦粒粗蛋白质含量低,出粉率低,失去种用和工业用价值[2]。病麦粒还含有病菌产生的脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)和玉米赤霉烯酮(Zearalenone,ZEN)等毒素,人畜食用后易对健康造成严重威胁。
小麦赤霉病主要由禾谷镰刀菌Fusariumgraminearum侵染所致,其防控措施目前仍以小麦扬花初期的化学防治为主,防治药剂主要是多菌灵、戊唑醇和氰烯菌酯等单剂或相关复配剂。化学药剂长期的不合理使用,不仅使得环境污染和农药残留超标等问题日趋严重,也易衍生出诸多生态和社会问题。小麦赤霉病防治中,单一化学药剂的长期使用,使得部分麦区禾谷镰刀菌已产生了严重的抗药性[3]。为顺应我国农业绿色发展,生防菌因其环境友好性,相关产品的研发与应用在化学药剂减量的大背景下日益受到重视[4]。迄今,国内外已经筛选到许多对禾谷镰刀菌具有生防活性的菌株,包括芽胞杆菌Bacillusspp.、假单胞菌Pseudomonasspp.和链霉菌Streptomycesspp.等,它们通常通过分泌具有抑菌活性的次生代谢物、营养或生态位点竞争、诱导小麦抗病性等方式抑制禾谷镰刀菌的为害[5,6]。但是基于菌剂的小麦赤霉病生防应用大多仍处于实验室阶段,少有商业化应用产品转化开发[6]。截止2020年5月,我国赤霉病防治登记菌剂仅包括枯草芽胞杆菌Bacillus subtilis、蜡质芽胞杆菌Bacilluscereus和多粘类芽胞杆菌Bacilluspolymyxa等5个产品[7],而且相关产品的推广还常受到活菌制剂见效慢及农户盲目应用防效差等因素制约[4]。因此,筛选高效生防菌并配套适宜的应用技术或许为解决赤霉病生物菌剂开发和商业化应用迟滞等问题提供契机。
本研究评价了1株分离自稻茬的细菌对禾谷镰刀菌的抑菌活性,并采用16S rDNA和gyrB基因序列对其进行种属鉴定;开展了这个菌株对小麦赤霉病的田间防治效果试验和潜在应用方法的探索;通过对其基因组的检测初步分析了其潜在的生防机制。
1 材料与方法
1.1 材料
供试菌株与培养基:菌株hzq1601,分离自冬闲田稻茬并由本实验室保存;禾谷镰刀菌菌株Fg1706,由本实验室分离并保存。供试培养基:细菌培养用LB培养基和NA培养基;抑菌试验采用马铃薯葡萄糖琼脂培养基(PDA);芽胞杆菌生化鉴定管,购自青岛海博生物技术有限公司。供试药剂:50%多菌灵可湿性粉剂,由四川国光农化股份有限公司生产。
1.2 菌株hzq1601对禾谷镰刀菌的抑菌活性
将保存的菌株hzq1601于LB平板培养基活化,28 ℃培养1~2 d后用接种环挑取1个单菌落接种至装有10 mL LB液体培养基的50 mL 离心管中,28 ℃、200 r/min培养16 h,此时含菌量约2×107cfu/mL;取直径0.5 cm的无菌滤纸碟于菌液中浸泡5 min后至超净工作台凉干;将带菌纸碟与禾谷镰刀菌进行平板对峙培养,以未处理纸碟为对照。另取上述过夜培养的菌液1 mL接种至装有50 mL LB液体培养基的150 mL三角瓶中继续振荡培养72 h后,10000 r/min离心10 min,取上清经0.22 μm一次性无菌过滤器过滤除菌获得无菌滤液,并与未凝固的PDA培养基按1/20(v/v)的比例均匀混合后制成平板,用于测定无菌滤液对禾谷镰刀菌的抑菌效果。
1.3 菌株hzq1601的鉴定
1.3.1 菌体形态、培养特征观察及生理生化指标测定 挑取菌株hzq1601单菌落于NA平板上划线,置于30 ℃恒温培养24 h后,观察其菌落颜色和形态。参考《常见细菌系统鉴定手册》的方法,进行革兰氏染色、厌氧生长、V-P反应、柠檬酸盐利用、丙酸盐利用、D-木糖利用、L-阿拉伯糖利用、D-甘露醇利用、明胶液化、7%氯化钠生长、pH 5.7生长、硝酸盐还原、淀粉水解等生理生化试验。
1.3.2 菌株多基因系统发育树构建 取方法1.2中hzq1601菌液2 mL,5000 r/min离心10 min收集菌体,采用天根生化科技有限公司生产的细菌基因组DNA提取试剂盒提取基因组DNA。16S rDNA序列扩增采用通用引物27F和1492R[8]。gyrB基因片段扩增采用引物UP2r和UP1[9]。PCR扩增产物经凝胶电泳切胶回收后进行DNA测序。引物合成及DNA测序均由北京擎科生物技术有限公司完成。测序所得序列通过NCBI 数据库进行 BLAST 比对,并通过 MEGA 软件对供试菌株与模式菌进行系统发育分析。系统发育分析所用DNA序列均来源于NCBI数据库,所用菌株16S rDNA序列Genbank登录号分别是解淀粉芽胞杆菌BacillusamyloliquefaciensFZB42(NR_075005)、DSM7(NR_118950)、枯草芽胞杆菌 168(NR_102783)、萎缩芽胞杆菌Bacillusatrophaeus1942(MF101172)、地衣芽胞杆菌BacilluslicheniformisATCC 14580(NR_074923)、BacilluspumilusSAFR-032(AY167879)和蜡质芽胞杆菌 ATCC 14579(NR_074540)。gyrB基因序列Genbank登录号分别是解淀粉芽胞杆菌FZB42(CP000560;4871-6787),解淀粉芽胞杆菌DSM7(FN597644;4871-6793)、枯草芽胞杆菌 168(CP010052;4867-6783)、萎缩芽胞杆菌 1942(CP002207;3633334-3635250)、地衣芽胞杆菌 ATCC 14580(CP000002;4986-6905)、短小芽胞杆菌B.pumilusSAFR-032(AY167871)和蜡质芽胞杆菌 ATCC 14579(AB190226)。
1.4 解淀粉芽胞杆菌hzq1601与多菌灵兼容性分析
取方法1.2中菌株hzq1601的培养液2 mL至100 mL LB培养液中继续培养24 h,取10 mL菌液5000 r/min离心10 min收集菌体,用无菌去离子水洗涤菌体3次后,将菌体重悬于10 mL无菌去离子水中待用。称取适量多菌灵可湿性粉剂用无菌去离子水配置成2000 mg/L的多菌灵母液,待用。在15 mL离心管中加入上述菌悬液和多菌灵母液,用无菌去离子水分别配置成多菌灵浓度为1000、500、250和0 mg/L的菌药混合液10 mL。菌药混合液振荡混匀后,经LB平板涂板测定初始活菌量。菌药混合液室温放置并间有振荡混匀,分别于放置1、2、4和8 d后取适量菌液检测存活菌量。
1.5 菌株hzq1601对小麦赤霉病的田间防效
取方法1.2中hzq1601菌液8 mL至装有400 mL LB培养液的1 L三角瓶中振荡培养72 h后(含菌量约1.6×108cfu/mL),菌液直接用于田间防效试验。试验共设7个处理:T1:50%多菌灵可湿性粉剂100 g/667m2; T2:50%多菌灵可湿性粉剂80 g/667m2;T3:50%多菌灵可湿性粉剂70 g/667m2; T4:50%多菌灵可湿性粉剂80 g/667 m2+上述hzq1601培养液4 L/667 m2; T5:50%多菌灵可湿性粉剂70 g/667 m2+上述hzq1601培养液4 L/667 m2;T6:上述hzq1601培养液4 L/667 m2;T7:清水对照。试验田块种植小麦品种为金运麦1号,种植方式为稻田免耕直播。每个处理设置3次重复,小区面积30 m2,小区随机区组排列。试验共施药处理2次,分别于小麦始花期和第1次药后7 d,喷雾采用3WBD-16型背负式电动喷雾器(台州市黄岩绿野喷雾器厂),每667m2用水量30 kg。至小麦乳熟后,按每小区棋盘式 5点进行病害调查,每点调查麦穗不少于100穗。赤霉病病级划分标准和病情指数计算标准按国标GB/T 15769-2011。防治效果计算方法:防治效果(%)=(对照区药后病情指数—处理区药后病情指数)/对照区药后病情指数×100。试验数据采用DPS 17.10软件进行Duncan新复极差法分析。
1.6 基因组的测序及生防机制分析
取方法1.2中hzq1601菌液以3%(v/v)接种量于100 mL LB液中28 ℃、200 r/min振荡培养6 h后,以5000 r/min 离心10 min收集菌体,并将菌体置于干冰中送上海欧易生物有限公司进行基因组测序。建库测序、基因组组装及基因组特征分析均由上海欧易生物医学科技有限公司完成。次级代谢产物合成基因簇分析采用antiSMASH(http://antismash.secondarymetabolites.org/)软件。
2 结果与分析
2.1 菌株hzq1601对禾谷镰刀菌菌丝生长的抑制效果
经平皿对峙培养发现分离自稻茬的细菌 hzq1601对禾谷镰刀菌具有良好的拮抗效果(图 1A),表明菌株hzq1601可分泌抑菌活性物质。将菌株hzq1601在LB培养液中振荡培养72 h后过滤除菌后用于抑菌效果测定,结果显示禾谷镰刀菌在含5% hzq1601无菌滤液的PDA平板上生长受到严重抑制,相对生长抑菌率达到85.8%(图1B)。
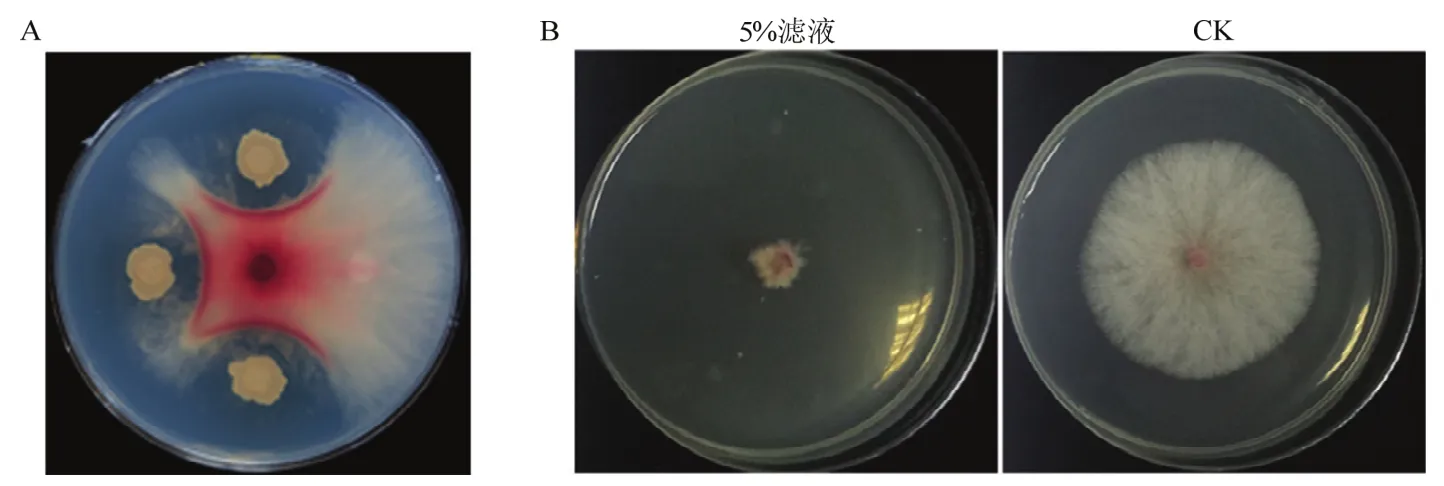
图1 菌株hzq1601抑菌效果测定Fig.1 Detection of antagonistic activity of the strain hzq1601
2.2 菌株hzq1601鉴定
2.2.1 菌株hzq1601生理生化指标测定 菌株hzq1601在NA平板30 ℃培养24 h后,菌落形态都呈灰白色不透明,菌落表面隆起似毛玻璃状,边缘整齐(图2A)。菌株hzq1601为革兰氏阳性菌(图2B),在NaCl含量7%、pH 5.7和厌氧条件下均能生长。V-P反应、柠檬酸盐利用、D-木糖利用、明胶液化、硝酸盐还原、淀粉水解为阳性;丙酸盐利用、L-阿拉伯糖利用、D-甘露醇利用等为阴性(表1)。
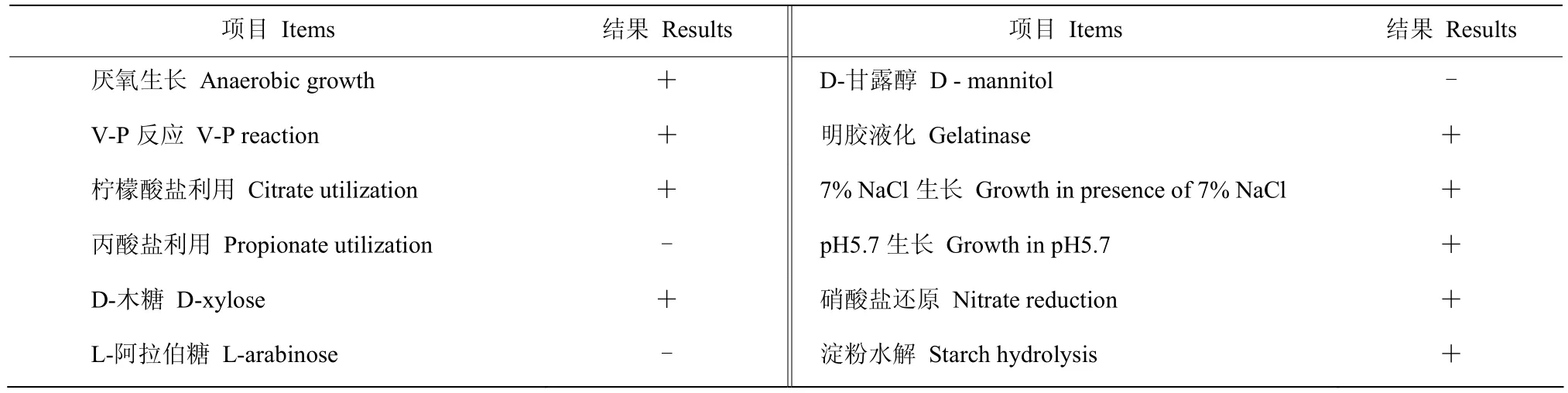
表1 菌株hzq1601生理生化特征Table 1 Physiological and biochemical characters of strain hzq1601
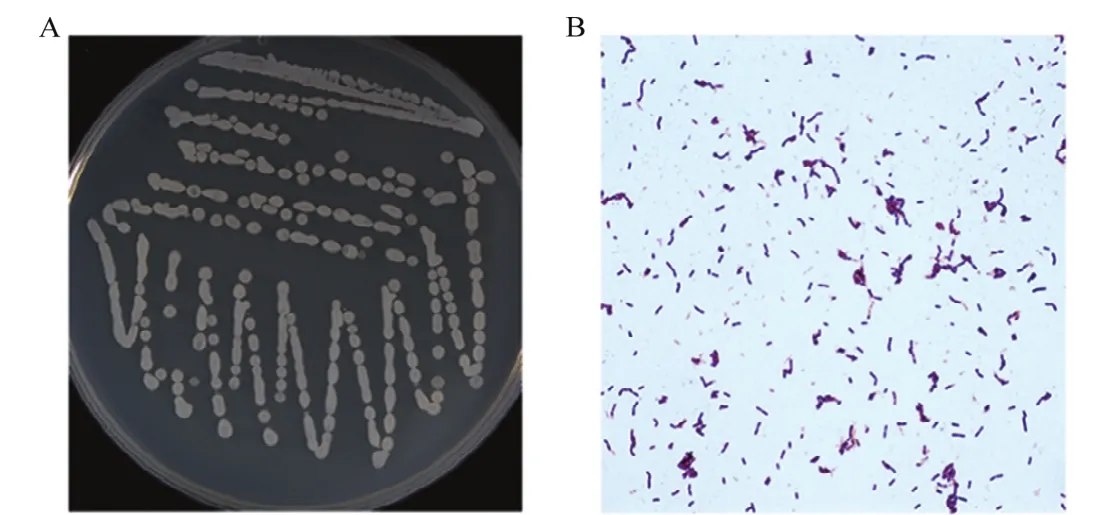
图2 菌株hzq1601菌落形态和革兰氏染色Fig.2 Colony morphology and Gram staining of the strain hzq1601
2.2.2 16S rDNA和gyrB基因序列扩增与分析 提取菌株hzq1601的基因组 DNA,以其为模板分别扩增16S rDNA和gyrB基因片段,电泳结果显示分别扩增到大小约1500和1200 bp的特征性条带。经切胶回收后送公司测序,将结果序列提交GenBank数据库分别获得登录号OM108303和OM303790,并在 NCBI 网站用 BLAST 程序进行检索,结果显示菌株hzq1601的16S rDNA序列与解淀粉芽胞杆菌BA31相似性为99%,gyrB基因序列与解淀粉芽胞杆菌CAUB946相似性100%。基于16S rDNA 和gyrB基因序列,应用MEGA 10软件与解淀粉芽胞杆菌FZB42、DSM7、B.subtilis168、B.atrophaeus1942、B.licheniformisATCC 14580、B.pumilusSAFR-032和B.cereusATCC 14579等菌株构建系统进化树,结果显示菌株hzq1601与模式菌株解淀粉芽胞杆菌亲缘关系最近(图3,4)。由此,将菌株hzq1601鉴定为解淀粉芽胞杆菌。
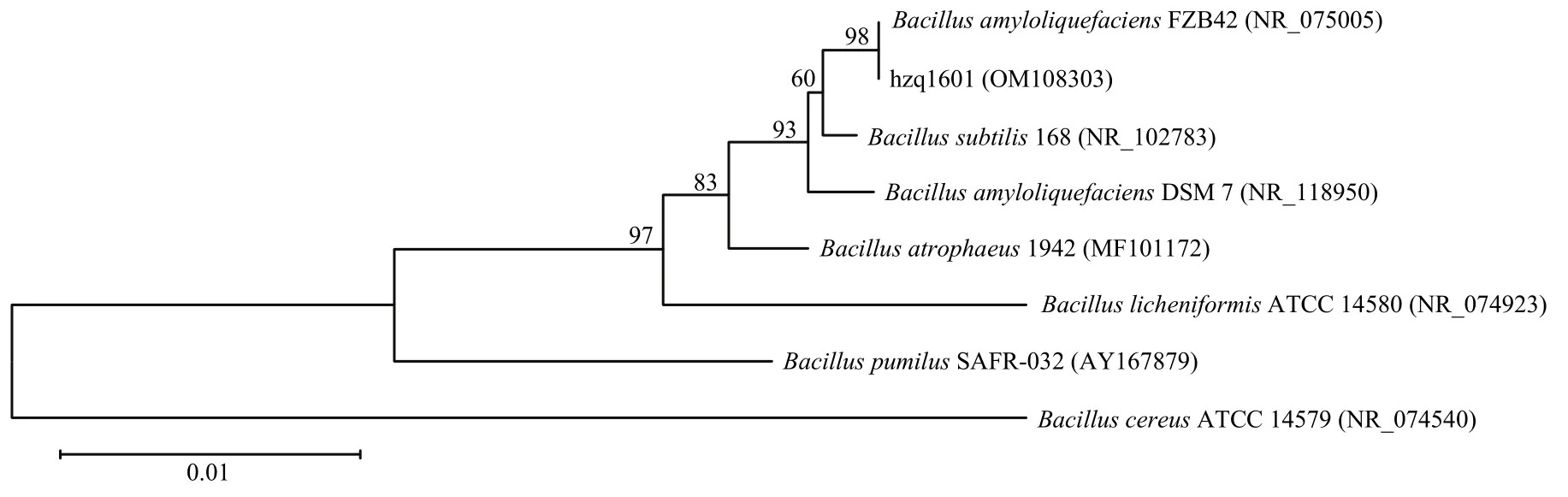
图3 基于16S rDNA序列构建菌株hzq1601系统发育树Fig.3 Phylogenetic tree of the strain hzq1601 based on 16S rDNA sequence

图4 基于gyrB基因序列构建菌株hzq1601系统发育树Fig.4 Phylogenetic tree of the strain hzq1601 based on gyrB gene sequence
2.3 菌株hzq1601与多菌灵相容性分析
为了明确多菌灵是否对生防细菌的存活存在影响,将菌株hzq1601与多菌灵配制成菌药混合液,静置处理1、2、4和8 d后,分别检测菌药混合液中细菌存活数量。结果显示,与去离子水处理对照相比较,菌药混合液静置处理1 d后,多菌灵的存在使得菌株hzq1601存活率下降27.6%~35.8%;但含多菌灵的处理间菌株hzq1601的存活情况无明显差异。当菌药静置处理2、4和8 d后,含多菌灵各处理与清水对照相比菌株hzq1601存活率也无明显差异,且各样品中菌株 hzq1601活菌量均在 105cfu/mL以上(图5)。结果表明,当多菌灵剂量在低于1000 mg/L的条件下,菌株hzq1601与药液相容性较好。
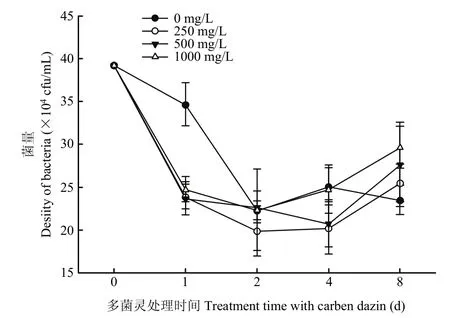
图5 菌株hzq1601与多菌灵的相容性Fig.5 Compatibility of the strain hzq1601 with fungicide carbendazim
2.4 菌株hzq1601对小麦赤霉病的田间防治效果
以108cfu/mL的hzq1601培养液和50%多菌灵可湿性粉剂协同,设计了7个处理进行小麦赤霉病田间防治试验,结果显示50%多菌灵可湿性粉剂(100 g/667 m2)进行2次喷雾处理防效在85.1%;菌株hzq1601培养液对小麦赤霉病防效为55.6%(表2)。菌株hzq1601分别与50%多菌灵可湿性粉剂80 g/667 m2或70 g/667 m2协同施用,对赤霉病防效分别在87.5%和81.0%,均显著高于相应的单独使用多菌灵的处理,且与50%多菌灵可湿性粉剂(100 g/667 m2)处理无显著性差异。
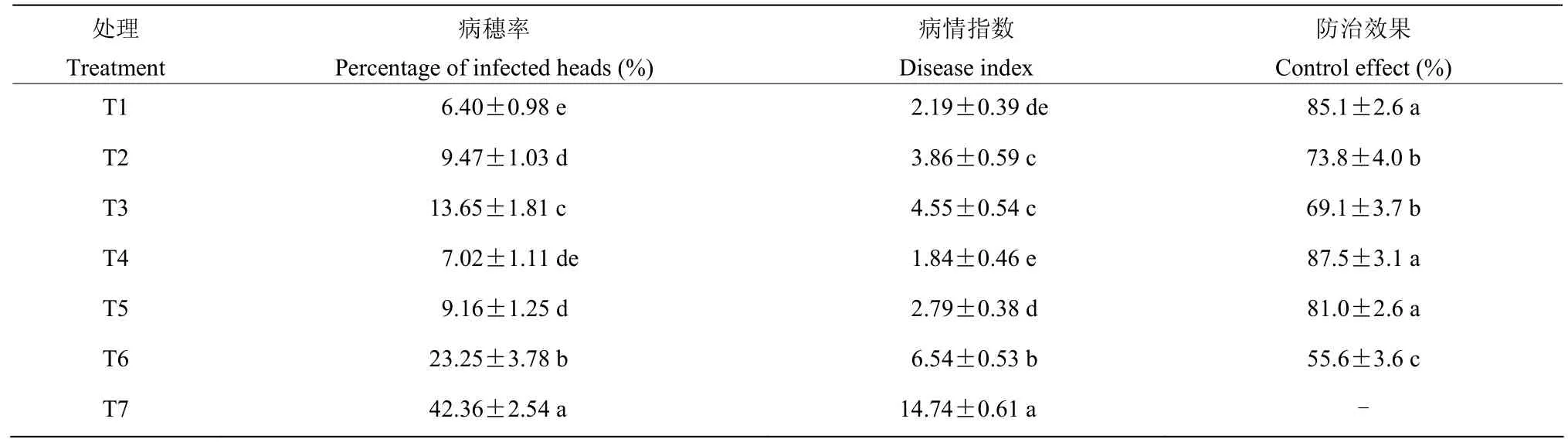
表2 菌株hzq1601与多菌灵协同对小麦赤霉病的防效Table 2 Control effect of the strain hzq1601 combined application of carbendazim on wheat fusarium head blight
2.5 基因组组装及抑菌机制分析
菌株hzq1601基因组测序结果显示,其含有1条4290856 bp大小的染色体,与其他已知芽胞杆菌基因组数据相比,略大于B.amyloliquefaciensFZB42基因组(3918589 bp),与B.subtilis168基因组(4214630 bp)相当(表3)。编码基因预测结果显示,菌株hzq1601基因组共编码基因 4231个,其中3个菌株共有的基因2889个。以蛋白编码基因序列进行系统发育分析,解淀粉芽胞杆菌hzq1601与解淀粉芽胞杆菌FZB42的亲缘关系较近。

表3 菌株hzq1601基因组特征及与其他芽胞杆菌基因组序列比较Table 3 Genomic features of the strain hzq1601 genome and comparison with genomes of other Bacillus spp.
为了揭示解淀粉芽胞杆菌 hzq1601是否存在具有抑菌活性的次级代谢产物,将基因组序列提交antiSMASH平台,进行代谢产物编码基因的同源性分析,结果(表4)显示菌株hzq1601携有13个次生代谢产物合成基因簇,其中8个能找到已鉴定的基因簇,100%相似的有bacilysin、bacillibactin、difficidin、fengycin、bacillaene和macrolactinH等合成基因簇;另外2个为surfactin编码基因簇和bustirosin编码基因簇,但相似度分别仅为 82%和7%。其他5个编码未知次生代谢产物的基因簇,初步预测为2 种萜烯类物质、2种硫肽类物质和1个T3PKS合成途径产物。
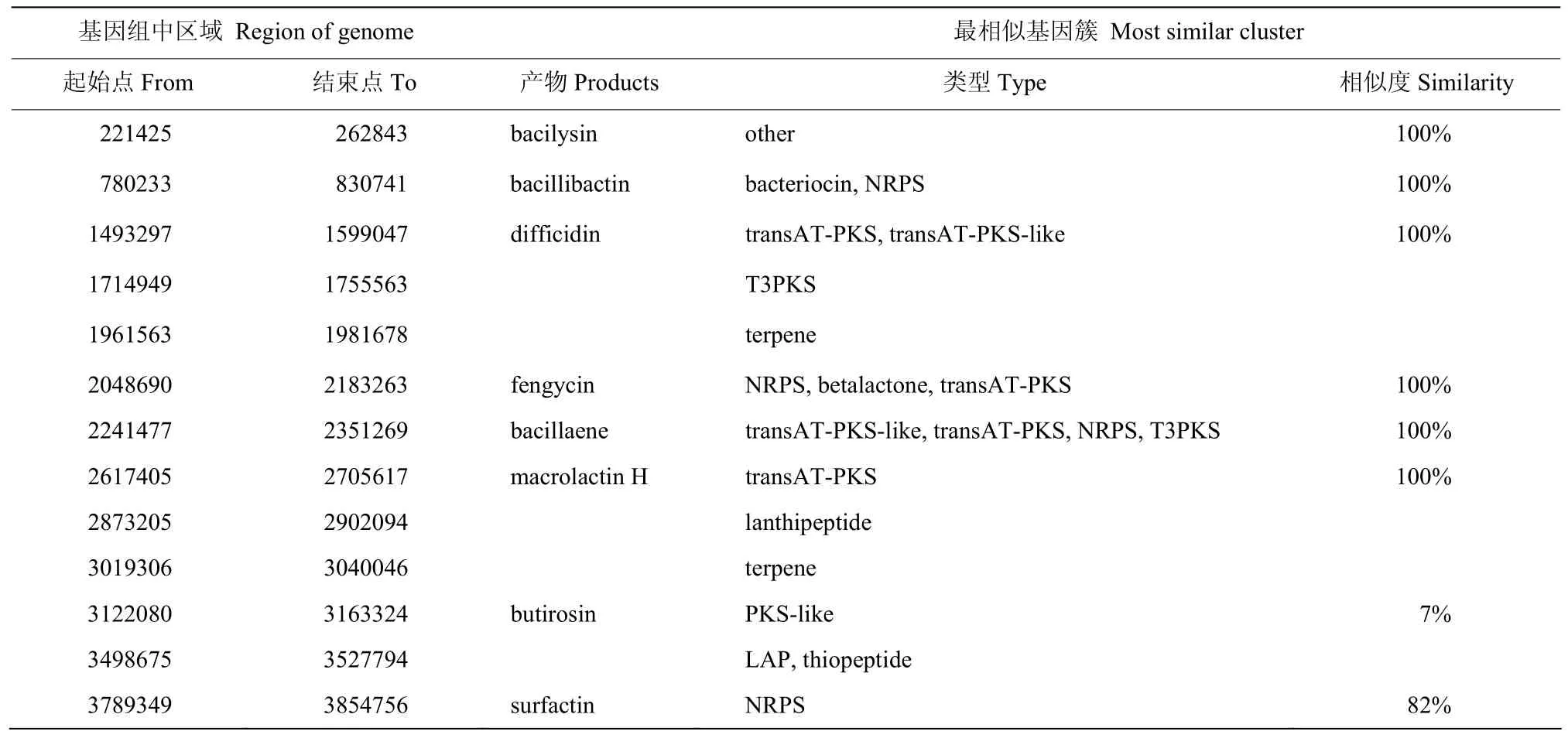
表4 菌株hzq1601次生代谢产物合成区域鉴定结果Table 4 Identified secondary metabolite regions in the strain hzq1601 genome
3 讨论
植物病害生防菌因其高度的环境友好性而具有良好的应用前景。以枯草芽胞杆菌、蜡质芽胞杆菌和多粘类芽胞杆菌为主要成分的生防菌剂已经在小麦赤霉病防治应用中取得了一定的效果[10,11],但是面对我国农业绿色发展的新要求,高效生防菌剂和配套应用技术的研发仍然是当前小麦赤霉病绿色防控的迫切需求和长远需要。筛选对赤霉病菌具有高生防活性的微生物是生防菌剂开发的前提。解淀粉芽胞杆菌分布广泛,因其可产生丰富的具有生防活性的次生代谢物、植物促生作用和环境适应性强,极具生防菌剂开发潜力[12-14]。近年来。国内学者从土壤、小麦、中草药植株等材料中筛选出对小麦赤霉病具有生物活性的解淀粉芽胞杆菌菌株[15-18],鉴定出对禾谷镰刀菌有效的拮抗物质macrolactin A和subtilisin等[17,19]。本研究获得的解淀粉芽胞杆菌hzq1601对禾谷镰刀菌具有较强的抑菌活性,基因组含有6种已知的次生代谢产物合成基因簇,这些次生代谢产物已经被证明具有拮抗植物病原菌、诱导抗病性、促进生物膜形成等功能[20-26],但在菌株hzq1601中这些物质是否与其对禾谷镰刀菌的抑菌活性有关仍需验证。多种次生代谢产物合成基因簇在菌株hzq1601中出现,也说明其可能存在较宽的抑菌谱,在植物病害防控中也将有更为广泛的应用前景。
由于自然环境的不可控性,生物菌剂田间使用时对病害的防治效果易受环境影响。研究发现生防菌剂与化学药剂协同可有效提高生防菌的防治效果[27-31],这可能与部分化学杀菌剂可通过弱化病菌而间接正向调控生防菌的原因有关[32]。但是,生防菌剂与化学药剂混用并不总是产生正向效果,生防菌的存活或者其生物活性也可能受化学药剂的负面影响。因此,如果能正确地筛选出生防菌与化学药剂协同组合,不仅可以发挥生防菌防病效果,也可有效减少化学药剂的用量。本研究结果显示菌株hzq1601与多菌灵具有较好的相容性,田间防效也显示菌株hzq1601与多菌灵协同使用在确保防效的前提下可大幅降低了多菌灵的用量。考虑到后续菌剂研发和应用,菌株hzq1601与多菌灵复配将能更好发挥其对小麦赤霉病的生防功效。

