刺参对生境的选择性及其行为生理响应
姜玉山 宋亚彩 方玲 吕菲 张沛东
(中国海洋大学,海水养殖教育部重点实验室,青岛 266003)
刺参(Apostichopus japonicus)是重要的食用参种,因其较高的营养价值在我国被列为“海八珍”之一[1]。随着我国人民生活水平提高,市场对刺参的需求不断增加,刺参增养殖业的发展迅速增长[2]。根据刺参的生态习性,利用人工海珍品礁进行刺参增养殖目前得到广泛应用。张艳等[3]调查了投放海珍品礁前后刺参增殖区沉积物粒径的变化,发现礁体投放后增殖区沉积物的中值粒径和平均粒径均高于非礁区,礁体投放改变了周围水体的水动力学特征,导致增殖区海底底质粗糙化,利于刺参的附着及活动。丁增明等[4]研究发现,通过投放海珍品礁体进行刺参增养殖,刺参存活率可达60%以上,且刺参无病害、生长快。但近年来受气候变化和人类活动影响,刺参增殖区底部海水缺氧等极端环境变化时有发生,对刺参增养殖业带来严重威胁。刘国山等[5]报道,2013年威海双岛湾人工鱼礁区由于底部海水严重缺氧引发刺参大规模死亡。因此,进一步探究适宜的天然绿色生境,对实现刺参增养殖的可持续健康发展具有重要意义。
研究发现,鳗草(Zostera marina)海草床是刺参的天然栖息地,其对刺参具有较强的养护作用。鳗草碎屑不仅可作为刺参的直接食物来源[6],而且可显著提高刺参的免疫水平,如唐薇等[7]研究发现,刺参摄食鳗草碎屑后,其体腔液的免疫酶活性高于未摄食鳗草碎屑的对照组,其中超氧化物歧化酶活性是对照组1倍。此外,鳗草生境还利于提高刺参的存活率,如刘元刚等[8]通过刺参生态养殖实验发现,刺参在鳗草围堰的存活率为35%,显著高于无鳗草植株的其他围堰。这些研究均证明,构建以鳗草海草床为生境载体的刺参绿色生态牧场具备广阔的应用潜力。
为明确刺参对不同生境的选择性及其行为生理响应过程,在室内人工条件下模拟了裸沙、石块与鳗草生境,研究了刺参对不同生境的选择性和偏好性,量化了刺参在不同生境的蠕动、摄食和排便行为特征,分析了不同生境条件下刺参肌肉ATP含量及体腔液儿茶酚胺类激素含量的差异,以期补充完善刺参行为生理生态学理论内容,并为刺参绿色生态牧场的建设提供理论支撑。
1 材料与方法
1.1 幼参来源
实验用幼参购自马山集团有限公司,平均体重为10 g/头,运至实验室后使用16个42 cm×36 cm×33 cm(长×宽×高)的玻璃缸进行暂养。在暂养期间,保持海水水温(17±1)℃,盐度32±1,pH8.2—8.3,使用气泵24h连续充气并保证水体溶解氧含量≥6 mg/L,使用荧光灯营造日光条件(光照强度>2000 lx,光照时长6:00—18:00)。每2天换水1次,换水量为玻璃缸水量的1/3。每天投喂商用幼参专用饲料(主要成分为鼠尾藻、马尾藻和进口鱼粉等),根据王晓艳等[9]对刺参饵料配置的研究,将投饵量设置为刺参体重的6%,并每天观察刺参摄食情况及时调整投饵量。
1.2 实验设计
刺参对不同生境的选择性选取刺参典型资源分布区—山东省荣成市天鹅湖海草床及其周边海域礁石区作为模拟生境[10]。在室内营造鳗草生境、裸沙生境和石块生境,研究刺参对不同生境的选择性及光照条件(日光条件和黑暗条件)对刺参生境选择性的影响。根据Xu等[11]调查的天鹅湖海草床的平均植株密度(200 shoots/m2)、Zhang等[12]调查的天鹅湖底质状况与礁石分布情况等,设置鳗草-裸沙组、鳗草-石块组和石块-裸沙组3个实验组(表 1)。实验期间使用的底泥均来自荣成天鹅湖的天然底泥,其底质类型为砂质粉砂及粉砂质砂。

表1 实验组的设置Tab.1 Setting of experimental groups
光照条件设置为日光条件(6:00—18:00)和黑暗条件(18:00—次日6:00),其中日光条件根据Yang等[13]的实验结果,光照强度设置为2000 lx,黑暗条件时用黑幕包围实验水槽,其光照强度为0。
刺参对不同生境的偏好性及其行为生理响应过程按照选择性实验的方法,在圆形水槽同时设置裸沙生境、石块生境和鳗草生境,研究刺参对不同生境的偏好性,并观察刺参在不同生境的行为表现(运动、摄食和排泄行为),查明刺参的行为响应特性。在实验结束后,采集刺参样品,并选择暂养条件下的刺参作为对照组,测定刺参肌肉的ATP含量和体腔液的儿茶酚胺类激素含量,以明确刺参在不同生境的生理状态。
1.3 实验装置与过程
刺参对不同生境的选择性刺参选择性实验采用3组方形水槽(图 1)。每个水槽规格为96 cm×56 cm×60 cm(长×宽×高)。将水槽按照4∶1∶4的比例划分为3部分,并用隔板隔开,从而在水槽中间的10 cm×56 cm长方形区域形成刺参缓冲区,在缓冲区两侧随机按照实验组设置不同的生境。

图1 鳗草-裸沙组(A)、鳗草-石块组(B)和裸沙-石块组(C)实验装置示意图Fig.1 Schematic diagram of experimental apparatus of group ZS (A),group ZR (B),and group RS (C)
每次实验时间为6:00至次日6:00。实验开始前,各实验组随机选择10头刺参,将其放入中间缓冲区适应30min。实验期间的环境条件与暂养条件保持一致。
实验于6:00开始,打开各实验组照明灯,营造日光条件(光照强度2000 lx),然后将各实验组的隔板移除,使用目视法记录刺参在各生境的分布状态,计算平均聚集率。
至18:00,关闭各实验组照明灯,并用黑幕将实验装置围遮,营造黑暗条件(光照强度0),记录刺参在各生境的分布状态,计算平均聚集率。记录时依次打开各实验组照明灯,迅速记录刺参分布状态,记录后及时关闭照明灯。
至次日6:00,实验结束,将各处理组刺参取出,移至暂养水槽不再使用,并变换实验水槽位置以消除水槽位置对刺参生境选择性的影响。实验重复5次(n=5),期间不投饵以消除饵料对刺参选择性的影响。
刺参对不同生境的偏好性及其行为生理响应过程刺参的偏好性实验采用高110 cm、直径160 cm的圆形水槽,在其中间选取直径20 cm的圆形区域作为缓冲区,其余空间平均分为3个区域,按照选择性实验的配置方法,随机营造鳗草生境、裸沙生境和石块生境(图 2)。

图2 刺参偏好性实验的装置示意图Fig.2 Schematic diagram of apparatus in preference experiment of A.japonicus
每次实验持续7d。在实验开始前,随机选择20头刺参,将其放入中间缓冲区,并用圆形挡板将刺参与其他生境隔开,适应1d。实验期间的环境条件与暂养条件保持一致,并按照选择性实验的方法营造光照条件。
在适应结束后,于正式实验第1天的6:00移除圆形挡板,容许刺参随机选择各生境,持续6d。于实验第7天的6:00开始,每1h使用目视法观察并记录刺参在各生境的分布状态并录像,第8天的6:00结束。
根据录像统计刺参在各生境的蠕动、摄食和排泄行为响应。根据Sun等[14]的研究方法,刺参从肛门端至口端依次收缩,产生位移并恢复平静状态的过程视为刺参完成1次蠕动,刺参口端触手伸缩,将食物送进口中的过程视为刺参完成1次摄食。收集刺参粪便,测量并记录刺参粪便的长度和厚度。
在各生境随机选取刺参3头,并同期随机选择暂养条件下的刺参3头作为对照组,解剖并收集刺参的体腔液,立刻用于儿茶酚胺类激素(皮质醇、多巴胺、肾上腺素和去甲肾上腺素)含量的测定,解剖后的刺参去除呼吸树和石灰环并分离刺参的肌肉组织,用于刺参肌肉ATP含量的测定。
实验结束,将刺参取出,移至暂养水槽不再使用,并随机变换实验水槽内的生境位置以消除生境位置对刺参生境偏好性的影响。实验重复5次(n=5),期间不投饵以消除饵料对刺参偏好性的影响。
1.4 数据处理和样品分析
平均聚集率(Mean attractive rate,MAR)根据林承刚[15]的研究,MAR计算公式如下:
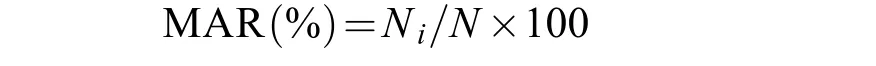
式中,Ni为刺参每小时在某生境的分布数量,N为刺参总数量。
行为特征(1)蠕动频率(Crawling frequency,CF)
根据Yang等[16]的方法,计算公式如下:

式中,C代表蠕动次数;T代表观察时间(min)。
(2)触手伸缩频率(Tentacles activity frequency,TAF)
根据Sun等[14]的方法,计算公式如下:

式中,TA为刺参完成触手伸缩并舒张的次数;T为观察时间(min)。
生理状态(1)肌肉ATP含量采用磷钼酸比色法测定[17]。刺参解剖后将其肌肉与煮沸的去离子水按照重量(g)∶体积(mL)=1∶9 的比例进行匀浆,匀浆液抽提1min后采用4000 r/min离心1min,取上清液,使用南京建成生物研究所生产的试剂盒(A095-1-1)测定ATP含量。(2)刺参体腔液儿茶酚胺类激素含量采用酶联免疫吸附法(ELISA)并参考丁奎[18]的样品处理方法进行测定。取刺参体腔液,加入一定量的磷酸缓冲液,2000 r/min条件下离心20min,取上清液,使用江苏酶标生物科技有限公司生产的多巴胺(MB-10128B)、肾上腺素(MB-21370B)、去甲肾上腺素(MB-21402B)和皮质醇(MB-2229B)ELISA试剂盒测定4种儿茶酚胺类激素含量。
1.5 统计分析
实验数据使用平均值±标准误(mean±SE)表示。利用SPSS 25软件对数据进行统计分析。采用t检验分析比较在日光条件与黑暗条件下刺参平均聚集率的差异。采用单因素方差(One-way ANOVA)分析偏好性实验中各生境刺参的平均聚集率、蠕动频率、摄食频率、粪便长度、粪便宽度、ATP含量、多巴胺含量、肾上腺素含量、去甲肾上腺素含量和皮质醇含量的差异,若差异显著,使用Duncan法进行组间差异性比较,以P<0.05作为差异显著水平。
2 结果
2.1 刺参对不同生境的选择性
鳗草-裸沙组,刺参在鳗草生境的平均聚集率在70%—100%,显著高于刺参在裸沙生境的平均聚集率(P<0.05),平均是其5倍(图 3A);石块-裸沙组,刺参在石块生境的平均聚集率在30%—80%,平均是裸沙生境的2倍(图 3B);鳗草-石块组,刺参在鳗草生境的平均聚集率在60%—90%,显著高于刺参在石块生境的平均聚集率(P<0.05),平均是其2倍(图 3C)。

图3 鳗草-裸沙组(A)、石块-裸沙组(B)和鳗草-石块组(C)刺参平均聚集率的变化Fig.3 The change in MAR of A.japonicus in group ZS (A),group RS (B) and group ZR (C)
光照条件对刺参平均聚集率存在显著影响(图 4)。鳗草生境,刺参在黑暗条件下的平均聚集率达到80%,显著高于日光条件的平均聚集率;石块生境和裸沙生境,刺参在黑暗条件下的平均聚集率低于日光条件的平均聚集率,相比日光条件分别下降6%和10%。

图4 不同光照条件对鳗草-石块组(A)、石块-裸沙组(B)和鳗草-裸沙组(C)刺参平均聚集率的影响Fig.4 The effect of different light conditions on the MAR of A.japonicus in group ZR (A),group RS (B) and group ZS (C)
2.2 刺参对不同生境的偏好性及其行为生理响应
刺参对不同生境的偏好性刺参对不同生境的偏好存在显著差异,其在鳗草生境的平均聚集率达到48%,显著高于刺参在其他2个生境的平均聚集率(P<0.05),分别是裸沙生境和石块生境的4倍和2.5倍(图 5)。

图5 不同生境对刺参平均聚集率的影响Fig.5 The effect of different habitats on the MAR of A.japonicus
刺参在不同生境的行为特征刺参在鳗草生境的平均蠕动频率达到0.65/min,显著高于其他两个生境(P<0.05),是石块生境和裸沙生境的2倍(图 6A)。刺参在鳗草生境的摄食活动显著高于其他两生境(P<0.05),其触手伸缩频率达到0.43/min,是石块生境的2倍(图 6B)。刺参在鳗草生境的粪便长度和厚度显著高于其他两生境(P<0.05),其粪便长度是石块生境的1.9倍,粪便厚度是石块生境的2.5倍(图 6C和6D)。

图6 不同生境对刺参蠕动频率(A)、触手伸缩频率(B)、粪便长度(C)和粪便厚度(D)的影响Fig.6 The effect of different habitats on the crawling frequency(A),tentacles activity frequency (B),feces length (C) and feces thickness (D) of A.japonicus
刺参在不同生境的肌肉ATP含量刺参在鳗草生境的肌肉ATP含量达到860 μmol/g prot,显著高于其他两生境刺参肌肉ATP含量(P<0.05),是石块生境和裸沙两生境的约2倍(图 7)。
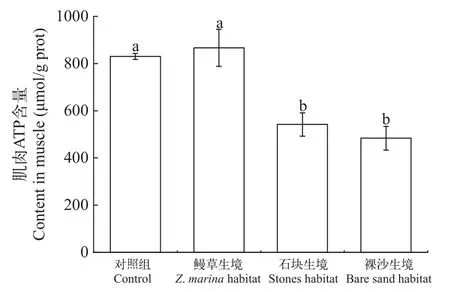
图7 不同生境对刺参肌肉ATP含量的影响Fig.7 The effect of different habitats on the ATP content in the muscle of A.japonicas
刺参在不同生境的体腔液儿茶酚胺类激素含量刺参在鳗草生境的体腔液多巴胺含量为929 pg/mL,显著高于对照组(P<0.05),与石块生境和裸沙生境的没有显著差异(P>0.05;图 8A)。刺参在石块生境的体腔液皮质醇含量为1340 pg/mL,显著高于对照组及其他两生境(P<0.05),是鳗草生境和裸沙生境的1.1倍(图 8B)。不同生境之间刺参体腔液的肾上腺素和去甲肾上腺素含量均无显著差异(P>0.05;图 8C和8D)。

图8 不同生境对刺参多巴胺(A)、皮质醇(B)、去甲肾上腺素(C)和肾上腺素含量(D)的影响Fig.8 The effect of different habitats on the dopamine (A),cortisol (B),noradrenaline (C) and epinephrine contents (D) in cavity fluid of A.japonicas
3 讨论
3.1 刺参的生境选择性和偏好性
生境选择性与偏好性实验表明,刺参对鳗草生境具有较强的选择和偏好,其中选择性实验显示刺参在鳗草生境的平均聚集率可达60%以上,分别是石块生境和裸沙生境的2倍和5倍;偏好性实验显示,刺参在鳗草生境的平均聚集率达到48%,分别是石块生境和裸沙生境的2.5倍和4倍,研究结果与已有报道的结论类似。如王学广[19]研究发现,规格50 g的刺参对鳗草养殖区具有明显的选择性,其在鳗草生境的聚集率是泥沙生境的10倍;佟飞[20]研究表明,刺参一般选择鳗草草床栖息,且鳗草草床对刺参有较好的增殖效果;高亚平等[21]发现,养殖池塘中面积占比为60%的鳗草斑块栖息的刺参数量可达养殖池塘刺参总数量的90%。刺参对鳗草生境的选择和偏好可能与鳗草草床的遮阴作用与水质净化功能有关。王喜涛[22]发现,荣成天鹅湖鳗草海草床在春夏季的光照强度约为临近裸沙区的58%,日平均水温低于裸沙区,其明显的遮阴作用为负趋光性的刺参提供了遮蔽场所。Carmen等[23]研究显示,鳗草草床对氮和磷的吸收量分别可达0.8—1.8和0.04—0.07 kg/d,其强大的水质净化功能为海草床营造了良好的水质条件,从而吸引刺参的栖息。
研究发现,刺参对石块生境也具有一定的选择和偏好,其中石块-裸沙组选择性实验显示刺参在石块生境的平均聚集率是裸沙生境的2倍,偏好性实验刺参在石块生境的平均聚集率为20%。实验还发现,刺参在石块生境通常聚集在石块底部的粗糙区域,仅个别刺参栖息在石块表面,这可能与石块颜色及表面粗糙程度有关。张辉等[24]研究发现,刺参在黄色附着基的平均聚集率仅为相同形状黑色附着基的10%。Sun等[25]发现,冰岛刺参(Cucumaria frondosa)在光滑石块上平均聚集率是粗糙石块的70%。本实验使用的石块表面较光滑,且石块表面附着较多泥沙从而呈现与底泥相同的黄色,导致刺参的选择不高。
刺参对裸沙生境的选择性最低,其中选择性实验显示,刺参在裸沙生境的平均聚集率低于40%,偏好性实验刺参在裸沙生境的平均聚集率仅为16%,印证了刺参对沙质和沙泥底质有忌避效应的观点。赵鹏等[26]研究发现,刺参倾向于选择粗砂和砾石比例较高的海底,对黏土、粉砂等比例较高的底质选择性较低;Dobson等[27]发现,糙海参(Holothuria scabra)在粗糙底质生境的摄食率更高。Hu等[28]研究显示,刺参对底质条件不利于其运动的生境的平均选择率仅为对照组的30%。本实验使用的底泥主要以砂质粉砂及粉砂质砂为主,不利于刺参的管足附着和运动,从而导致刺参在裸沙生境的平均聚集率较低。
研究发现,光照条件对刺参平均聚集率存在显著影响,其中鳗草生境中刺参在黑暗条件下的平均聚集率达到80%,显著高于日光条件。Sun等[13]研究也发现,当环境昼夜切换时,刺参会发生迁移活动。夜间是刺参摄食的主要时段,鳗草叶片及其附着生物是刺参的优良饵料,从而导致黑暗条件下刺参向饵料丰富的鳗草生境移动,其在鳗草生境的平均聚集率显著升高[29,30]。在黑暗条件下,刺参向鳗草生境的移动摄食,导致刺参在石块生境和裸沙生境的平均聚集率相比日光条件下降。Dong等[31]也发现,光照强度由500 lx下降至0时,刺参逐渐进行采食活动,栖息于遮蔽场所的刺参聚集率由90%下降至50%。
3.2 刺参在不同生境的行为特征
蠕动、摄食与排泄是刺参重要的生境适应性行为[32]。蠕动行为是刺参进行移动的主要形式[14]。刺参能够通过口端的触手感知食物存在,并使用触手收集口部周围的食物并送入口中。刺参排便行为则反应了刺参的消化能力[34]。本实验结果发现,刺参在鳗草生境的行为响应强烈,其蠕动频率和触手伸缩频率是石块生境和裸沙生境的2倍,粪便长度和厚度分别为石块生境的2倍和2.5倍。
鳗草生境的底质营造、饵料效应与复杂结构可能是刺参行为响应强烈的原因。研究发现,刺参的运动能力与底质条件密切相关,粗糙底质可为刺参管足提供良好的附着基,促进刺参蠕动[33]。鳗草生境含有大量的鳗草碎屑,在生境底部形成了粗糙表面,从而利于刺参蠕动。鳗草碎屑也为刺参提供了大量的潜在食物来源,因此刺参在鳗草生境的食物丰富且来源更广泛[35]。Hu等[28]研究发现,刺参摄食时需要收缩腹部收集食物,从而消耗较多能量,而倾角60°的礁体为刺参提供了一定的辅助,促进其在礁体上的摄食频率是无礁体区域摄食频率的4倍。本实验也发现,刺参会黏附在鳗草叶鞘上进行摄食,这可能是因为鳗草结构为刺参提供了物理辅助,从而增加其摄食效率。
3.3 刺参在不同生境的生理特征
ATP是动物肌肉收缩的能量来源,因此ATP含量的变化对刺参的运动具有较大影响[35]。茹小尚[36]研究发现,在刺参进入繁殖期后,其大量能量被用于性腺组织,肌肉组织ATP含量降低,导致刺参运动耐力下降。本研究发现,刺参在鳗草生境的肌肉ATP含量为860 μmol/g prot,是石块生境和裸沙生境的2倍,其在鳗草生境的活动比较旺盛。
研究发现,儿茶酚胺类激素能够作为信息传导物质影响动物的摄食、移动、呼吸、繁殖和免疫[35]。如Huo等[37]研究发现,刺参夏眠时肾上腺素与去甲肾上腺素含量上升,从而补偿刺参免疫活动的缺失。Pei等[38]比较了7 g/头刺参在养殖密度分别为0.5和0.8 头/L的皮质醇含量与生长速率,发现在高密度条件下刺参的皮质醇含量是低密度条件的1.5倍,且刺参的生长速率降低80%。本研究发现,刺参在各生境的体腔液多巴胺、去甲肾上腺素和肾上腺素含量均无显著差异,可能是因为本实验选择的3种生境均是刺参较适宜的栖息生境,实验期间刺参的放置密度也较适宜,因此并未对刺参产生胁迫作用。
综上,刺参对鳗草生境具有明显的选择性,其在鳗草生境的行为活跃,生理状态良好,说明鳗草草床是刺参绿色生态牧场构建的优良生境。

