山杏核壳黑色素提取及其金属螯合物的螯合工艺优化
高 莉,刘琳琳,刘盼盼,徐宏宇,王海宾,刘海英,杨 柳
(中北大学化学工程与技术学院,山西太原 030051)
黑色素(melanin)是主要由吲哚或酚类化合物聚合而成的一类高分子聚合物,是目前已知生物色素中最广泛的一类色素,在动植物和微生物中广泛存在[1−2],因其抗氧化、抗辐射和抑菌等生物活性而广泛用于食品和医药领域[3−7]。研究发现,原物质与金属螯合后,可改变甚至增强原物质的一些生物活性,拓宽了原物质的应用范围,且金属与原物质形成螯合物也有利于金属离子在有机体内的吸收和转运,目前主要研究的有黄酮金属螯合物、透明质酸金属螯合物等[8−11],有关黑色素金属螯合物的研究较少。螯合金属离子是黑色素重要的生物学功能之一[12−14],黑色素含有C=O、-COOH、-NH 等大量带负电的活性官能团,既可作电子供体又可作电子受体[15−17],且能为金属离子提供多个非等效结合位点,可与带正电的金属离子形成稳定的螯合物[18−20]。黑色素金属螯合物不仅具有黑色素的功能性质,还兼具金属离子的生物活性,在性能和应用研究方面更有协同增效作用,可充分发挥黑色素金属螯合物的功能作用,还可降低金属离子在机体及生物环境中富集造成的负面影响[20]。
目前已报道的提取黑色素的植物主要有花椒籽、黑木耳和黑芝麻等[1,21],山杏是我国北方盛产水果之一,其核壳是山杏在制作食品过程中的主要废料,资源蕴藏量大,为避免资源浪费,目前逐渐有研究将其中的生物活性成分—黑色素进行提取并加以研究与利用[22],李红姣等[23]通过响应面设计确定了超声波辅助提取山杏种皮黑色素的工艺为氢氧化钠浓度0.33 mol/L、料液比1:10(g/mL)、提取温度63.07℃,在此条件下黑色素得率为4.14%。
因此,本实验在提取山杏核壳黑色素的基础上将其分别与Fe3+、Cu2+和Zn2+三种金属离子配合,确定最佳制备工艺,之后对三种黑色素金属螯合物进行表征以初步了解其结构,为山杏核壳黑色素及其金属螯合物作为天然食品添加剂及金属元素补充剂在医药和食品等领域的应用提供了基础研究。
1 材料与方法
1.1 材料与仪器
山杏核壳 山西省杏仁加工厂;氢氧化钠、浓盐酸 分析纯,国药集团化学试剂有限公司;无水乙醇分析纯,天津市光复科技发展有限公司;纤维素酶、糖化酶 生物试剂,索莱宝公司;硫酸铜、氯化锌、锌试剂、铜试剂、硫酸亚铁铵、氯化铁 分析纯,天津市北辰方正试剂厂。
400Y 高速粉碎机 永康氏柏欧五金制品有限公司;SB-5200 DTDN 超声波清洗机 宁波新芝生物科技股份有限公司;TDL-5-A 高速离心机 上海安亭科学仪器厂;PHS-3C 型酸度计 杭州奥利龙有限公司;ReadMax 1900 光吸收全波长酶标仪 上海闪谱生物科技有限公司;UV-5200 紫外可见分光光度计 上海元析仪器有限公司;Perkin ElmerSpectrum Two 红外光谱分析仪 天津市能谱科技有限公司;Tecnai G2 F20 S-TWIN TMP 扫描电镜 FEI有限公司。
1.2 实验方法
1.2.1 山杏核壳黑色素的提取与纯化 参考杨柳[24]的实验方案,采用碱溶酸沉法从山杏核壳中提取纯化黑色素,以黑色素的得率(%)为指标确定提取的最佳条件。具体实验步骤如下:称取适量粉碎后的山杏核壳粉末,按料液比1:20 溶于2 mol/L 的NaOH 溶液中,静置提取3 h 后离心除去固体,之后使用循环水真空泵对液体抽滤,将上清液用稀盐酸溶液调pH至2.2,静置沉淀2 h,再离心,除去上清液。向所得固体中加一定蒸馏水,调其pH 至5.00,加入适量纤维素酶,55 ℃水浴1 h 后离心去除上清液,再向所得固体中加一定蒸馏水,调其pH 至4.50,加入适量糖化酶,60 ℃水浴1 h 后离心去除上清液。对两种酶处理后的固体按料液比为1:30 加入2 mol/L 的NaOH 溶液,超声波辅助溶解30 min,酸沉后离心去除上清液,烘干后所得固体即为黑色素,4 ℃保存。

式中:m0表示提取的黑色素的质量,g;m 表示山杏核壳的质量,g。
1.2.2 山杏核壳黑色素提取的单因素实验 固定碱浓度1.5 mol/L,提取时间5 h,酸沉pH2,离心转速4000 r/min,超声时间25 min,考察料液比(1:5、1:10、1:15、1:20、1:25 g/mL)对山杏核壳黑色素得率的影响;固定料液比1:15 g/mL,提取时间5 h,酸沉pH2,离心转速4000 r/min,超声时间25 min,考察碱浓度(0.5、1.0、1.5、2.0、2.5 mol/L)对山杏核壳黑色素得率的影响;固定料液比1:15 g/mL,碱浓度1.5 mol/L,酸沉pH2,离心转速4000 r/min,超声时间25 min,考察提取时间(1、3、5、7、9 h)对山杏核壳黑色素得率的影响;固定料液比1:15 g/mL,碱浓度1.5 mol/L,提取5 h,离心转速4000 r/min,超声时间25 min,考察酸沉pH(1、1.5、2.0、2.5、3.0)对山杏核壳黑色素得率的影响;固定料液比1:15 g/mL,碱浓度1.5 mol/L,提取5 h,酸沉pH2,超声时间25 min,考察离心转速(1000、2000、4000、6000、8000 r/min)对山杏核壳黑色素得率的影响;固定料液比1:15 g/mL,碱浓度1.5 mol/L,提取5 h,酸沉pH2,离心转速4000 r/min,考察超声时间(5、15、25、35、45 min)对山杏核壳黑色素得率的影响。每个水平重复三次。
1.2.3 响应面法对山杏核壳黑色素提取工艺的优化根据单因素结果确定响应面因素及相应水平,采用Design Expert 10.0 软件进行Box-Behnken 设计试验,试验因素水平编码表见表1。始终固定提取5 h 和离心转速6000 r/min 不变,以山杏核壳黑色素的得率为评价指标,考察料液比、碱浓度、酸沉pH、超声时间对山杏核壳黑色素提取的影响。
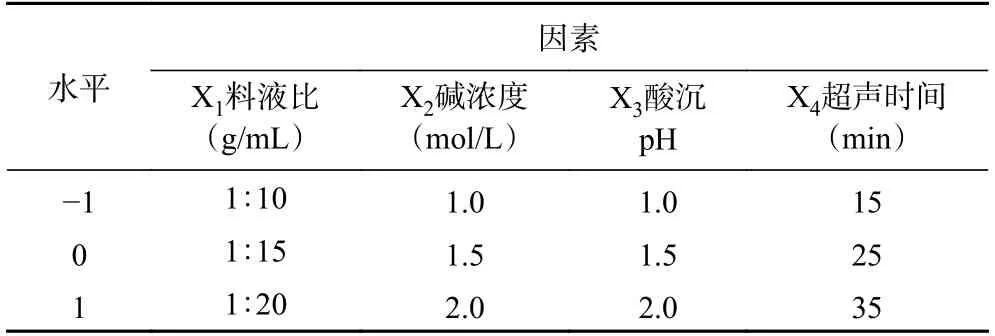
表1 响应面试验因素及水平设计Table 1 Response surface test factors and horizontal design
1.2.4 山杏核壳黑色素的紫外-可见光谱(UV-Vis)表征 山杏核壳黑色素溶于碱性溶液,以0.1 mol/L 氢氧化钠溶液为参照,200~800 nm 范围内扫描其光吸收情况。
1.2.5 山杏核壳黑色素的红外光谱(FT-IR)表征 山杏核壳黑色素与适量溴化钾混匀压片,4000~400 cm−1范围扫描其红外光谱。
1.2.6 山杏核壳黑色素的扫描电镜(SEM)表征 将山杏核壳黑色素置于贴了双面导电胶的样品台上,喷金后观察其表面形貌。
1.2.7 山杏核壳黑色素铁螯合物的螯合工艺优化采用溶液共沉淀法制备黑色素铁螯合物[12],将黑色素溶液与氯化铁溶液共混,37 ℃避光反应一段时间后离心取沉淀,水洗两次后干燥即得黑色素铁螯合物(制备黑色素锌螯合物和黑色素铜螯合物的步骤同上)。以黑色素铁螯合物结合效果为指标进行单因素实验(根据紫外吸收峰变化情况判断)。固定反应pH5.5,避光反应10 h,考察铁离子浓度(2、3、4、5、6 mmol/L)三氯化铁溶液对结合效果的影响;固定铁离子浓度5 mmol/L 的三氯化铁溶液,避光反应10 h,考察反应pH(3.0、4.0、4.5、5.5、6.5)对结合效果的影响;固定铁离子浓度5 mmol/L 的三氯化铁溶液,反应pH5.5,考察避光反应时间(6、8、10、12、24 h)对螯合效果的影响,各重复三次。
1.2.8 山杏核壳黑色素铜螯合物的螯合工艺优化以黑色素铜螯合物结合效果为指标进行单因素实验(根据紫外吸收峰变化情况判断)。固定反应pH7.5,避光反应6 h,考察铜离子浓度(2、3、4、5 mmol/L)硫酸铜溶液对结合效果的影响;固定铜离子浓度4 mmol/L 的硫酸铜溶液,避光反应10 h,考察反应pH(5.5、6.5、7.5、8.5、9.5)对结合效果的影响;固定铜离子浓度4 mmol/L 的硫酸铜溶液,反应pH7.5,考察避光反应时间(2、4、6、8、10 h)对螯合效果的影响,各重复三次。
1.2.9 山杏核壳黑色素锌螯合物的螯合工艺优化以黑色素锌螯合物结合效果为指标进行单因素实验(根据紫外吸收峰变化情况判断)。固定反应pH6.5,避光反应6 h,考察锌离子浓度(2、3、4、5 mmol/L)氯化锌溶液对结合效果的影响;固定锌离子浓度3 mmol/L 的氯化锌溶液,避光反应6 h,考察反应pH(4.5、5.5、6.5、7.5、8.5)对结合效果的影响;固定铜离子浓度3 mmol/L 的氯化锌溶液,反应pH7.5,考察避光反应时间(2、4、6、8、10 h)对螯合效果的影响,各重复三次。
1.2.10 三种黑色素金属螯合物螯合程度的比较3 份20 mL 的山杏核壳黑色素溶液(质量浓度为0.04 mg/mL)分别加入2 mL 4 mmol/L 三氯化铁、硫酸铜和氯化锌溶液,调pH 至6.5,避光反应6 h。制作不同金属离子标准曲线,通过分光光度法测定溶液中金属离子剩余浓度(即未与黑色素螯合的金属离子浓度),进而求出金属离子螯合率。

式中:C0—溶液中金属离子初始浓度,mg/L;Ce—反应后溶液中离子的剩余浓度,mg/L。
1.2.11 山杏核壳黑色素金属螯合物的紫外-可见光谱(UV-Vis)表征 三种黑色素金属螯合物溶于碱性溶液,以0.1 mol/L 氢氧化钠溶液为参照,200~800 nm范围内扫描其光吸收情况得到其紫外光谱图。
1.2.12 山杏核壳黑色素金属螯合物的红外光谱(FTIR)表征 三种黑色素金属螯合物分别与适量溴化钾混合压片,4000~400 cm−1范围扫描其红外光谱。
1.2.13 山杏核壳黑色素金属螯合物的扫描电镜(SEM)表征 将三种黑色素金属螯合物置于贴了双面导电胶的样品台上,喷金后观察其表面形貌,并利用能谱仪对其进行元素扫描。
1.3 数据处理
2 结果与分析
2.1 山杏核壳黑色素的提取工艺优化
2.1.1 单因素实验结果 随着料液比从1:5 g/mL 增加到1:15 g/mL,山杏核壳黑色素的得率逐渐增大,这可能是因为料液比的适当增加使山杏核壳与碱溶液充分混合,提取量上升。但料液比从1:15 g/mL增加到1:25 g/mL 时,得率基本保持不变(如图1a)。因此,从成本考虑,选择最适料液比为1:15 g/mL。
随着氢氧化钠浓度从1.0 mol/L 增至1.5 mol/L时,山杏核壳黑色素的得率的增长速度最快,继续增加到2.5 mol/L 时,得率增幅较小(如图1b)。因此,从成本考虑,选择最适氢氧化钠浓度为1.5 mol/L。
山杏核壳黑色素的得率随提取时间的增加而平缓增加,且5 h 后增加速度更加缓慢,说明提取时间对山杏核壳黑色素得率的影响不大(如图1c)。因此,选择最适提取时间为5 h。
酸沉pH 为1 和1.5 时,山杏核壳黑色素的得率基本相同,逐渐增加到3.0 时,得率逐渐减少(如图1d),这可能是因为随着pH 的增加,黑色素的溶解性逐渐增大,从而使沉淀的黑色素的质量降低[25]。因此,从成本考虑,选择最适酸沉pH 为1.5。
离心转速从1000 r/min 到6000 r/min,山杏核壳黑色素的得率随着离心转速的增加基本呈现不变,达到8000 r/min 时,得率有下降趋势(如图1e)。这是由转速过高时,杂质与提取液的分离效果较差所导致的。因此,从成本考虑,选择离心转速为6000 r/min操作。
超声时间从5 min 到25 min,山杏核壳黑色素的得率随之增加,从25 min 到45 min,得率的增长幅度基本趋于平缓(如图1f)。超声提取使黑色素固体震碎程度更大,使碱溶液更加有效的和黑色素接触,有助于黑色素溶解于碱溶液,但提取时间对得率的影响有限。因此,从成本考虑,选择最适超声时间为25 min。

图1 山杏核壳黑色素提取单因素实验结果Fig.1 Single factor test results of melanin extraction from apricot kernel shell
2.1.2 响应面试验结果 根据响应面结果(表2),利用Design Expert 10 对山杏核壳黑色素的得率Y 与料液比X1(g/mL)、氢氧化钠浓度X2(mol/L)、酸沉pH X3和超声时间X4(min)之间进行多元二次回归拟合,得到了一个回归方程模型:
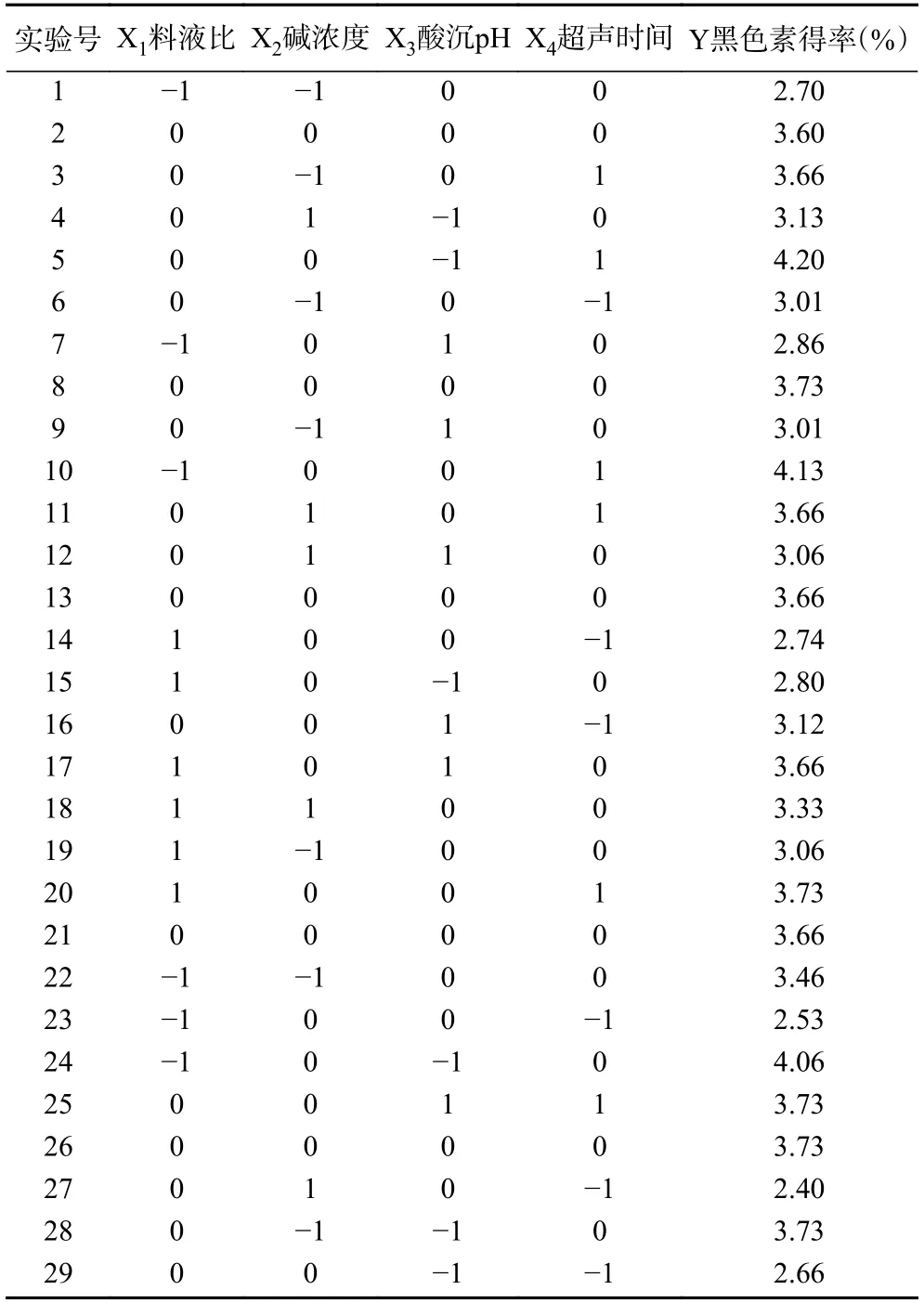
表2 响应面试验设计与结果Table 2 Program and experimental results of RSA

为检测该方程的可靠性,对该方程进行方差分析,结果见表3。
从表3 可知,该方程模型P值小于0.01,表明该二次回归方程模型极显著,同时失拟项不显著,说明方程对实验的拟合较好,可用于黑色素得率的预测。回归方程是一个复杂的多项式方程,说明实验因素对响应值有较复杂的影响。根据P值得出了各因素对山杏核壳黑色素得率的影响顺序(超声时间>碱浓度>酸沉pH>料液比);根据响应面模型结果得出了提取的最佳条件(料液比1:10 g/mL,氢氧化钠浓度1.58 mol/L,酸沉pH 为1,超声时间35 min),此条件下得率为4.78%。考虑到实际操作的可行性,将提取条件调整为:料液比1:10 g/mL,氢氧化钠浓度1.5 mol/L,酸沉pH 为1,超声时间35 min,此条件下重复3 次得出得率为4.78%±0.23%,表示该预测模型是可行的。

表3 回归方程方差分析结果Table 3 Results of variance analysis of regression equation
2.2 山杏核壳黑色素的紫外-可见光谱表征分析
本研究提取的黑色素的紫外-可见光谱图(图2)的光密度对数值与波长的线性曲线斜率在−0.0015~−0.0030 之间(−0.0019),符合黑色素的特征[26]。另外,270~280 nm 处有一较弱肩峰,这是由水解残留蛋白质中的芳族氨基酸残基对光的吸收引起的,此结果与李军等[27]提取的山杏种皮黑色素的紫外-可见光谱一致。
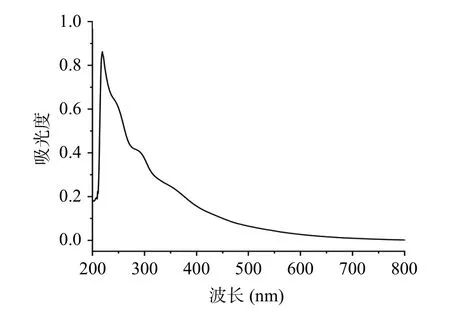
图2 山杏核壳黑色素的紫外-可见光谱图Fig.2 UV-vis absorption spectra of melanin from apricot kernel shell
2.3 山杏核壳黑色素的红外光谱表征分析
由图3 可看出山杏核壳黑色素的红外光谱是一系列宽而强的吸收峰,主要有以下特征:3458 cm−1和3167cm−1处的吸收峰是由于羟基(-OH)、吲哚的氨基(-NH2)或羧基(-COOH)伸缩振动产生的,同时该区域也属于羰基(-C=O-)的伸缩振动[28],说明山杏核壳黑色素结构中含上述基团;2832 cm−1处小而尖的峰属于烷烃结构中的C-H 伸缩振动,可能为-CH2CH3结构[29];1659 cm−1与1400 cm−1处属于芳香环骨架C=C 键的振动吸收[30],说明其结构中有苯环的存在,1659 cm−1与3458 cm−1处的强吸收峰共同指示羧酸根(-COOH)的存在[31];综上所述,山杏核壳黑色素存在-OH、-NH2、-COOH、C-H 和C=C 等官能团。

图3 山杏核壳黑色素的红外光谱图Fig.3 FT-IR spectrum of melanin from apricot kernel shell
2.4 山杏核壳黑色素的扫描电镜分析
由图4 可看出,山杏核壳黑色素呈块状的立方体结构,粒径大小差异较大,为微米级,粒度范围大致在1~5 μm 之间,且以5 μm 左右居多。

图4 山杏核壳黑色素的SEM 图Fig.4 SEM images of melanin from apricot kernel shell
2.5 山杏核壳黑色素铁螯合物的螯合工艺优化
山杏核壳黑色素铁螯合物在250 nm 左右出现新的吸收峰,这可能归属于黑色素中的酚羟基与铁离子螯合后产生的特征吸收峰;在330 nm 处渐出现较宽的吸收峰,说明DHI(5,6-二羟基吲哚)单元也参与了铁离子的螯合[32];且铁离子浓度从2 mmol/L 到3 mmol/L,特征峰260 nm 处的吸光度呈上升趋势,从3 mmol/L 到4 mmol/L,特征峰吸光度呈下降趋势,5 mmol/L 处其在260 nm 处吸光值达到最大,之后6 mmol/L 又下降(图5a),这说明,铁离子浓度为5 mmol/L 时已经为黑色素提供了足够的铁,使得在此反应条件下的螯合效果最好。
随着pH 从3.0 到4.5,其曲线在260 nm 处的吸光值逐渐下降,但在pH5.5 处出现最大值,6.5 处吸光值比5.5 处稍下降,虽然pH3.0 在260 nm 处吸光值较大,但在330 nm 处的吸收峰反而未出现,表明此条件下DHI 与铁离子螯合情况不好,这可能是因为pH 为3 时,溶液中大量水合氢离子会与金属离子竞争反应活性位点,还可能是因为溶液呈强酸性,黑色素中的酚羟基、羧基、胺基等因质子化而带正电荷,与Fe3+之间产生较强的静电斥力,使Fe3+很难靠近黑色素,导致螯合效果较差,随着pH 的增大,螯合率提高,是因为溶液的酸性减弱,吸附剂中与水合氢离子螯合的活性部位逐渐暴露出来有利于Fe3+的螯合,pH 大于5.5 后呈下降趋势,可能是因为超过了铁离子微沉淀上限,金属离子会形成氧化物沉淀;pH 大于7.5 后,溶液中OH-与黑色素竞争Fe3+,使溶液中游离的Fe3+浓度变小,导致螯合率降低,因此,不再继续探究。因此酸度对黑色素螯合Fe3+有较大影响,其最佳pH 为5.5(图5b),本实验结果与陈士国等[33]研究的结果一致,溶液酸碱度对黑色素铁螯合物的螯合效果影响较大。
随着反应时间从6 到8 h,260 nm 处吸光值呈上升趋势,8 到10 h,260 nm 处吸光值呈下降趋势,10 到24 h,260 nm 处吸光值呈上升趋势,8 h 处吸光值最大,因此最佳反应时间为8 h(图5c)。这是因为反应时间太短,黑色素与三氯化铁反应不完全,形成的螯合物还不稳定,导致其螯合效果较差;当反应时间太长,三价铁可能会与溶液中的氢氧化钠结合生成氢氧化铁红色沉淀,导致螯合效果降低,所以选择反应时间为8 h 最好。因此,黑色素铁螯合物的最佳螯合工艺为铁离子浓度5 mmol/L,pH5.5,反应8 h。

图5 不同铁离子浓度(a)、反应pH(b)、反应时间(c)对山杏核壳黑色素铁螯合物的制备影响Fig.5 Effects of different iron ion concentrations (a),reaction pH (b) and reaction time (c) on the chelating of iron melanin chelate in apricot kernel shell
2.6 山杏核壳黑色素铜螯合物的螯合工艺优化
山杏核壳黑色素铜螯合物在260 nm 左右出现新的吸收峰,这可能归属于铜离子与黑色素儿茶酚基螯合形成的特征吸收峰[34];由图6a 可知,铜离子浓度从2 mmol/L 到4 mmol/L,特征吸收峰260 nm 处的吸光值呈上升趋势,4 mmol/L 到5 mmol/L,吸光值整体呈下降趋势,4 mmol/L 吸光值达到最大,这可能是由于Cu2+浓度增加后以较高的比例参与螯合,但铜离子浓度为4 mmol/L 时已经为黑色素提供了足够的铜,使得在此反应条件下的螯合效果最好,配位比太小,不能形成稳定的环状结构,螯合物不稳定;配位比太大,又会造成黑色素的浪费。图中曲线在217 nm 处均出现吸收峰,可能因为其pH 的影响,导致山杏核壳黑色素酸性位点去质子化,解离出更多螯合位点,也有可能是因为Cu2+以不同比例与儿茶酚基螯合的结果。
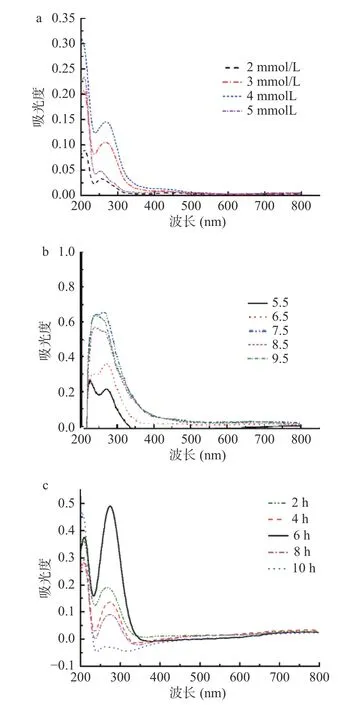
图6 不同铜离子浓度(a)、反应pH(b)、反应时间(c)对山杏核壳黑色素铜螯合物的制备影响Fig.6 Effects of different copper ion concentrations (a),reaction pH (b) and reaction time (c) on the chelating of copper melanin chelate in apricot kernel shell
由图6b 可知,pH 从5.5 到7.5,260 nm 处吸光值呈上升趋势,且217 nm 处吸收峰渐增强,这是因为随着pH 增大,促进黑色素酸性位点去质子化,解离出更多结合位点,因而在217 nm 处吸收峰增强;从7.5 到9.5,260 nm 吸光值整体呈下降趋势,217 nm处吸光值变化不大,这是因为铜离子可能与溶液中的氢氧化钠结合,导致螯合效果降低(图6b)。
由图6c 可知,随着反应时间从2 到6 h,260 nm处吸光值呈上升趋势,6 到10 h,其特征峰吸光值呈下降趋势,6 h 时其吸光值达到最大,这是因为反应时间太短,黑色素与硫酸铜反应不完全,形成的螯合物还不稳定,导致其螯合效果较差,所以选择反应时间为6 h 最好。因此,黑色素铜螯合物的最佳螯合工艺为铜离子浓度4 mmol/L,pH7.5,反应6 h。
2.7 山杏核壳黑色素锌螯合物的螯合工艺优化
由图7a 可知,锌离子浓度从2 到3 mmol/L,其整体吸光值呈上升趋势,3 到5 mmol/L,其整体吸光值呈下降趋势,3 mmol/L 处整体吸光值达到最大(包括特征吸收峰360 nm 和500 nm 处[35]),这可能是因为锌离子浓度为3 mmol/L 时已经为黑色素提供了足够的锌,使得在此反应条件下的螯合效果最好。如图7b 所示,pH 从4.5 到7.5,吸光值整体呈上升趋势,7.5 到8.5,吸光值呈整体呈下降趋势,在pH7.5处时,整体吸光值达最大,pH 大于7.5 后,溶液中OH-与黑色素竞争锌离子,使溶液中游离的锌离子浓度变小,导致螯合率降低。如图7c 所示,反应时间从2 到4 h,整体吸光值呈上升趋势,4 到6 h,整体吸光值呈下降趋势,6 到10 h,整体吸光值(包括特征吸收峰360 nm 和500 nm 处)呈上升趋势。因此,黑色素锌螯合物的最佳螯合工艺为锌离子浓度3 mmol/L,pH7.5,反应4 h。
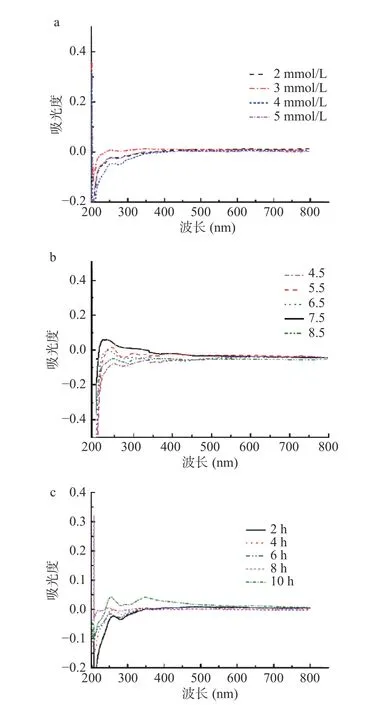
图7 不同锌离子浓度(a)、反应pH(b)、反应时间(c)对山杏核壳黑色素锌螯合物的制备影响Fig.7 Effects of different zinc ion concentrations (a),reaction pH (b) and reaction time (c) on the chelating of zinc melanin chelate in apricot kernel shell
2.8 三种山杏核壳黑色素金属螯合物的螯合程度比较
相同条件下,黑色素铁螯合物的螯合效果最好(63.86%),而黑色素铜螯合物与黑色素锌螯合物的螯合率分别为5.59%与3.05%,这可能是因为在该设置环境下铁离子与黑色素的螯合更牢固,Hong 等[36]总结得出黑色素与金属离子间亲和力的大小顺序:碱金属<碱土金属<Zn(Ⅱ)<Cu(Ⅱ)、Fe(Ⅲ)和Mn(Ⅱ)。根据姚增玉[37]研究的山杏种皮黑色素金属螯合物的性质,其在形成过程,金属离子易促进黑色素酸性位点去质子化,且铜离子比锌离子的促进作用强,与黑色素螯合也更牢固,本实验结果也证明在同一条件下铜离子比锌离子的螯合率更高。
2.9 山杏核壳黑色素金属螯合物的紫外-可见光谱分析
如图8 所示,248 nm 处黑色素铁螯合物的吸收峰主要是因为酚羟基参与了铁离子的螯合,340 nm处归因于DHI(5,6-二羟基吲哚)单元参与了铁离子的螯合,其结果与陈士国等[33]研究的鱿鱼墨黑色素铁螯合物的紫外图一致。270 nm 处黑色素铜螯合物的紫外吸收峰归于黑色素的儿茶酚基与Cu2+的螯合。黑色素锌螯合物的吸收曲线上有多个吸收峰,但除了在210~220、240~250 和340~350 nm 处的3 个吸收峰外,其他各吸收峰缺乏规律性。240 nm 处是由Zn2+与羧基螯合引起的,350 nm 处的吸收峰是由Zn2+与醌胺基螯合引起,其结果与姚增玉[37]研究的山杏种皮黑色素锌螯合物的紫外图一致。

图8 山杏核壳黑色素金属螯合物的紫外-可见光谱图Fig.8 UV-visible spectrum of melanin metal chelates in apricot kernel shell
2.10 山杏核壳黑色素金属螯合物的红外光谱分析
可采用红外光谱分析通过黑色素金属螯合物红外透过率的变化来确定黑色素对重金属的螯合作用。由山杏种皮黑色素红外光谱结果可知,山杏核壳黑色素中存在酚羟基、羧基和氨基,这些基团均是与金属离子螯合的潜在部位,金属离子与其螯合实际上是与H+在竞争结合位点。由图9 可知,3 种黑色素金属螯合物的红外光谱非常相似,黑色素与金属离子Cu2+、Fe3+和Zn2+螯合后,其最基本的变化是1600~1700 cm−1、1200~1400 cm−1和1515 cm−1处吸收峰的变化。1515 cm−1处的变化可能是因为Cu2+、Fe3+和Zn2+与氨基的螯合,其主要限制了NH 基团弯曲和CN 基团的伸缩振动。1210 cm−1处的变化可能是因为Cu2+、Fe3+和Zn2+与羰基或者邻位醌羟基的螯合。1700 cm−1为COO-的对称带,表明羧基离子化并参与了金属离子的螯合[38]。

图9 山杏核壳黑色素金属螯合物的红外光谱图Fig.9 FT-IR spectra of melanin metal chelates in apricot kernel shell
2.11 山杏核壳黑色素金属螯合物的扫描电镜和能谱分析
图10(a、d、g)为三种山杏核壳黑色素金属螯合物的扫描电子显微镜图,从图可看出三者微观形态相似但与山杏核壳黑色素存在显著差异。山杏核壳黑色素呈立方体块状结构,结构较明显,表面无附着物,且形貌较规则;而黑色素金属螯合物较聚集,呈片状,形状大多不规则,表面较粗糙,有些许颗粒状凸起,上述结果可能是由于黑色素与金属离子反应后可能改变了本身的一些基团,内部结构出现变动,从而导致其表面形貌发生了改变[39−40]。

图10 山杏核壳黑色素金属螯合物的SEM(5000×)及EDS 图Fig.10 SEM (5000×) and EDS of apricot kernel shell melanin metal chelates
图10(b、e、h)EDS 元素分析结果显示黑色素金属螯合物中主要存在C、O 及相应的金属元素。黑色素铁螯合物中铁的含量大约为21.39%,Si 元素的存在可能是因为SEM 使用玻璃基底,所以在样品比较薄的区域扫谱,会有基底的Si 信号出来(图10b);黑色素铜螯合物中Cu 的含量大约为32.52%(图10e);黑色素锌螯合物中Zn 的含量大约为10.85%(图10h);结果表明,黑色素金属螯合物的合成条件是可行的。
3 结论
本文确定了山杏核壳黑色素的最佳提取工艺为料液比1:10(g/mL),氢氧化钠浓度1.5 mol/L,酸沉pH 为1,超声时间35 min。之后分别得出了黑色素铁螯合物的最佳制备工艺为铁离子浓度5 mmol/L,pH5.5,反应8 h;黑色素铜螯合物的最佳制备工艺为铜离子浓度4 mmol/L,pH7.5,反应6 h;黑色素锌螯合物的最佳制备工艺为锌离子浓度3 mmol/L,pH7.5,反应4 h。相同条件下,黑色素铁螯合物的螯合率最大,达63.86%。山杏核壳黑色素金属螯合物的紫外图显示铁离子主要和黑色素儿茶酚基螯合,铜离子主要和黑色素酚羟基螯合。山杏核壳黑色素金属螯合物红外光谱图表明金属离子(Fe3+、Cu2+和Zn2+)主要与黑色素的羰基、邻位醌基和氨基螯合。扫描电镜及能谱扫描结果表明三种黑色素金属螯合物的成功制备。
黑色素特有的安全性、负电性、高比表面积等特性使其与金属离子具有良好的螯合能力,制得的螯合物不仅具有黑色素的活性,还兼具金属离子的生物活性,在性能和应用方面更有协同增效作用,显著提升了黑色素在食品、生物和医学等方面的应用。本文为深入探究和开发黑色素及其金属螯合物奠定了理论基础,在改善生物机能及金属元素补充剂[38]等方面有广阔的应用前景。

