嗜热杜邦菌α-淀粉酶的定向进化及高效表达
靳 燕,李延啸,马俊文,王玉川,闫巧娟,江正强,3,
(1.中国农业大学工学院,中国轻工业食品生物工程重点实验室,北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083;3.南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,江苏南京 210023)
淀粉是地球中储量最丰富的可再生资源之一[1],是一种天然的葡萄糖聚合物,主要包括两种类型:直链淀粉和支链淀粉。α-淀粉酶(EC.3.2.1.1)可以随机水解淀粉分子内部的α-1,4-糖苷键,生成短链糊精、麦芽寡糖和少量葡萄糖,因其生产成本低、pH 适用范围广、热稳定性能好[2]等优点而在淀粉糖[3]、酿造[4]和面包烘焙等食品工业中广泛应用。
分子改造技术能提高已有α-淀粉酶的热稳定性和比酶活等酶学特性,是提升α-淀粉酶工业应用价值的有效方法之一[5]。目前,许多研究报道了α-淀粉酶的分子改造,常用的方法包括定向进化、定点突变和理性设计等。其中,定向进化无需了解蛋白酶结构功能关系,可快速建立突变体文库,通过高通量筛选,能有效改良酶的功能[5−6]。如HUANG 等[7]利用定向进化技术对地衣芽孢杆菌来源的α-淀粉酶(BSA)进行分子改造,获得了一个耐酸性提高的突变体G81R,在pH4.5 下孵育40 min 后仍然保留10%的初始酶活,而相同条件下的野生型淀粉酶已经基本没有活性。WU 等[8]利用易错PCR 对解淀粉芽孢杆菌(B.amyloliquefaciens)来源的液化α-淀粉酶(BAA)进行分子改造,有效降低了突变体对Ca2+的依赖性,且突变体的催化效率(kcat/Km)较野生型提高了2.4 倍。刘雪莲等[9]利用DNA 重排技术构建地衣芽孢杆菌来源的α-淀粉酶突变文库,筛选得到最适温度提高10 ℃、最适pH 降低0.5~1 个单位且对Ca2+依赖性降低的突变体V-2。此外,基于基因工程技术进行异源表达是实现α-淀粉酶高产量的重要途径之一。毕赤酵母表达系统因具有高效表达、胞外分泌等优势而受到广大研究者和生产者的关注。如赵宁等[10]将嗜热真菌樟绒枝霉(Malbranchea cinnamomea)来源的α-淀粉酶在毕赤酵母中高效表达,高密度发酵至168 h 时,胞外酶活力达到13440.6 U/mL。WANG 等[11]将米黑根毛霉来源的α-淀粉酶在毕赤酵母中高效表达,发酵168 h 后,其酶活达29794.2 U/mL。WANG等[12]将嗜热杜邦菌来源的α-淀粉酶在毕赤酵母中高效表达,发酵168 h 后,其酶活达38314 U/mL。迄今,已有较多α-淀粉酶在毕赤酵母系统中成功表达,但达到工业化生产水平的不多。因此,基于定向进化技术获得一个稳定性和比酶活力同时提高的α-淀粉酶突变体具有重要意义。
前期研究了嗜热杜邦菌(Thermomyces dupontii)来源的GH13 家族α-淀粉酶(Td-amy)的酶学性质和异源表达[11]。该酶具有优良的水解特性,在焙烤食品等领域具有良好的应用潜力,但是该酶的热稳定性和比酶活较低。本研究利用易错PCR 及定向进化技术对Td-amy 进行分子改造,构建随机突变文库,经高通量筛选以期筛选得到耐热性和比酶活同时提高的突变体,并通过定点突变分析各突变氨基酸对其酶学性质的影响,最后将改造后的α-淀粉酶在毕赤酵母中高效表达,为淀粉酶的大规模工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
嗜热杜邦菌 本实验室筛选保藏;载有嗜热杜邦菌来源α-淀粉酶基因的重组质粒pPIC9k-Tdamy 和重组质粒pET28a-Td-amy 本实验室构建并保存;克隆表达宿主大肠杆菌工程菌株DH5α 和Rosetta(DE3) 北京博迈德基因技术有限公司;表达载体pET-28a(+) Novagen;毕赤酵母GS115北京全式金生物技术有限公司;载体pPIC9K 美国Invitrogen;Fast Pfu DNA 聚合酶(500 U/mL) 北京全式金生物技术有限公司;限制性内切酶BamHI(20000 U/mL)、NdeI(20000 U/mL)、AvrII(20000 U/mL)、SnaBI(20000 U/mL)、SalI(10000 U/mL)和T4 DNA 连接酶(1000 U/mL)美国NEB 公司;琼脂糖凝胶纯化回收试剂盒 北京博迈德基因技术有限公司;高纯质粒小量提取试剂盒 北京天根生物科技有限公司;酵母膏和胰蛋白胨Oxoid 公司;DNS 北京索莱宝科技有限公司;溶菌酶(20000 U/mg)、可溶性淀粉、NaCl、柠檬酸、柠檬酸三钠、磷酸二氢钠、磷酸氢二钠、2-吗啉乙磺酸(MES)、2-环己基氨基乙磺酸(CHES)、3-环己基-1-丙磺酸(CAPS)和咪唑 美国sigma 公司;Geneticin(G418)、异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素和氨苄青霉素 美国 Inalco;其它试剂若无特殊说明均是国产分析纯。
MD 平板培养基(g/L):10×葡萄糖(20%,w/v)100 mL,10×YNB(13.4%,w/v)100 mL,500×生物素(0.02 g/L)2 mL,琼脂粉15 g;LB 液体培养基(g/L):酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g;LB 平板培养基(g/L):LB 液体培养基,琼脂粉15 g;YPD 液体培养基(g/L):酵母提取物10 g,胰蛋白胨20 g,葡萄糖20 g(葡萄糖与其他成分分开灭菌);YPDG418 平板培养基(g/L):YPD 液体培养基,琼脂粉15 g,1~4 mg/mL G418。
Gene Pulser MXcell 电转仪、PCR MyCycler 自动扩增仪和 Power Pac BasicTM 型电泳仪 美国BIO-RAD 公司;TGL 12GB 高速台式离心机 上海安亭科学仪器厂;TU 1800PC 紫外分光光度计 北京普析通用仪器设备有限责任公司;金属亲和层析柱料Ni-NTA agarose 德国 Qiagen 公司;国强5 L 高密度发酵罐 上海国强生化工程设备有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HZQ-X100 恒温摇床 江苏太仓实验设备厂;酶标仪 赛默飞世尔科技公司;XMTD-6000恒温水浴锅 北京长风仪器公司。
1.2 实验方法
1.2.1α-淀粉酶(Td-amy)随机突变文库的建立及高通量筛选
1.2.1.1α-淀粉酶(Td-amy)随机突变文库的建立易错PCR 反应体系如下:0.1 mmol/L Mn2+/0.2 mmol/L Mn2+1 μL,5 mmol/L Mg2+1 μL,0.2 mmol/L dGTP和dATP 各1 μL,1.0 mmol/L dCTP 和dTTP 各1 μL,0.2 μmol/L Td-amy-F 和Td-amy-R 各1 μL(见表1),1.25 U rTaq DNA 聚合酶1 μL,5 ng pPIC9K-Tdamy 重组质粒1 μL,5x pfu buffer 10 μL,剩余用超纯水补足至50 μL。易错PCR 反应条件:95 ℃,3 min;95 ℃,30 s;55 ℃,30 s;72 ℃,90 s;反应循环34 次;72 ℃,10 min。

表1 本文所用引物Table 1 Primers used in this study
易错PCR 产物经琼脂糖凝胶电泳验证正确后进行胶回收,胶回收产物与pET28a 质粒用相同的限制性酶BamHI 和HindIII 在37 ℃下双酶切处理,并在T4DNA 连接酶的作用下16 ℃过夜连接,连接产物转大肠杆菌DH5α感受态细胞,将所有单菌落从平板刮取至新鲜LB 培养基中,摇菌提质粒转化至大肠杆菌Rosetta(DE3)中,收集所有转化子,即为随机突变文库。随机对10 个转化子进行测序分析,计算突变体文库的文库容量和突变量。
1.2.1.2 突变文库的初筛 将96 孔板中加入100 μL的含卡那霉素(50 μg/mL)的LB 培养基,之后用牙签挑取突变体接种至96 孔板,同时接种野生型作为对照,37 ℃培养4 h 作为种子液。将96 孔板中的菌液取20 μL 转接至新的装有180 μL 新鲜LB 培养基(含卡那霉素50 μg/mL)的96 孔板中,37 ℃培养3 h后加入IPTG 10 μL 使其终浓度为0.5 mmol/L,16 ℃、180 r/min 诱导16 h。4 ℃、3000 r/min 离心20 min获得菌体,将菌体于−80 ℃冷冻2 h 后于室温下复融,加入100 μL 溶菌酶(10 mg/mL),pH8.0、37 ℃处理30 min,再于4 ℃、3000 r/min 离心20 min,获得上清液即为粗酶液。
在96 孔深孔板中加入90 μL 1%(w/v)可溶性淀粉(50 mmol/L MES 缓冲液,pH6.5),然后加入10 μL 的粗酶液,置于55 ℃反应10 min,加入100 μL的DNS 终止反应。将上述反应液于沸水浴煮10 min,冷却至室温后,3000 r/min 离心10 min 后取上清用酶标仪测酶活。选择酶活高于对照的菌株用于下一步的复筛。
1.2.1.3 突变文库的复筛 选取初筛为阳性的克隆接种于LB 液体培养基中,37 ℃下培养,取1 mL 菌液在600 nm 处测吸光度值。当其OD600达0.6~0.8,加入10 μL IPTG 使其终浓度为0.5 mmol/L 进行重组酶的诱导表达。分别测定不同菌株粗酶液的酶学性质。以最适温度和酶活升高的突变体作为正向突变体。
1.2.2 mTd-amy 的纯化和酶学性质分析
1.2.2.1 纯化 粗酶液使用Ni-IDA 柱(1 cm×5 cm)纯化。先用10 个柱体积的缓冲液A(20 mmol/L 磷酸盐缓冲液PB,500 mmol/L NaCl,20 mmol/L 咪唑,pH8.0)以1.0 mL/min 的流速平衡柱子,粗酶液以0.5 mL/min 流速上样;用缓冲液A 以1.0 mL/min 流速洗脱至OD280<0.05,除去杂蛋白,然后分别用洗脱缓冲液B(20 mmol/L PB,500 mmol/L NaCl,50 mmol/L 咪唑,pH8.0)和缓冲液C(20 mmol/L PB,500 mmol/L NaCl,100 mmol/L 咪 唑,pH8.0)以1.0 mL/min 洗脱并收集目的蛋白。洗脱后经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检验其纯度。
1.2.2.2 酶活力和蛋白浓度的测定α-淀粉酶酶活力的测定采用DNS 法(3,5-二硝基水杨酸法)[13]:将酶液用MES 缓冲液(50 mmol/L,pH6.5)进行适当稀释,吸取100 μL 适当稀释的酶液至900 μL 可溶性淀粉溶液(1.0%,w/v,50 mmol/L MES 缓冲液,pH6.5)中,振荡均匀后,在55 ℃下反应10 min,加入1 mL DNS 溶液终止反应,于沸水浴中加热10 min,测定OD540条件下的吸光度值,并使用葡萄糖作为标准。α-淀粉酶酶活力定义为:在以上反应条件下,每分钟产生1 μmol 葡萄糖所需要的酶量定义为1 U。蛋白质浓度测定参考LOWRY 等[14]的方法。Folin 甲A 液和Folin 甲B 液按50:1 比例混合,每个样品加1 mL 上述混合液和100 μL 适当稀释的酶液,轻振荡后室温静置10 min,加入100 μL Folin乙,迅速振荡后于37 ℃水浴静置30 min 后于OD650处测定吸光度值。以牛血清蛋白(BSA)为标准品制作标准曲线。
1.2.2.3 野生型Td-amy 及突变体mTd-amy 酶学性质的测定 a.最适pH 及pH 稳定性:在50 ℃(Td-amy)、55 ℃(mTd-amy)50 mmol/L 不同pH 的缓冲溶液中测定纯酶的酶活以确定其最适pH。所选择的缓冲体系分别为:柠檬酸盐缓冲液(pH3.0~5.0)、MES 缓冲液(pH5.5~6.5)、磷酸盐缓冲液(pH7.0~8.0)、CHES缓冲液(pH8.5~10.0)、CAPS 缓冲液(pH10.5~11.0)。将酶液用上述不同体系不同 pH 的缓冲液稀释至OD540为0.2~0.8,于45 ℃水浴中保温30 min,然后迅速置于冰水浴冷却30 min,测定残余酶活力。
b.最适温度及热稳定性:最适温度的测定是将纯酶用50 mmol/L、pH6.5 的MES 缓冲溶液适当稀释,分别在40~80 ℃下测定野生型Td-amy 和突变体mTd-amy 酶活力,确定其最适温度。将纯酶用50 mmol/L、pH6.5 的MES 缓冲溶液适当稀释,在40~80 ℃下孵育30 min,然后于冰水浴中冷却30 min后,加热至55 ℃(Td-amy)和60 ℃(mTd-amy)测定残余酶活力。
1.2.2.4 底物特异性的测定 分别以1.0%(w/v)可溶性淀粉、红薯淀粉、小麦淀粉、玉米淀粉和马铃薯淀粉为底物,测定野生型Td-amy 和突变体mTdamy 的底物特异性。分别在55 ℃(Td-amy)和60 ℃(mTd-amy)、pH6.5(50 mmol/L MES 缓冲液)的条件下反应10 min。采用DNS 法[13]测定酶活,以可溶性淀粉为底物测得的酶活设定为100%,每分钟反应生成1 μmol 葡萄糖所需要的酶量定义为1 个酶活力单位。
1.2.3α-淀粉酶(Td-amy)的定点突变及结构模拟分析 将筛选到的阳性突变体α-淀粉酶基因(mTdamy)测序后,与野生型基因(Td-amy)序列进行比对分析,确定阳性克隆的突变位点。根据突变位点信息,以野生型基因为出发点向阳性突变体的方向逐一进行定点突变。
定点突变以重组质粒pET28a-Td-amy 为模板,用定点突变引物(表1),PCR 扩增程序为:95 ℃预变性3 min;95 ℃变性20 s,55 ℃退火20 s;72 ℃延伸3 min,25 个循环;72 ℃总延伸10 min。PCR 扩增产物经DpnI 在37 ℃条件下消化2 h,直接转化大肠杆菌DH 5α感受态细胞。将转化后的重组菌涂布于LB 固体培养基(含卡那霉素50 μg/mL),37 ℃培养12 h,对单菌落进行菌落PCR,并测序得到每个突变位点的20 个突变体。收集质粒,转化大肠杆菌Rosetta(DE3)。
以米曲霉(A.oryzae)来源的Takaα-淀粉酶(PDB:6XSJ,序列同源性为65.54%)结构为模板,经SWISS-MODEL 进行同源结构模拟,得到α-淀粉酶(Td-amy)结构,根据预测的结构信息对突变位点进行分析。利用PyMOL 软件分析氨基酸残基间氢键相互作用和突变位点对蛋白质二级结构的影响。
1.2.4 mTd-amy 在毕赤酵母中表达及高密度发酵
1.2.4.1 mTd-amy 在毕赤酵母中表达 用限制性内切酶 SnaBI 和AvrII 对淀粉酶突变体基因(mTdamy)和载体 pPIC9K 双酶切,凝胶回收后连接获得重组质粒pPIC9K-mTd-amy。重组质粒pPIC9KmTd-amy 用限制性内切酶SalⅠ线性化后电转化至巴斯德毕赤酵母GS115 中。取 100~200 μL 电转化产物涂布于MD 平板培养基,30 ℃下培养2~3 d 后用无菌蒸馏水将MD 平板上生长的毕赤酵母转化子洗脱和重悬。分别涂布于含有不同质量浓度的YPD-G418 平板培养基上30 ℃培养2~5 d。挑取不同质量浓度G418 平板培养基上的单菌落摇瓶发酵3 d,吸取上清液检测淀粉酶酶活力。
1.2.4.2 突变体mTd-amy 的高密度发酵 选取摇瓶发酵淀粉酶酶活力最高的重组菌株进行高密度发酵。发酵方法及培养基的配制参照毕赤酵母发酵手册(Version B,053002,Invitrogen)操作。
1.3 数据处理
数据统计和图片处理采用 Origin 8.0 进行,数据均为3 次平行。
2 结果与讨论
2.1 α-淀粉酶突变文库的构建和筛选
采用Mg2+和Mn2+进行易错PCR 扩增,与pET28a载体酶切连接构建重组质粒,并转化至大肠杆菌DH5α,得到随机突变文库。随机对10 个转化子进行测序分析,结果表明,当Mg2+浓度为5 mmol/L 和Mn2+浓度为0.1 mmol/L 时,随机突变文库中碱基突变率约为0.21%,氨基酸突变率约为0.63%,为合适突变率。经过两轮筛选,最终得到1 个比酶活明显升高的正向突变体,命名为mTd-amy。该突变体的比酶活为466.3 U/mg,相对于野生型(227.90 U/mg)提高至2.0 倍,测序结果表明,α-淀粉酶突变基因(mTd-amy)中有四个碱基发生改变,分别为C11T、C365T、A581G 和C1403A,导致该突变体中四个氨基酸发生改变,即Ala4Val、Ala122Val、Lys194Arg和Ala468Asp。将野生型α-淀粉酶基因(Td-amy)和突变体基因(mTd-amy)的氨基酸序列与其它GH13 家族α-淀粉酶进行序列比对,发现Ala4Val、Ala122Val、Lys194Arg 为部分保守氨基酸,而Ala468Asp 为非保守氨基酸。
2.2 野生型Td-amy 和突变体mTd-amy 的酶学性质
2.2.1 最适条件的测定 将突变体mTd-amy 纯化后,SDS-PAGE 结果分析表明目的蛋白条带均一,分子量为61.2 kDa(图1),与其预测分子量和野生型Td-amy 分子量一致。对野生型Td-amy 和突变体mTd-amy 酶学性质测定结果如图2。mTd-amy 的最适pH 为6.5(图2A),在pH4.5~10.0 范围内保持稳定(图2B),与野生型Td-amy 研究结果一致[12]。mTd-amy 的最适温度为60 ℃(图2C),较野生型(大肠杆菌中表达)提高了5 ℃,明显高于许多不同来源的重组α-淀粉酶,如来源于莱斯氏菌属(45 ℃)[15]、海洋专性放线菌(50 ℃)[16]、柄篮状菌(50 ℃)[17]和嗜碱溶淀粉性碱单胞菌(50 ℃)等[18];mTd-amy 在55 ℃以下保持稳定,在55 ℃下保温30 min 后仍能够残留90%左右的酶活力(图2D),而Td-amy(大肠杆菌中表达)仅在50 ℃以下保持稳定。另外,mTdamy 在65 和70 ℃保温30 min 后,残余酶活分别为27.3%和14.2%;而经过相同处理后,Td-amy(在大肠杆菌中表达)的残余酶活分别仅为16.3%和8.1%。这表明进化后突变体mTd-amy 的最适温度和热稳定性均有所提高。
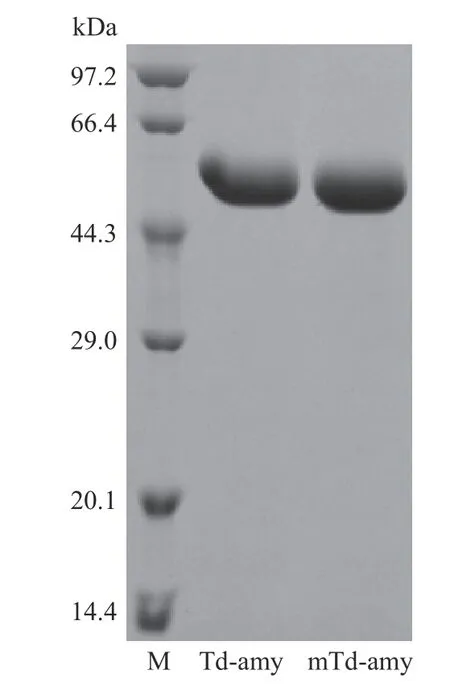
图1 野生型(Td-amy)和突变体(mTd-amy)纯化蛋白电泳图Fig.1 SDS-PAGE analysis of the proteins during purification process of Td-amy and mTd-amy

图2 野生型Td-amy 和突变体mTd-amy 的最适pH(A)、pH 稳定性(B)、最适温度(C)和温度稳定性(D)Fig.2 Optimal pH (A),pH stabilities (B),optimal temperatures(C) and thermostabilities (D) of Td-amy and mTd-amy
2.2.2 底物特异性 野生型Td-amy 和突变体mTdamy 对不同底物的特异性如表2 所示。结果表明,野生型Td-amy 和突变体mTd-amy 对多种底物均有水解活性,两者均对玉米淀粉的水解能力最强,与丁梦瑶等[19]对约氏黄杆菌HSL13 中新型α-淀粉酶的底物特异性研究一致,其次是小麦淀粉、红薯淀粉和马铃薯淀粉。突变体mTd-amy 对不同底物的比酶活均明显提高,其中,底物为马铃薯淀粉和可溶性淀粉时,其比酶活都比野生型Td-amy 提高了2 倍以上。

表2 野生型Td-amy 和突变体mTd-amy 的底物特异性Table 2 Substrate specificity of Td-amy and mTd-amy
2.3 定点突变及结构模拟分析
定点突变结果表明(表3),与野生型Td-amy 相比,单突变体Ala122 Val 的比酶活较野生型提高至194.6%,但低于突变体mTd-amy(提高至204.6%),其余三个单突变体Ala4Val、Lys194Arg 和Ala468Asp与野生型Td-amy 相比,比酶活明显降低。突变体Ala122Val 和Ala468Asp 的最适温度较野生型提高了5 ℃。所有突变体最适pH 未发生变化。推测第122 位丙氨酸(Ala)突变和第468 位丙氨酸(Ala)突变是影响mTd-amy 酶学性质的关键。

表3 突变体mTd-amy 的定点突变各个突变体的最适温度、最适pH 及相对酶活Table 3 The optimal temperature,optimal pH and relative enzyme activity of mutants for site-directed mutation of mTd-amy
经SWISS-MODEL 同源结构模拟,得到α-淀粉酶(Td-amy)的结构模型(图3),与其他GH13 家族α-淀粉酶相似,Td-amy 呈现典型的(β/α)8-TIM 桶结构,C 端区域还包含有一个小的β-片层结构,由8 个β-折叠和1 个小的α-螺旋结构组成。其中,Asp179、Glu232 和Asp299 为关键催化氨基酸,位于TIM 桶入口处。根据三维结构可知,该酶第4 位的丙氨酸、第194 赖氨酸和第468 位的丙氨酸均位于酶分子的表面,而第122 位的丙氨酸位于酶分子内部。

图3 Td-amy 和 mTd-amy 的结构、改变位点、作用力和表面电荷分布示意图Fig.3 Schematic diagram of structure,mutant sites,molecular force changes and surface charge distribution of Td-amy and mTd-amy
通常,蛋白质表面电荷的变化会影响蛋白质的折叠以及酶分子的催化特性[20−21]。第4 位电中性的丙氨酸突变为缬氨酸后,具有较大β侧链的氨基酸缬氨酸不利于α螺旋的稳定[22],这可能是造成其比酶活降低的原因。第194 位赖氨酸突变为精氨酸后,精氨酸有更长的侧链,增加了空间位阻,影响α螺旋的稳定,导致突变体酶活明显降低[23]。第468位电中性的丙氨酸突变为负电性的天冬氨酸,导致该区域表面电荷由电中性变为弱负电性,推测可能是表面电荷的变化使其比酶活降低。另外,突变后第468 位的天冬氨酸增加了与第469 位精氨酸的相互作用力,有利于该Loop 区的稳定,可能是导致其最适温度提高的原因。虽然122 位丙氨酸突变为缬氨酸没有导致酶分子相互作用和表面电荷的改变,但A122 与三个催化氨基酸均位于催化凹槽入口处的Loop 区域。由于Loop 区是酶结构中最灵活的部分,酶的进化经常涉及它们在环区的残基变化[24]。Loop 区域氨基酸的变化可能对底物的特异性结合产生了影响。另外,丙氨酸突变为缬氨酸后,稳定了底物结合区的空间结构,有利于底物的结合,既提高了酶活性,也提高了热稳定性[25]。
虽然单突变体Ala4Val、Lys194Arg 和Ala468-Asp 比酶活都相对于野生型Td-amy 有所降低,但四突变体mTd-amy 的比酶活较野生型Td-amy 提高204.6%,说明单突变体的酶学性质经组合突变后并不一定产生叠加效应。这一结果与陈春等[26]对来源于Arthrobacter ramosus的MTHase 以及史然等[27]对地杆菌来源的α-L-岩藻糖苷酶进行定向进化的研究结果类似。
2.4 mTd-amy 的高密度发酵
突变体mTd-amy 成功在毕赤酵母中高效表达,经168 h 高密度发酵,发酵上清液的α-淀粉酶酶活力和蛋白含量分别达64696 U/mL 和33.6 mg/mL,菌体湿重439 mg/mL(图4A)。发酵过程中发酵上清液的蛋白电泳如图4B 所示,诱导开始,发酵上清液出现目的条带(61.2 kDa);随着诱导培养时间延长,目的条带逐渐变粗,发酵上清液中mTd-amy 的蛋白含量逐渐增加。
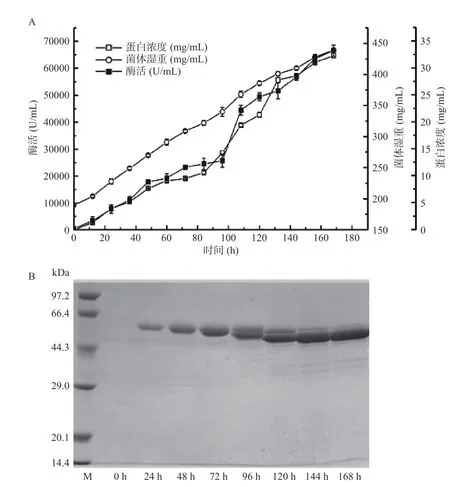
图4 毕赤酵母高密度发酵产α-淀粉酶(mTd-amy)历程图(A)和SDS-PAGE 分析(B)Fig.4 Time-course of mTd-amy expression in P.pastoris by high-cell density fermentation (A) and SDS-PAGE analysis (B)
突变体mTd-amy 的产酶水平明显高于许多不同来源α-淀粉酶在毕赤酵母中异源表达的产酶水平,如来源于米曲霉(72 U/mL)[28]、微小根毛霉(8285 U/mL)[29]、地衣芽孢杆菌(11000 U/mL)[30]、米黑根毛霉(29794.2 U/mL)[11]和微小胞根霉(32100 U/mL)[31]。此外,mTd-amy 的蛋白含量也明显高于许多不同来源重组α-淀粉酶在毕赤酵母中表达的蛋白含量,如米曲霉(0.4 mg/mL)[32]、微小胞根霉(1.5 mg/mL)[31]和地衣芽孢杆菌(12.2 mg/mL)[30]。可见,突变体mTd-amy 的高效表达为该酶的工业化生产奠定了基础。
3 结论与讨论
本研究基于定向进化及高通量筛选方法对嗜热杜邦菌来源α-淀粉酶(Td-amy)进行分子改造研究,成功筛选到正向突变体mTd-amy,其比酶活较野生型Td-amy 提高至2.0 倍,最适温度较野生型Tdamy 提高5 ℃,热稳定性也有明显提升,进一步将该酶在毕赤酵母中高效表达,酶活水平达64696 U/mL,较野生型Td-amy 提高1.68 倍[12]。ZHU 等[33]基于易错PCR 技术对来源于解淀粉芽孢杆菌的α-淀粉酶进行随机突变得到突变体G300H,其比酶活仅提高了9.6%。马银凤等[34]基于酶分子进化原理,得到催化特性明显提高的突变体E2M6,其最适温度提高5 ℃,但其比酶活没有明显改变。本文利用定向进化技术得到了最适温度和比酶活力同时改善的正向突变体mTd-amy,为淀粉酶的分子改造提供了理论依据。同时,实现了该酶的高效表达,为淀粉酶的大规模生产提供了实践基础。今后,仍需对淀粉酶进行更深入的分子改造,以提高淀粉酶在不同应用中的适应性。

