可溶性程序性死亡受体-1和干扰素调节因子4在类风湿关节炎患者血清中的表达与疾病活动性、免疫炎症的关系
黄艳艳, 林书典, 詹 锋, 肖 璐, 詹宇威, 莫碧瑶, 韩叶光
(海南省人民医院/海南医学院附属海南医院, 1. 风湿免疫科, 2. 检验科, 海南 海口, 570311)
类风湿关节炎(RA)是一种慢性自身免疫性疾病,主要侵犯机体的手足关节。RA以T细胞浸润滑膜、持续的炎性反应、进行性软骨退化及骨侵蚀为主要病理改变,可导致患者关节畸形和功能障碍,甚至增大心血管事件风险,严重影响生活质量[1-2]。RA病因复杂,至今发病机制仍不明确,且临床上仅能对症治疗,大部分患者无法彻底治愈[3]。因此,进一步阐明RA发病机制,寻找新的有效治疗靶点,仍是临床研究者迫切需要解决的问题。可溶性程序性死亡受体-1(sPD-1)是程序性死亡受体-1(PD-1)的可溶形式,可阻断PD-1/程序性死亡配体-1(PD-L1)负性信号,促进T细胞的活化增殖,强化免疫应答,刺激炎症因子分泌,在自身免疫性疾病中发挥重要作用[4-5]。干扰素调节因子4(IRF4)是诱导、调节干扰素的转录因子,在T细胞分化成熟调节中发挥不可或缺的作用,参与多种自身免疫性疾病的发病环节[6-7]。sPD-1、IRF4均参与了RA的发生,但其与RA疾病活动性、免疫炎症的关系尚不明确[8-9]。本研究检测不同受试者血清中sPD-1、IRF4表达水平,初步探讨sPD-1、IRF4与RA患者疾病活动性及体内炎症反应的关系。
1 资料与方法
1.1 一般资料
选取2020年10月—2021年9月接受治疗的RA患者100例(RA组)为研究对象,其中缓解期患者(RA缓解组)50例,活动期患者(RA活动组)50例。纳入标准: RA诊断依据《2018年中国类风湿关节炎诊疗指南》[10], 依据28个关节疾病活动度(DAS28)评分[11]对患者RA疾病活动性进行分组,缓解期为DAS28评分<2.8分,活动期为DAS28评分≥2.8分。排除标准: ① 感染、外伤等因素导致的关节肿痛者; ② 合并恶性肿瘤、糖尿病、血液系统疾病、重要脏器功能不全、其他自身免疫性疾病及风湿性疾病者; ③ 依从性差者; ④ 年龄<18岁者。选取同期接受治疗的骨关节炎(OA)患者50例为OA组,排除有过敏史、自身免疫性疾病史者,选择同期进行体检的健康者50例为对照组。收集所有入选者性别、年龄、体质量指数(BMI)等一般资料。所有入选者对本研究知情同意并签署知情同意书,本研究得到医院伦理委员会批准(批号202008-22)。
1.2 试剂与仪器
人sPD-1、白细胞介素-17(IL-17)酶联免疫吸附测定(ELISA)试剂盒(货号CD-102163、CD-100414)购自武汉纯度生物科技有限公司; 人IRF4 ELISA试剂盒(货号EH9468)购于武汉菲恩生物科技有限公司; 人白细胞介素-4(IL-4)、干扰素γ(IFN-γ)ELISA试剂盒(货号SEKH-0011、SEKH-0046)购于北京索莱宝科技有限公司。MODEL550酶标仪为美国Bio-Rad公司产品。
1.3 ELISA法检测受试者血清sPD-1、IRF4、IL-4、IL-17、IFN-γ表达水平
RA患者、OA患者入院第2天,健康者体检当天均抽取清晨空腹静脉血5 mL, 3 000转/min、4 ℃离心处理10 min, 结束后取上清液,分装后置于-80 ℃冰箱保存待测。血清样本于冰上融化,采用人sPD-1、IRF4、IL-4、IL-17、IFN-γ ELISA试剂盒进行检测,在酶标仪上测得光密度(OD)值,绘制标准曲线,计算血清sPD-1、IRF4、IL-4、IL-17、IFN-γ表达水平。
1.4 统计学分析

2 结 果
2.1 对照组、OA组和RA组受试者一般资料比较
对照组、OA组和RA组受试者性别、年龄、BMI比较,差异无统计学意义(P>0.05), 具有可比性,见表1。

表1 对照组、OA组和RA组受试者一般资料比较
2.2 对照组、OA组和RA组受试者血清sPD-1、IRF4水平比较
对照组、OA组和RA组受试者血清sPD-1、IRF4水平比较,差异有统计学意义(P<0.05)。与对照组比较, OA组和RA组受试者血清sPD-1、IRF4水平均升高,差异有统计学意义(P<0.05)。与OA组比较, RA组受试者血清sPD-1、IRF4水平升高,差异有统计学意义(P<0.05)。见表2。
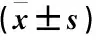
表2 对照组、OA组和RA组受试者血清sPD-1、IRF4水平比较 ng/mL
2.3 RA缓解组和RA活动组RA患者血清sPD-1、IRF4水平比较
与RA缓解组比较, RA活动组RA患者血清sPD-1、IRF4水平升高,差异有统计学意义(P<0.05), 见表3。

表3 RA缓解组和RA活动组患者血清sPD-1、IRF4水平比较 ng/mL
2.4 对照组、OA组和RA组受试者血清IL-4、IL-17、IFN-γ水平比较
对照组、OA组和RA组受试者血清IL-4、IL-17、IFN-γ水平比较,差异有统计学意义(P<0.05)。与对照组比较, OA组和RA组受试者血清IL-4、IL-17、IFN-γ水平均升高,差异有统计学意义(P<0.05)。与OA组比较, RA组受试者血清IL-4、IL-17、IFN-γ水平升高,差异有统计学意义(P<0.05), 见表4。

表4 对照组、OA组和RA组受试者血清IL-4、IL-17、IFN-γ水平比较 pg/mL
2.5 RA患者血清sPD-1、IRF4水平与血清IL-4、IL-17、IFN-γ水平的相关性分析
相关性分析结果显示, RA患者血清sPD-1水平与血清IL-4、IL-17、IFN-γ水平均呈正相关(r=0.432、0.426、0.515,P<0.05), RA患者血清IRF4水平与血清IL-4、IL-17、IFN-γ水平均呈正相关(r=0.480、0.536、0.526,P<0.05), 见图1。

图1 RA患者血清sPD-1、IRF4水平与血清IL-4、IL-17、IFN-γ水平的相关性分析图
3 讨 论
RA是一种以滑膜炎症及关节软骨、骨质侵蚀性破坏为主要特征的自身免疫性疾病,会引起患者关节疼痛、肿胀、僵硬和功能丧失[12]。RA作为特发性的自身免疫性、慢性炎症疾病,自身免疫紊乱及炎症反应异常在其发病机制中扮演重要角色[1]。T细胞异常活化介导的免疫系统紊乱在RA进展中起关键作用, T细胞异常激活后,会分泌IL-4、IL-17、IFN-γ等各种炎症细胞因子,加重RA滑膜炎病情。本研究显示, RA患者血清IL-4、IL-17、IFN-γ水平均高于OA患者、健康者,表明T细胞活化分泌IL-4、IL-17、IFN-γ参与RA发生。研究[13]发现,T细胞活化过程需要抗原刺激提供的第一信号和协同刺激分子提供的第二信号刺激,如果缺失协同刺激分子的相互作用传递,会导致T细胞无反应性或功能失活。因此,对T细胞增殖活化有关的因子展开研究有助于阐明RA发病机制,找到新的有效治疗靶点。
在免疫调节中, PD-1/PD-L1信号通路发挥着负性调节作用, PD-1可结合PD-L1抑制正性共刺激分子的表达,从而阻止T细胞的异常活化、增殖,减少IL-4、IL-17、IFN-γ等炎症因子的分泌[14]。武加标等[15]研究表明, PD-1/PD-L1信号通路可通过调控T细胞参与RA的发生,而sPD-1作为PD-1的可溶性型形式,具有阻断PD-1/PD-L1负性信号通路的生物学功能,可能调控IL-4、IL-17、IFN-γ的分泌。郭艳华等[16]发现, sPD-1在RA患者血清中呈异常高表达,并与病情严重程度呈正相关。本研究发现, RA患者血清sPD-1水平较OA患者、健康者高,活动期RA患者血清sPD-1水平较缓解期RA患者高,表明sPD-1不仅参与RA的发病过程,还与RA病情进展有关。此外, RA患者血清sPD-1水平与血清IL-4、IL-17、IFN-γ水平均呈正相关,表明sPD-1表达与T细胞活化分泌IL-4、IL-17、IFN-γ关系密切,推测sPD-1可能通过阻断PD-1/PD-L1通路导致RA患者T细胞活化信号不断增强,最终导致自身免疫紊乱,并不断分泌IL-4、IL-17、IFN-γ等细胞因子,加重RA病情。
在T细胞主导的免疫反应中, IRF家族成员IRF4可作为非特异的转录因子参与调节Treg/Th17、Th1/Th2细胞的分化和发育,进而影响IL-4、IL-17、IFN-γ等细胞因子的分泌过程[17]。郭钊林[18]研究显示, IRF4在自身免疫性疾病系统性红斑狼疮患者血清中显著增高,且与疾病活动性指数相关。本研究显示, RA患者血清IRF4水平较OA患者、健康者均升高,且活动期RA患者血清IRF4水平较缓解期RA患者升高,表明IRF4参与了RA的发生,并与RA疾病活动性有关。相关性分析表明, RA患者血清IRF4水平与血清IL-4、IL-17、IFN-γ水平呈正相关,表明IRF4与免疫炎症反应关系密切,鉴于IRF4与T细胞主导的免疫反应的关系,推测IRF4可能增强了RA患者的T细胞活化信号,刺激其不断向Treg/Th17、Th1/Th2分化,进而引起IL-4、IL-17、IFN-γ分泌的增加,导致免疫炎症反应异常,从而参与RA的发生和发展。
综上所述,sPD-1、IRF4在RA患者血清中均显著升高,在不同疾病活动性RA患者血清中呈差异表达,与患者体内免疫炎症反应异常密切相关,参与RA的发生和发展,有潜力成为RA的有效治疗靶点。

