狼疮足细胞病伴发急性肾损伤的危险因素及预后分析
庄璐璐 夏 文 徐 峰 陈独群 金 英 刘正钊 曾彩虹 胡伟新
狼疮足细胞病是通过非免疫复合物途径介导的狼疮性肾炎(LN)[1-4],约占LN肾活检患者的1.5%[4],以肾病综合征(NS)为主要临床表现,肾活检光镜下肾小球病变轻,超微病理以足细胞广泛足突融合而毛细血管袢无或偶见免疫沉积物为特征[5-6]。
我们前期研究发现狼疮足细胞病患者的急性肾损伤(AKI)发生率为34%,合并AKI的患者存在中重度肾小管间质急性损伤[4],但AKI的发生机制及其对病程转归的影响不明。本研究通过回顾性分析狼疮足细胞病的病例资料,探讨AKI发生的危险因素,明确狼疮足细胞病合并AKI对预后的影响,以期为狼疮足细胞病患者发生AKI风险评估及诊疗方案选择提供重要参考依据。
对象和方法
病例资料2002年1月至2021年6月在国家肾脏疾病临床医学研究中心住院并经肾活检病理检查确诊的90例狼疮足细胞病患者,均符合以下条件:(1)符合系统性红斑狼疮(SLE)诊断标准[7];(2)肾损害临床表现为NS,肾活检病理检查明确为狼疮足细胞病;(3)有完整的临床、病理和随访资料。
排除标准:(1)AKI发生与感染、药物、血栓、尿路梗阻等其他原因相关;(2)合并抗中性粒细胞胞质抗体(ANCA)相关性血管炎、类风湿型关节炎、硬皮病等其他自身免疫性疾病,或其他肾小球疾病;(3)伴有严重心脑血管疾病,病情危重者。
本研究经东部战区总医院伦理委员会批准(批号:2021NZKY-021-01)。
临床和实验室资料收集肾活检时患者的基线资料,包括:(1)年龄、性别、SLE病程等。(2)临床表现:与SLE活动相关的发热、皮肤黏膜损伤、中枢神经系统损伤、关节炎、心脏损害及肠道损害等。SLE活动度评分采用SLE-DAI 2000[8]。(3)实验室检查:尿常规、尿沉渣、尿蛋白量、尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)、尿视黄醇结合蛋白(RBP);血常规、血生化、抗核抗体(ANA)、抗双链DNA(抗-dsDNA)、血清补体C3和C4等。
NS定义为尿蛋白≥3.5 g/24h且血清白蛋白<30 g/L,伴或不伴外周水肿和高脂血症。镜下血尿定义为尿沉渣镜检红细胞数计数>3个/HPF。AKI定义及分期参照2012年《改善全球肾脏病预后组织(KDIGO)急性肾损伤临床实践指南》[9]。根据是否合并AKI,狼疮足细胞病患者分为AKI组与非AKI组。高血压指收缩压≥140 mmHg和(或)舒张压≥90 mmHg。
肾脏病理LN的分型标准依据2018年《国际肾脏病学会及肾脏病理学会工作组(ISN/RPS)修订的LN病理分型标准》[8]。
狼疮足细胞病的病理诊断标准符合:(1)光镜下肾小球病变轻微或表现为系膜增生、局灶节段性肾小球硬化(FSGS),无内皮下及上皮侧免疫复合物沉积,FSGS排除增殖型LN遗留的瘢痕;(2)免疫荧光观察血管袢无免疫复合物沉积,伴或不伴系膜区免疫复合物和补体沉积;(3)电镜下足细胞足突融合范围≥50%,典型者≥70%,伴系膜区电子致密物沉积或少量孤立性内皮下或上皮侧电子致密物沉积[6]。根据肾小球形态学特征分为肾小球微小病变(MCD),系膜增生性病变(MsP)和FSGS三组[3-4]。
对肾小管间质急性损伤(ATI)和慢性损伤(CTI)半定量评分:根据ATI或CTI范围占整个皮质区肾小管间质面积的比例分别进行半定量赋分:0分(无病变)、1分(<25%)、2分(25%~49%)、3分(≥50%,或存在肾小管上皮细胞坏死)。
足突融合范围测量方法[10]:采用电镜下足突融合(FPE)占肾小球毛细血管袢基膜总长度的百分比表示。
治疗反应与随访结局患者口服糖皮质激素(激素)诱导剂量为30~60 mg/d,完全缓解2周或完成12周疗程后开始逐渐减量,减至10 mg/d 时长期维持。其他免疫抑制剂包括环磷酰胺、他克莫司、吗替麦考酚酯、硫唑嘌呤、来氟米特、雷公藤、利妥昔单抗等。治疗反应包括[11]:(1)完全肾脏缓解(CRR):指尿蛋白定量<0.5 g/24 h,无活动性尿沉渣,血清白蛋白≥35.0 g/L,血清肌酐(SCr)正常或升高<10%;(2)部分肾脏缓解(PRR):指尿蛋白定量下降超过50%且<3.0 g/24 h,血清白蛋白>30.0 g/L,SCr正常或升高<10%;(3)未缓解(NR):未达CRR或PRR。
复发指CRR患者尿蛋白≥1.0 g/24 h、PRR患者尿蛋白增加≥2.0 g/24 h,伴或不伴活动性尿沉渣及SCr增加。
随访截止至2021-11-30,随访肾脏终点为终末期肾病(ESKD)或估算的肾小球滤过率(eGFR)较基线值下降>50%。
统计学方法采用《IBM SPSS 25.0》软件进行统计学分析。计量资料以中位数(四分位数间距)描述,两组间比较采用t检验(正态分布)、Mann-Whitney U检验(非正态分布);多组间比较采用方差分析(正态分布)、Kruskal-Wallis检验(非正态分布),事后采用Bonferroni法进行两两比较。计数资料以数量(百分比)描述,组间比较采用 Person 卡方检验或 Fisher 精确检验。将单因素分析P<0.1的变量纳入Logistics多因素分析。绘制ROC曲线寻找独立危险因素的最佳截断值。狼疮足细胞病患者CRR及复发时间采用Kaplan-Meier生存曲线评估。P<0.05为差异有统计学意义。
结 果
一般临床和病理特征90例狼疮足细胞病患者的基线资料见表1和表2。肾损伤均表现为NS,中位尿蛋白量5.4 g/24 h。32例患者(35.6%)合并AKI,其中AKI 1期13例,AKI 2期6例,AKI 3期13例。肾脏病理显示肾小球病变以MsP最常见(占52.2%),其次为MCD和FSGS,43例(47.8%)伴ATI。

表1 狼疮足细胞病患者的基线临床特征
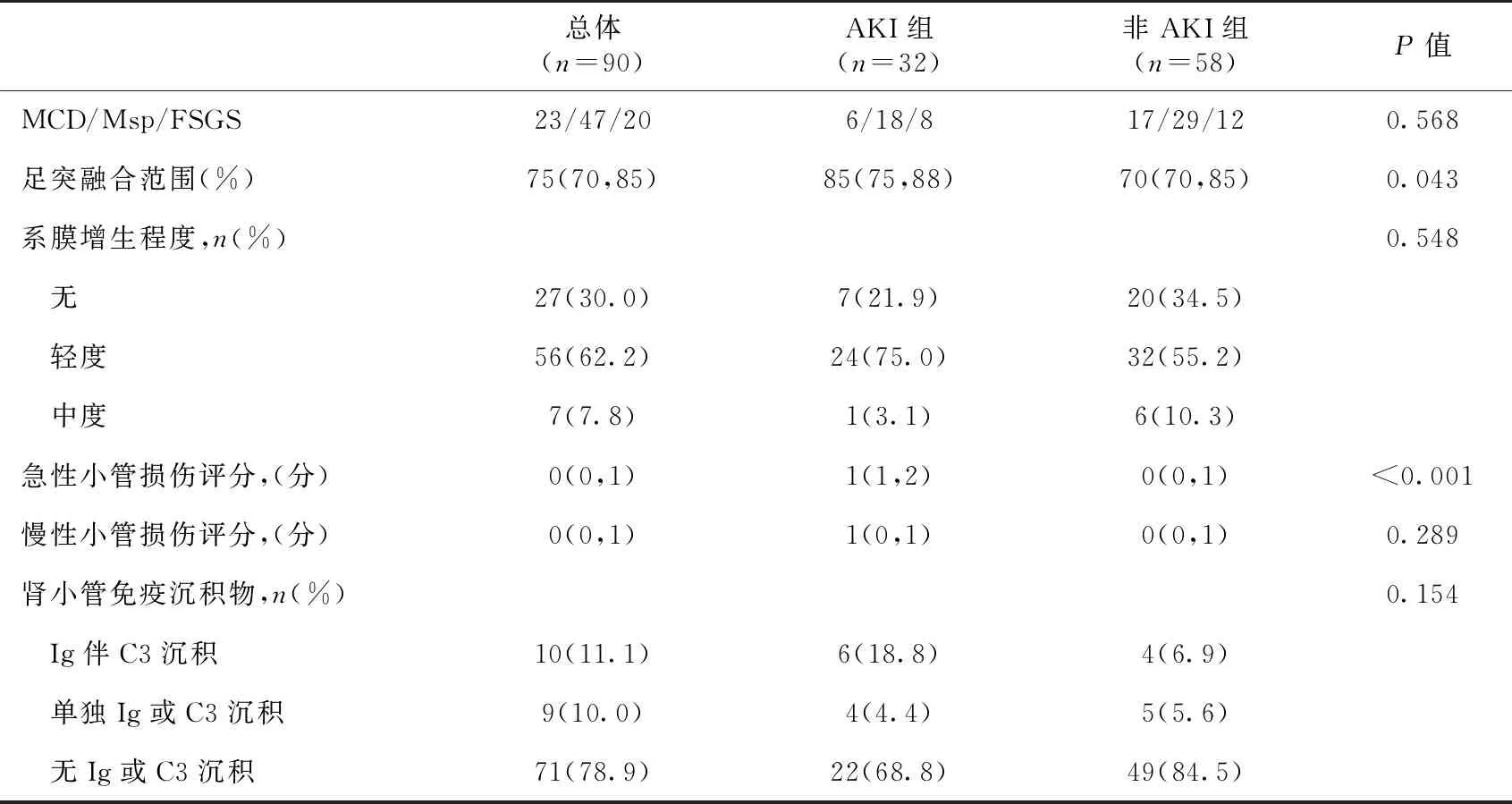
表2 狼疮足细胞病患者的肾脏病理特征
伴AKI患者的临床和病理特征狼疮足细胞病AKI组与非AKI组患者临床和病理指标的比较见表1和表2。FSGS组和MsP组患者合并AKI的比例高于MCD组患者,但三组间比较无显著差异。
AKI组患者尿蛋白,尿NAG和尿RBP水平显著增高,而AKI组患者血红蛋白(Hb)、血清白蛋白及补体C3和C4水平显著低于非AKI组。
肾脏病理指标方面,AKI组患者的ATI评分及足突融合范围显著高于非AKI组。
发生AKI的危险因素单因素Logistic回归分析显示,尿蛋白量、Hb、白蛋白水平、C3水平与狼疮足细胞病患者发生AKI相关。多因素分析显示尿蛋白量升高和C3水平下降是狼疮足细胞病患者发生AKI的独立危险因素(表3)。
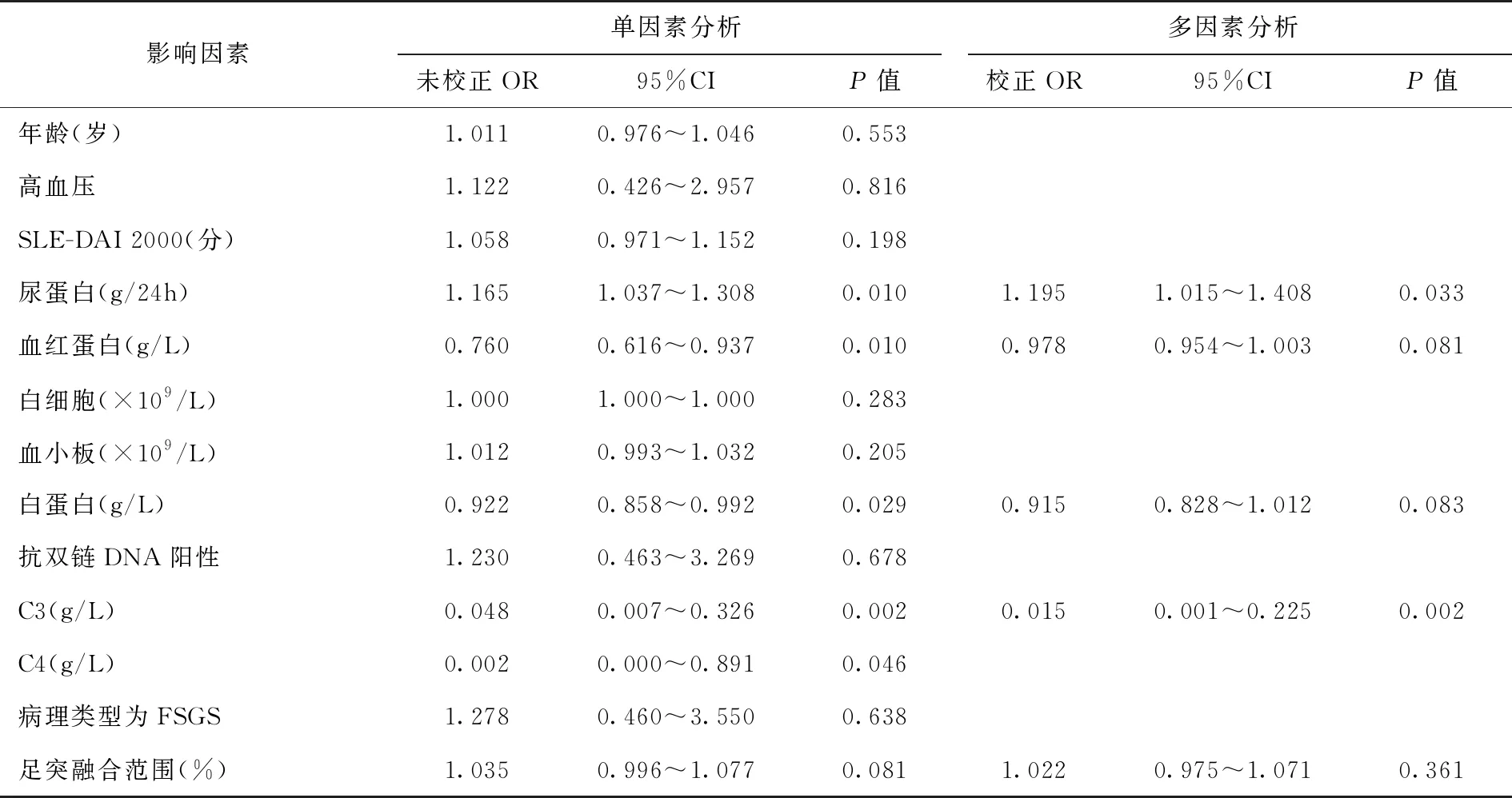
表3 狼疮足细胞病患者发生AKI的危险因素(n=90)
伴AKI患者的治疗反应和预后AKI组和非AKI组治疗方案比较无显著差异。治疗后共86例(95.6%)患者获得肾脏缓解,其中71例(78.9%)CRR,两组患者的CRR无显著差异(P>0.05)(表4)。
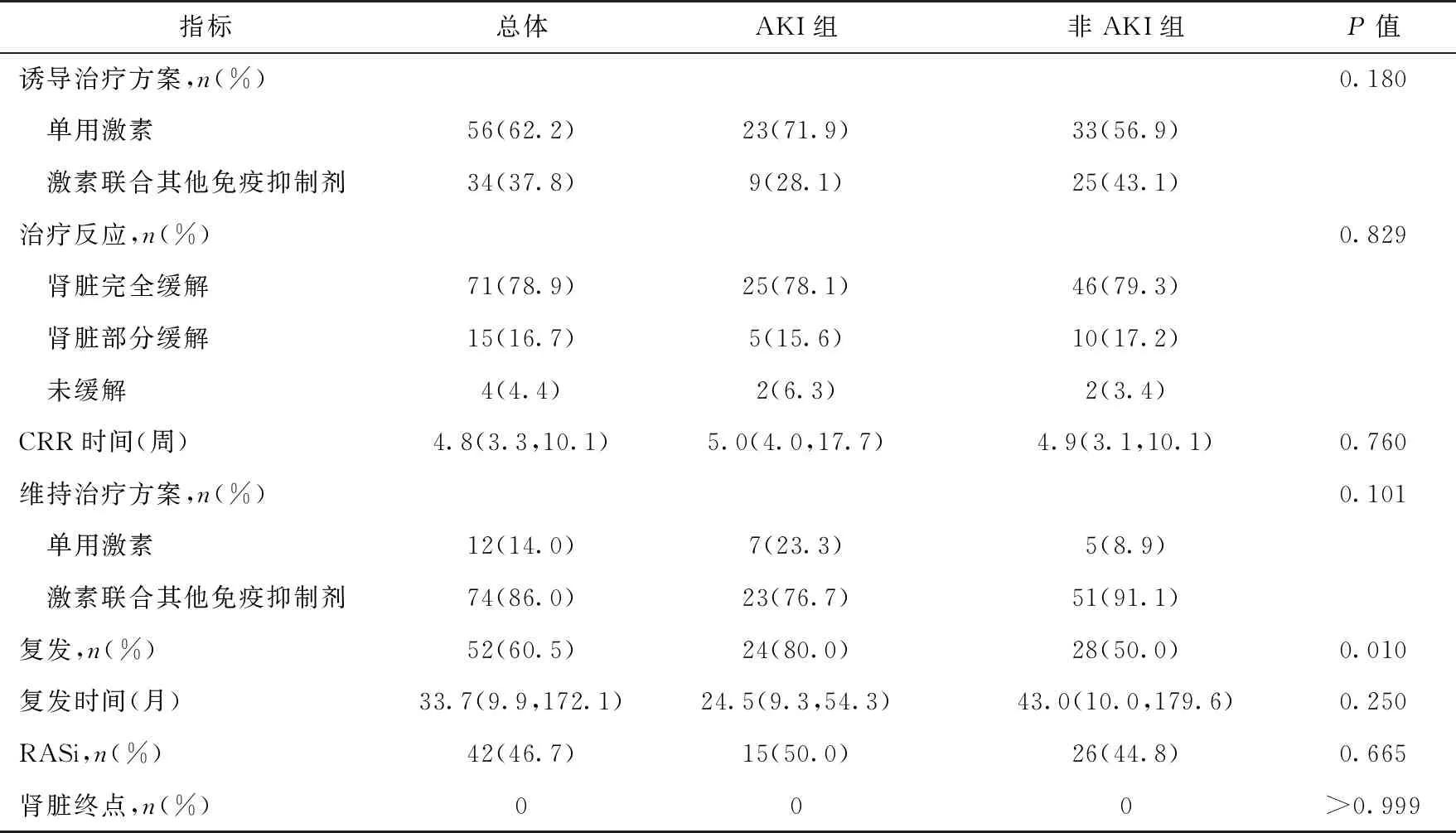
表4 狼疮足细胞病患者的治疗反应及预后
随访期间52例(60.5%)患者复发,AKI组患者肾脏复发率显著升高(P=0.010)。生存分析发现AKI组累积复发率显著高于非AKI组(P=0.008)(图1)。两组均无患者达到肾脏终点(表4)。
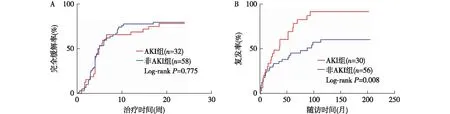
图1 狼疮足细胞病患者的治疗反应(A)及肾脏复发率(B)
19例患者在复发后接受重复肾活检,10例患者的病理类型发生了转型,其中6 例转为Ⅴ型,3例转为Ⅳ型,转为Ⅳ+Ⅴ型1例。两组比较病理转型率无显著差异(P=0.062)。
讨 论
本研究对迄今为止样本量最大的狼疮足细胞病队列进行了分析,发现35.6%的患者伴AKI,存在严重肾小管间质损伤。多因素分析发现高尿蛋白和低C3水平是狼疮足细胞病并发AKI的独立危险因素。随访研究发现,并发AKI的患者维持期复发率显著升高,但对远期人肾预后无明显影响。
早期国外小样本研究报道狼疮足细胞病AKI的发生率超过50%[2-3,12],肾小球病变为FSGS的患者AKI发生率高于MCD,与我们前期研究一致[4]。文献报道成人原发性MCD患者AKI发生率为25%~35%[13-16],原发性FSGS患者AKI发生率为44.4%[17],与本研究相近。原发足细胞病与狼疮足细胞病除系膜区免疫沉积物存在差异外,足细胞损伤的特征、AKI的发生率和临床治疗反应均相似,表明可能存在相似的AKI机制。
各种类型LN都可并发AKI[4,18-20]。我们一项1352例大样本队列研究发现,17.5%的LN患者合并AKI,其中IV型AKI发生率为27.4%,其次为V+IV型(20.9%)[18]。另一项322例LN的研究中[19]AKI的发生率为20.5%,合并AKI患者的远期肾脏存活率显著降低。由此可见,狼疮足细胞病患者AKI的发生率高于Ⅳ型和Ⅴ+Ⅳ型LN。根据报道发生AKI的LN主要病变为肾小球毛细血管袢坏死和新月体形成、袢内增生及炎症细胞浸润等增生性病变,或血栓性微血管病(TMA),伴有显著血尿、大量蛋白尿和高血压等临床特征。而本文狼疮足细胞伴AKI的患者除大量蛋白尿外,血尿发生率并未明显增高,高血压发生率也较低,但尿液肾小管损伤指标和肾活检病理ATI变均显著增高,表明狼疮足细胞病并发AKI患者的主要病变特征是ATI。
狼疮足细胞病发生AKI的危险因素目前缺乏研究,肾小管上皮细胞损伤机制不明。蛋白尿是被认为是足细胞病并发AKI的重要因素,早期有研究认为MCD患者AKI的发生与肾病综合征时有效循环容量不足相关[21]。但容量不足的患者在纠正容量不足后并不能使患者的肾功能恢复正常[13]。最近研究认为肾病综合征水肿时较高的组织液压力可促使增加淋巴液回流以维持正常血浆容量[22]。另有研究发现MCD患者AKI的发生与NS时内皮素表达增加导致肾血管收缩和肾小管缺血有关[23]。
本研究发现尿蛋白高和C3水平低是狼疮足细胞病患者发生AKI的独立危险因素,多因素分析表明肾小球滤过屏障损伤带来大量蛋白尿并损伤肾小管上皮细胞是AKI发生的主要风险因素。本研究首次发现狼疮足细胞病患者血清低C3水平与AKI的发生相关。SLE活动时引起大量免疫复合物在肾小球沉积并活化补体消耗所致C3减低[24]。在狼疮足细胞病中AKI组与非AKI组肾小管Ig和C3沉积无差异提示狼疮足细胞病合并AKI患者并无肾脏局部补体活化的证据,C3降低可能由狼疮活动引起足细胞损伤消耗C3所致。根据本研究结果,推测狼疮足细胞病发生AKI或主要与肾小球滤过屏障损伤程度(以蛋白尿为标志)及SLE肾脏活动(以低补体为标志)相关。
本研究亦首次发现并发AKI的狼疮足细胞病患者肾脏复发率显著升高,表明并发AKI的患者维持期治疗需要更加优化以降低其复发率,其潜在的机制需要进一步研究。
然而,本研究为单中心回顾性研究,结论仍需多中心研究的进一步验证;亦未分析AKI标志物等指标,无法评价这些标志物对狼疮足细胞病患者发生AKI的预测能力。
小结:本研究发现狼疮足细胞病患者AKI的发生与高尿蛋白、低C3水平相关。发生AKI的狼疮足细胞病患者维持期复发率更高,表明狼疮足细胞病患者的临床和病理的不均一性。

