北京西北浅山区退化草地植被恢复对土壤微生物群落多样性的影响
阚海明, 庞 卓, 陈 超, 邹俊亮, 张国芳, 武菊英
(北京草业与环境研究发展中心, 北京 100097)
北京西北部浅山区是承接我国北方农牧交错带与平原生态系统的重要过渡地带,是首都地区重要的水源涵养地和生态安全屏障,同时该区域也是生产生活的主要聚集区,人类活动频繁,生态环境敏感脆弱[1-3]。植被缺失、草地退化等问题制约了该区域生态系统服务功能的发挥[4-5]。如何长效地恢复退化草地生态系统植被,修复土壤生态系统功能,是一个亟待解决的重要问题[6-7]。植物多样性与土壤微生物多样性之间存在着密切的联系。进一步了解该区域植物群落组成对土壤微生物多样性的影响及其机制对于合理开展退化草地植被恢复具有重要的指导意义[8]。
植被恢复是退化生态系统恢复与重建的关键措施。选择合适植物作为退化草地的建群物种,构建不同的植被恢复模式,以期加快植被恢复进程,一直以来都是恢复生态学研究的热点。通过多年生适生植物的建植,构建稳定的植物群落,能够有效地提升植被覆盖度,改善土壤结构。紫花苜蓿(MedicagosativaL.)与无芒雀麦(BromusinermisLeyss.)是多年生优质牧草,常作为生态恢复的建群物种而被广泛应用。在我国北方地区这2种牧草常用来补播退化草地,是人工草地建植常用的多年生牧草[9-11]。相关研究主要集中在对植物多样性变化和环境因素的分析,对于地下土壤微生物响应过程的研究较少。近年来,基于2代、3代测序技术的成熟,大大提高了判别微生物群落组成与多样性变化的灵敏度,显著提升了相关研究的质量。
土壤微生物是生态系统功能的敏感指示剂,它们的物种和功能多样性也是维持生态环境可持续发展的关键所在[12-13],对植物的生长及植物群落的建立具有至关重要的作用。土壤微生物组成变化对很多环境因子如优势物种、土壤类型、pH和地理格局等十分敏感,可以对土壤性质和功能的变化起到很好的指示作用[14-16]。人工植被恢复不仅包括地上植被多样性的恢复,而且还包括土壤微生物与植物的相互作用过程[17-19]。在植被恢复过程中,土壤微生物的量、活性及种群结构都可能发生很大的变化[20-21]。由于不同植被的生长方式不同,对土壤生态系统的影响存在差异,且在植被恢复过程的不同阶段,土壤的变化也不尽相同[22-23]。因此,明确植被恢复对土壤微生物群落多样性的影响,探究不同植物与微生物多样性的关系,对于指导退化草地生态系统植被恢复具有重要的理论与实际意义。本研究以不同植被恢复方式的退化草地为研究对象,分析土壤微生物群落的响应变化,为探讨北京西北部浅山区植被恢复提供理论基础。
1 材料与方法
1.1 试验区概况
在北京市西北部选取沙荒化土地典型区域,建立试验区。试验地点位于北京市延庆区退化土地长期定位生态研究站(115°50′23″ E,40°27′53″ N)。该地位于华北农牧交错带范围内,气候属温带大陆性气候,全年降水主要分布于4—9月,年降水量在600 mm左右;土壤质地介于砂质土与壤土之间。
1.2 样地设置与样方监测
选取土壤质地均一、土壤坡度小于5°的退化沙荒地作为试验区域,采用完全随机区组试验设计,于2015年5月采用补播的方式,建植无芒雀麦(SB)、紫花苜蓿(AF)草地,自然演替地(CK),每种补播恢复处理设9个试验小区(重复),小区面积为10 m×10 m。植被建植后对该区域进行围栏处理。
本试验植物、土壤样品于2017—2019每年的8月末采集。采用样方法调查植物群落,小区内随机布设一个1 m×1 m的植物样方,共调查27个样方,记录每个样方内出现的物种名称以及各物种的盖度(目测法)、多度(样方内各物种的数目)、高度、生物量等。
土壤样品采集同地上部分同步进行,分别收集0~10 cm,10~20 cm,20~30 cm土层的土壤样品,其中一部分留置鲜样用于土壤常规理化性质的测定,另一小部分取样时立即放入干冰中,带回实验室用于测试土壤微生物多样性。每个处理分别选取4个小区采集土壤样品,每小区内采用S型5点取样法,作为一个土壤样品。
1.3 样品分析
地上部分采用样方法,测定物种的丰富度,即每个样方内出现的物种数。并分种测定植株的高度、盖度、频度。分种收集相应的地上部分带回实验室,在65℃下恒温烘干48 h,获得地上生物量;分别计算每个物种在群落当中的重要值。将各物种的相对盖度、相对频度、相对生物量、相对多度进行加权平均,计算物种的重要值(Important value,IV)。基于植物多度计算各群落的α多样性,采用Simpson指数、Shannon指数以及物种丰富度指数(S)来表征植物群落的物种多样性。
另外,微生物α多样性采用Sobs指数和Shannon指数来表征。
Shannon-Wiener指数反映土壤中微生物群落丰富度(H′):H′=- ∑Pi×lnPi
Simpson指数表征土壤中微生物群落优势度(D):D=1-∑(Pi)2
Pielou指数表示植物群落均匀度指数(J):J=-∑(PilnPi)/lns
式中S为样方中观察的物种数,Pi=样品中属于第i种的个体数(OTU数目)的比例如微生物Sobs指数是指丰富度实际观测值。
土壤微生物量碳(Soil microbial biomass carbon,MBC)、土壤微生物量氮(Soil microbial biomass nitrogen,MBN)含量采用氯仿熏蒸法测定,MBC=EC/KEC,EC=熏蒸土壤有机碳质量分数-未熏蒸土壤有机碳,KEC为转换系数,取值0.38;MBN=EN/KEN,EN=熏蒸土壤全氮质量分数-未熏蒸土壤全氮质量分数,KEN为转换系数,取值0.45。
采用CTAB(Cetyltrimethylammonium bromide)方法对样本的基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng·μL-1。以稀释后的基因组DNA为模板,对细菌16SrRNA基因V4区采用带Barcode的特异性引物(515F和806R)进行PCR扩增,每个样品3次重复。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。土壤中真菌采用ITS引物(1737F和 2043R)进行PCR扩增提取,后续进行Illumina建库测序。
1.4 生物信息学分析
根据Barcode序列和PCR扩增引物序列从测定数据中拆分出各样品数据,截去Barcode和引物序列后对每个样品的reads进行拼接后得到原始测序数据;原始测序数据经质检和嵌合体去除得到有效数据(effective tags)。利用Uparse软件对样品的有效序列进行OTUs聚类(相似度97%以上),用Mothur方法与Silva软件的SSUrRNA数据库进行物种注释(设定阈值为0.8~1.0);采用MUSCLE(3.8.31)软件进行快速多序列比对,最后对测序数据进行标准化处理,采用R3.6软件计算Alpha多样性指数、β多样性指数。通过非度量多维尺度(NMDS)在OTU水平来度量细菌以及真菌群落差异。
1.5 数据分析
本试验数据为2017—2019年试验数据采用OFFICE 2016,SPSS 20.0(IBM)进行初步处理和统计方差分析,采用一般线性模型对数据进行重复测量,并用Duncan和LSD法进行多重比较,并检验方差的显著性(F);当P<0.05时认为差异显著,P<0.01时差异极显著。所有数据采用Excel 2016和Sigmaplot 12.5进行绘图。
2 结果与分析
2.1 不同植被恢复方式下草地植物群落特征
经过一定时间的初级植被恢复演替(6年),3种不同植被恢复方式下的草地群落组成发生了显著的分异。3种植被恢复方式下的草地优势物种差异明显(表1),共生植物物种以狗尾草为主。3种植被恢复方式多年生植物的占比分别为33.3%,59.0%,44.7%,其中补播紫花苜蓿与补播无芒雀麦2种植被恢复方式均使补播物种成为了优势物种。
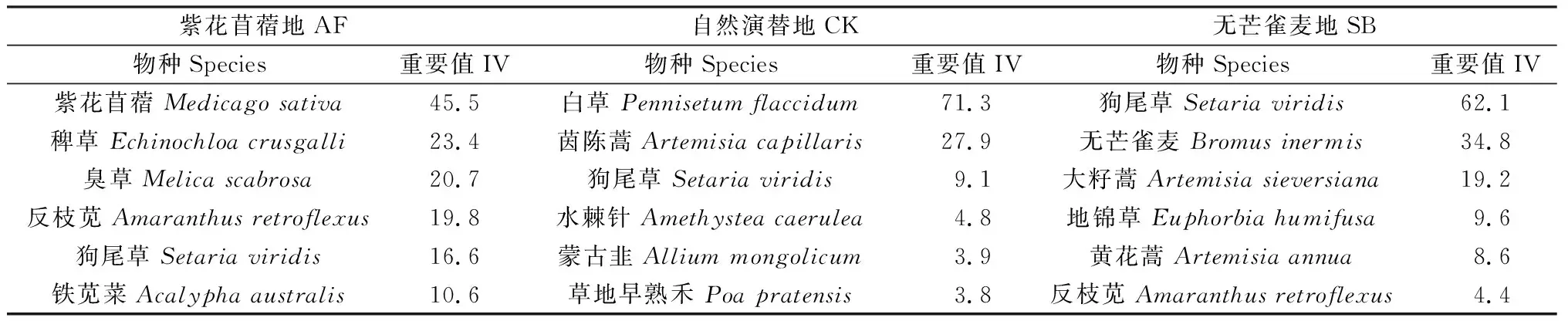
表1 2019年群落基本特征Table 1 Important value of each species of different plant communities in 2019
2.2 植被恢复对草地物种多样性的影响
不同植被恢复方式对物种多样性的影响表现出不一致的趋势(图1)。植被恢复的时间效应对3种草地的物种多样性均产生了显著地影响(P<0.05)。随着植被恢复时间的延长,CK的物种数和多样性指数呈逐渐下降的趋势;SB的物种数和多样性指数呈逐渐增加的趋势;AF的多样性指数变化不大,但其物种数2019年比2017年平均减少了3种。SB的物种数和多样性指数显著低于CK(P<0.05),AF和CK的物种数和多样性指数差异并不明显,CK的物种数略高于AF。

图1 草地植物多样性的变化Fig.1 α-diversity of different restored plant community注:大写字母表示不同植被恢复方式草地间差异显著(P<0.05),小写字母表示同一年内不同植被恢复方式间差异显著(P<0.05)Note:Different capital letters indicate significant differences between different restoration methods at the 0.05 level,and different lowercase letter indicate significant differences between different restoration methods in the same year at the 0.05 level
2.3 植被恢复对土壤微生物量碳、氮的影响
如图2所示,不同年际间土壤的微生物量碳含量没有显著差异,不同处理间微生物量碳含量也不存在显著差异,但不同土壤深度对微生物量碳含量的影响差异显著(P<0.05),表现为0~10 cm (232.602 mg·kg-1) > 10~20 cm (100.896 mg·kg-1) > 20~30 cm (42.187 mg·kg-1)。
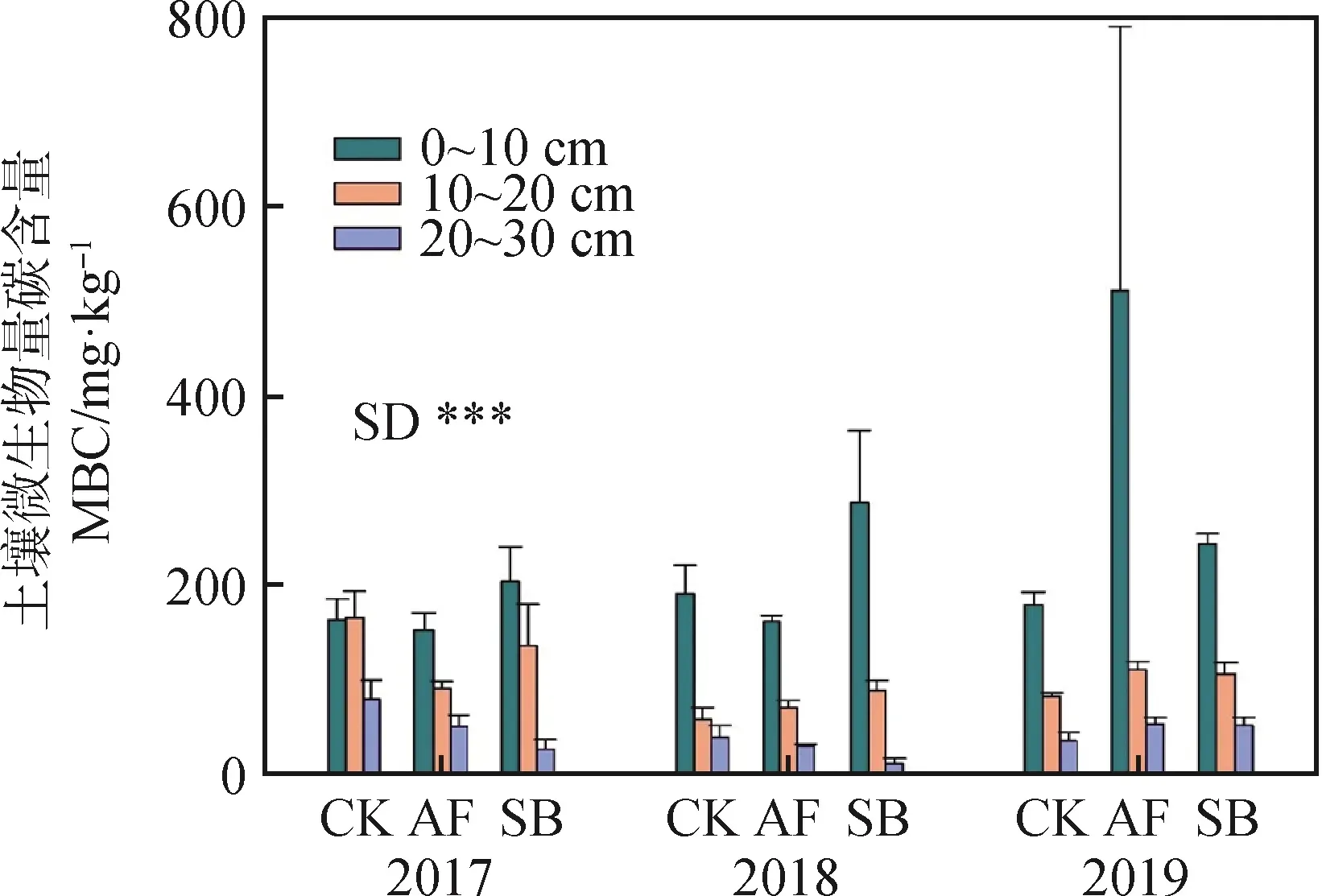
图2 不同植被恢复方式对土壤微生物量碳的影响Fig.2 Effects of different restoration approaches on soil microbial biomass carbon
土壤微生量氮含量(图3)受时间效应影响差异极显著(P<0.01),总体微生物量氮含量呈增加的趋势,同一土层不同年际间的微生物量氮含量差异显著,2018年和2019年表层(0~10 cm)土壤的MBN含量极显著地高于2017年含量(P<0.01)。
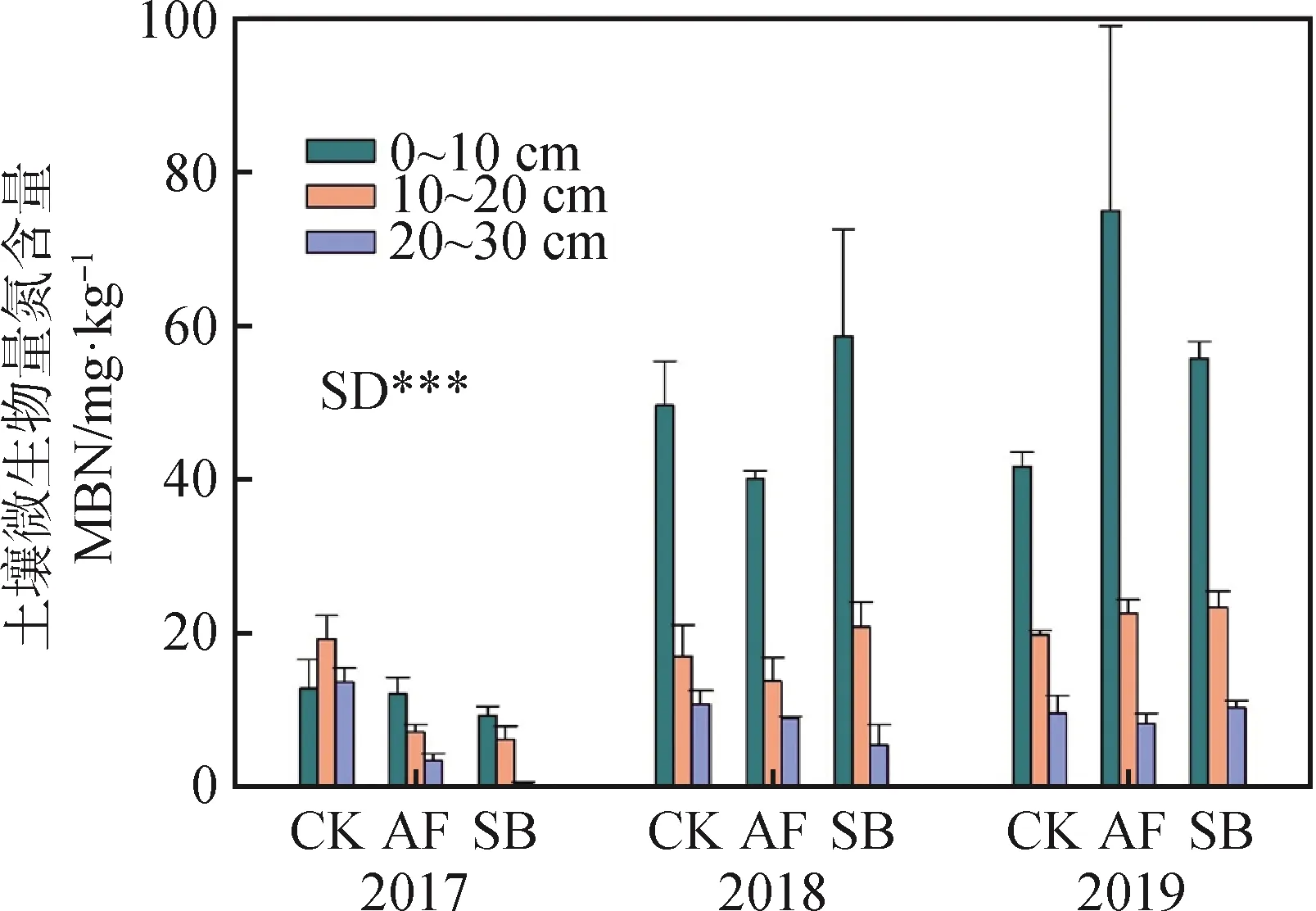
图3 不同植被恢复方式对土壤微生物量氮的影响Fig.3 Effects of different restoration approaches on soil microbial biomass nitrogen
不同土壤深度对微生物量氮的影响差异显著,表现为0~10 cm (34.91 mg·kg-1) > 10~20 cm(16.72 mg·kg-1) > 20~30 cm (7.93 mg·kg-1)。
不同植被恢复方式与时间的交互效应显著地影响土壤微生物量氮含量(P<0.05),但不同植被恢复方式对土壤微生物量氮含量并没有显著影响,说明不同植被恢复方式影响土壤微生物量氮的效应随着恢复时间的增加而逐渐显现。
2.4 植被恢复对土壤细菌群落的影响
土壤细菌测序共得到1 651 418条碱基,有效序列主要分布于421~460 bp,归类于6 078个OTU,分属于39个门、970个纲、189个目、365个科、653个属和14 170个种。
2.4.1细菌多样性 通过在门水平测定土壤细菌的多样性指数(包括Sobs,Shannon)发现,不同植被恢复方式对细菌的多样性指数均没有显著性影响,只有AF和CK间的细菌门数量差异显著(P<0.05)(图4)。
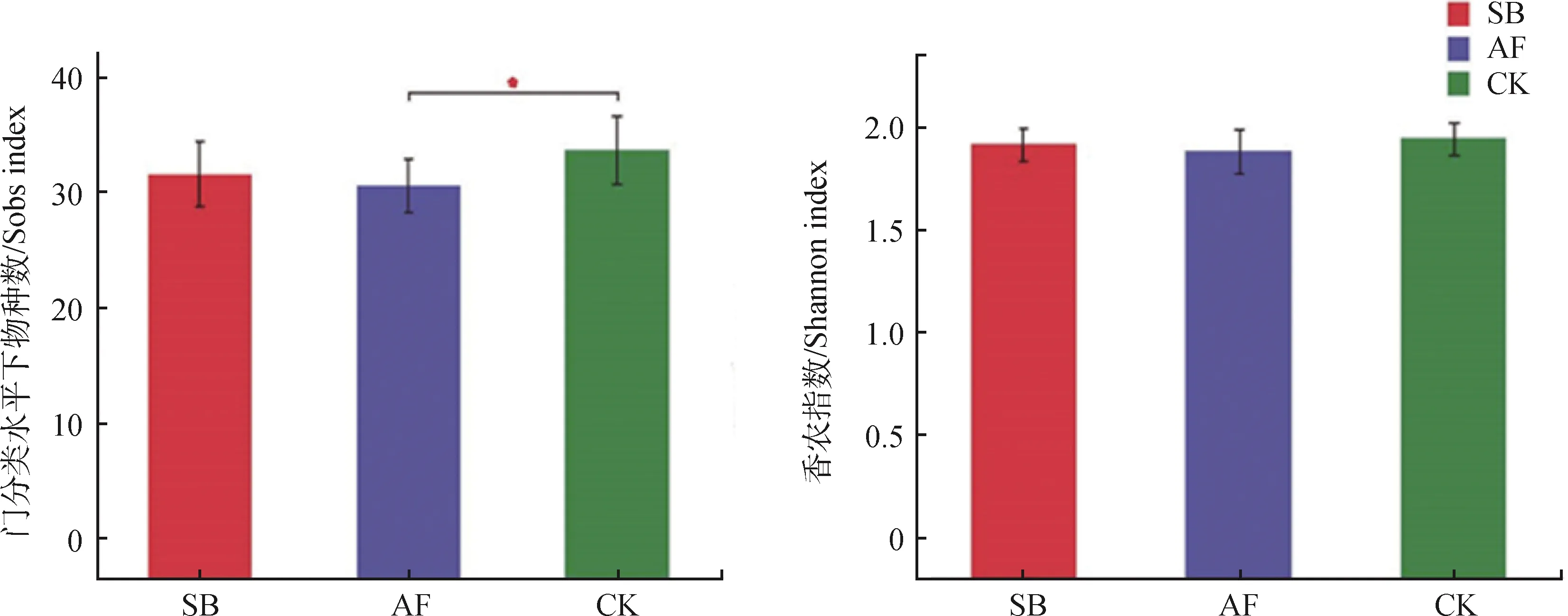
图4 植被恢复对土壤微生物群落α多样性的影响(Sobs指数、Shannon指数)Fig.4 T-test for α-diversity of soil bacterial community of different restoration approaches注:*为P<0.05,**为P<0.01,***为P<0.001,下同Note:*,P<0.05,*, P<0.01***, P<0.001,the same as below
2.4.2细菌群落组成 细菌群落以变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)为主,还包括芽单胞菌门(Germatimonadetes)、拟杆菌门(Bacterodietes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirobacteria)、装甲菌门(Armatimonadetes)等(图5)。其中,补播紫花苜蓿草地中的拟杆菌门细菌占比要显著地高于无芒雀麦地和自然演替地(P<0.05),浮酶菌门和装甲菌门细菌占比显著地低于无芒雀麦草地和自然演替草地(P<0.05)。

图5 不同植被恢复方式土壤细菌群落组成差异Fig.5 Composition of soil bacterial community of different restoration approaches at phylum level
将不同处理间的细菌数据在OTU水平下进行NMDS分类(stress为0.123<0.2)发现:3种植被恢复方式下的细菌群落可以很好地分开,并且SB和AF的细菌群落明显的和CK区分开(图6)。采用细菌分型分析也发现,CK和SB,AF的细菌可以明显的区别开。表明3种植被恢复方式对土壤细菌群落的β多样性影响显著。
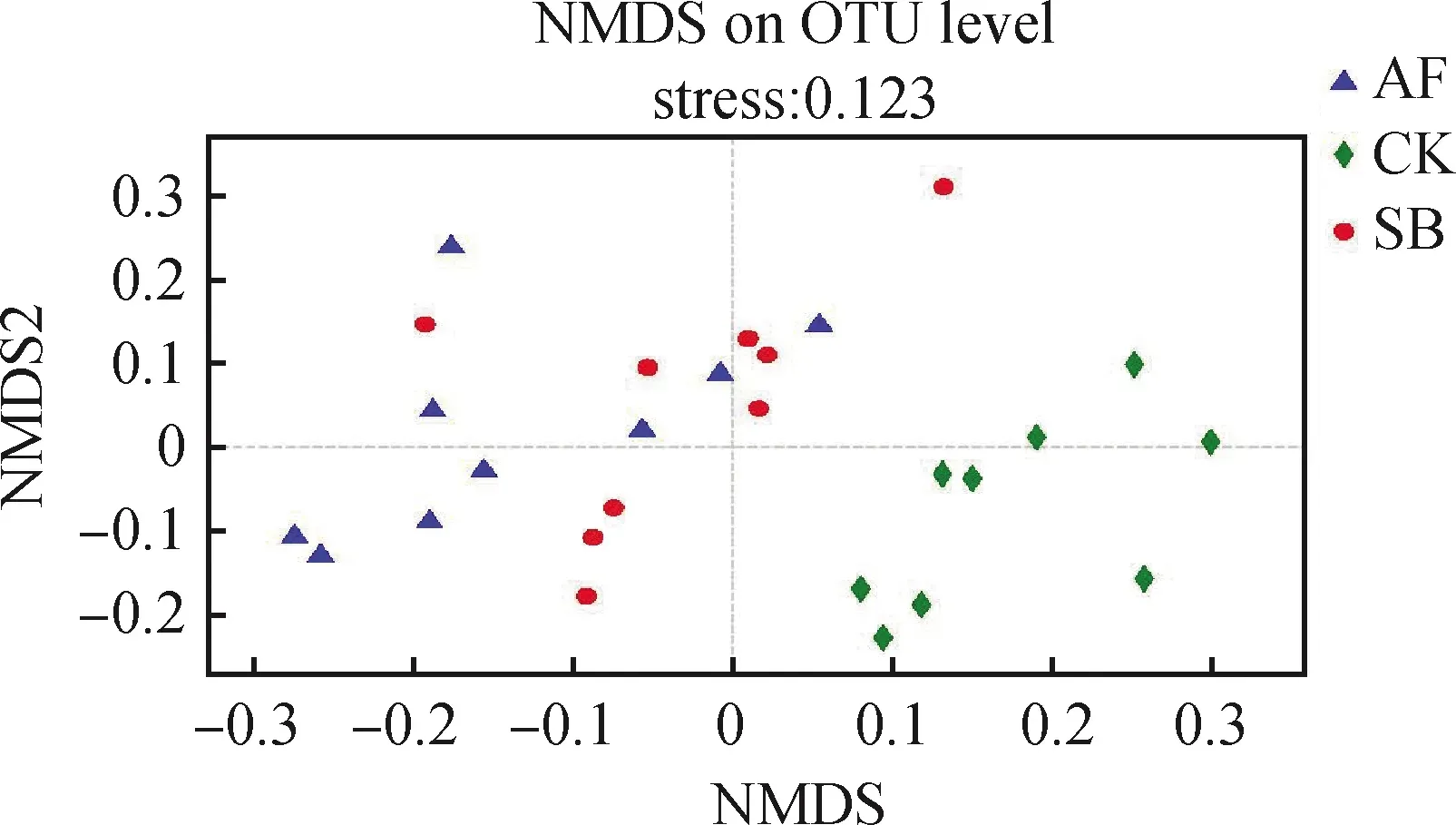
图6 NMDS分析结果Fig.6 Non-metric multidimensional scaling analysis for β-diversity of soil bacterial community
2.5 不同植被恢复方式对土壤真菌多样性的影响
土壤真菌测序共得到2 065 637条碱基,有效序列主要分布于221~320 bp,归类于1 809个OTU,分属于8个门、29个纲、79个目、167个科、343个属和606个种。主要包括子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)和壶菌门(chytridiomycota)等真菌。
2.5.1真菌多样性 在门水平分析不同植被恢复方式下土壤真菌的多样性指数(包括sobs,shannon),如图7所示,补播紫花苜蓿地和无芒雀麦地的真菌Sobs指数均显著地高于自然演替地(P<0.05和0.01),其中紫花苜蓿地的真菌Sobs指数最高;土壤真菌香农指数以无芒雀麦草地最高,分别显著高于自然演替地和补播无芒雀麦草地(P<0.05)。不同植被恢复方式对土壤真菌的多样性产生了显著影响。
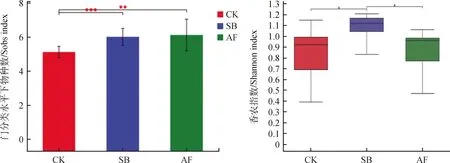
图7 真菌多样性指数(Sobs指数、Shannon指数)Fig.7 T-test for α-diversity of soil fungal community of different restoration approaches
2.5.2真菌群落组成 在门水平对不同处理间的真菌群落相对占比进行差异分析,发现球囊菌门和unclassified_k这2类真菌的差异显著,补播无芒雀麦草地要显著高于补播紫花苜蓿草地和自然演替地(P<0.01,P<0.05);担子菌门真菌占比在无芒雀麦草地略高于自然演替地与补播紫花苜蓿地,但差异不显著。
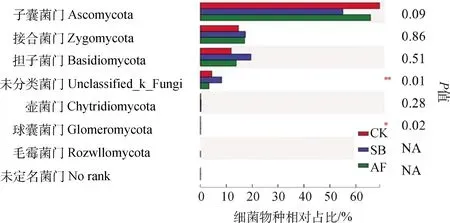
图8 真菌群落的组间差异比较Fig.8 Composition of soil bacterial community of different restoration approaches at phylum level
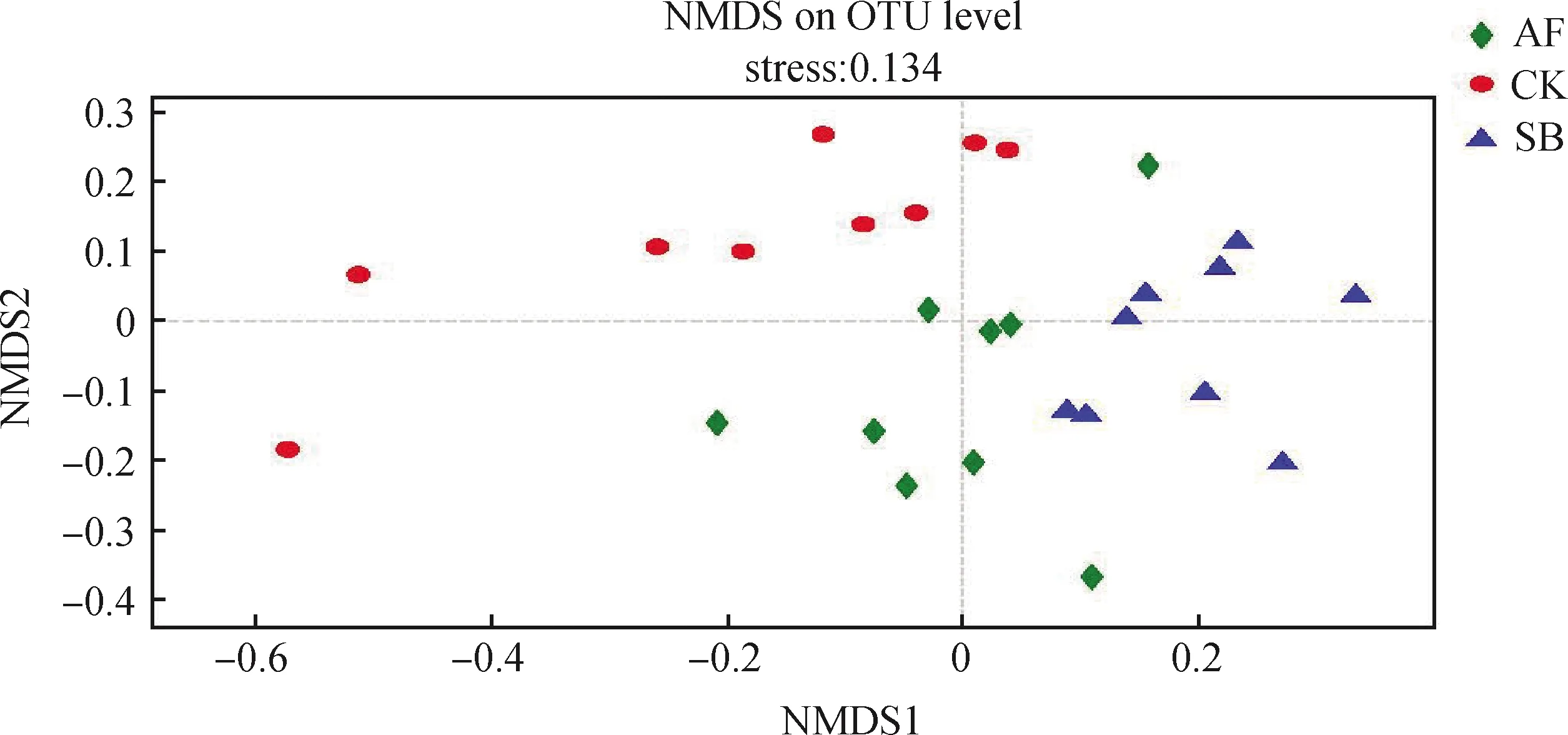
图9 NMDS分析结果Fig.9 Non-metric multidimensional scaling analysis for β-diversity of soil fungal diversity
NMDS分析结果表明3种处理间的真菌群落能够明显的区分开(stress<0.2),说明在不同植被恢复方式下,土壤真菌群落的β多样性差异显著。
3 讨论
3.1 不同恢复植被对植物多样性的影响
本研究中植物群落物种组成年际间变异较大,但补播紫花苜蓿方式中紫花苜蓿仍然为绝对优势物种。结果表明,补播的紫花苜蓿一定程度上抑制了部分一年生杂草的出现,减少了群落中物种的数量。AF草地中每个物种占有的生态位更加充分,物种分布的均匀度变高,是一种积极正向的演替,推动着群落的恢复。由于退化土地原生植被主要以依赖种子库繁殖的一年生杂类草为主,因此在补播无芒雀麦和紫花苜蓿草地中伴生物种的变化较大,并且在无芒雀麦处理中,无芒雀麦出现了衰退的迹象,其重要值下降了59.5%,这可能是因为无芒雀麦对所在地块的水分含量和土壤全氮含量要求较高,在不进行人工干预的条件下,会出现一定程度的自疏现象[10,27]。此外,3种处理间多样性差异可能是由于在无芒雀麦草地(SB)中,无芒雀麦的衰退,导致其它物种(主要是杂类草)的占比增加,一定程度上提高了SB的多样性指数。此外,在我国北方农牧交错区补播无芒雀麦恢复天然草地植被的研究中发现,其它物种的多样性显著地降低,无芒雀麦表现出很强的竞争优势[24-26]。这可能是由于无芒雀麦地下芽库的潜在更新能力,能够在一定阶段保持恢复群落的稳定[18,28-29]。紫花苜蓿由于在建植初期生长较慢,且为直根型多年生牧草,对其它功能群的影响相对较小[30-32],所以紫花苜蓿群落中一二年生的杂类草相对丰度较高。
3.2 土壤微生物群落多样性变化分析
土壤细菌和真菌群落经过5年时间的植被恢复,其群落β多样性均出现了显著地差异。说明在不同优势物种的作用下,微生物群落多样性的响应变化不一,不同物种可能会影响形成不同的微生物群落,并且这种作用通过影响微生物的物种组成和相对丰度表现出来。这与近年来土壤微生物多样性与植物相关关系的研究结果相一致,微生物多样性主要受到地上植物轮作或某种优势物种的调控[33-35]。微生物对地上植被变化的响应也主要表现为某一物种的相对丰度变化,而不是物种多样性的变化[36-37]。此外,本研究中研究地块相对集中且采用了区组随机设计,土壤异质性的影响相对较小,结果能够较为真实的反应生物因素(即不同恢复植被)对地下微生物群落的影响。紫花苜蓿和无芒雀麦草地由于草地枯落物的增加,土壤真菌的反应敏感,表现出真菌多样性和物种数量的明显差异;相比于自然演替恢复地真菌中球囊酶属的占比显著提升,说明紫花苜蓿和无芒雀麦补播建植后,通过一定时间的恢复演替,各自产生了不同的枯落物积累,对地下真菌群落产生了显著影响[21,38],尤其是无芒雀麦草地中球囊酶属真菌显著高于其它恢复模式,这可能与无芒雀麦能够形成特异性的丛枝菌根真菌,加速地下部分养分传递有密切关系[22,39]。
4 结论
本研究发现在北京浅山区退化草地中,经过建植无芒雀麦和紫花苜蓿人工草地,土壤微生物量碳、氮含量在植被恢复后显著高于植被自然演替地;不同植被恢复群落间的土壤细菌和真菌群落的β多样性有显著差异。无芒雀麦草地的植物多样性显著低于紫花苜蓿草地和对照,但其真菌和细菌的α多样性差异并不显著。本研究结果说明了植被恢复对土壤微生物群落产生了显著地影响,土壤细菌和真菌多样性对不同优势植物的响应不同。

