模拟氮沉降对高寒湿地土壤理化性质和酶活性的影响
黄瑞灵, 王西文, 马国虎, 朱锦福*, 周华坤
(1. 青海师范大学青海省自然地理与环境过程重点实验室, 青海 西宁 810008; 2. 开封市祥符区农业农村局, 河南 开封 475000;3.中国科学院西北高原生物研究所青海省寒区恢复生态学重点实验室, 青海 西宁 810008)
在过去几十年中,化石燃料的大量燃烧、工业生产废气的排放和氮肥的大量使用,导致土壤和大气中的氮素含量急剧增长[1-3]。氮沉降增加影响微生物对有机质和凋落物的分解、有机质的矿化及腐殖质形成,进而引起土壤理化性质、土壤微生物群落结构与功能以及土壤酶活性改变,最终改变生态系统的物质循环[4-5]。土壤酶作为土壤生态系统的重要组成成分,参与许多重要的土壤生物化学过程和物质循环、腐殖质的合成与分解以及有机化合物的分解,促进植物和土壤微生物生长繁殖,其活性反映了土壤生物化学过程的方向和强度,能够敏感指示土壤生境的细微变化,在土壤生物化学过程中扮演着重要的角色,并可作为土壤养分含量预测的指示性指标[6]。
土壤酶活性受众多因素影响,氮沉降是影响土壤酶活性的重要环境因子之一[7]。随着氮沉降增加日益严重,极有可能对土壤酶系统造成复杂的影响,从而影响土壤生态系统,进而影响土壤系统的碳氮循环。诸多研究表明,土壤酶作为土壤的敏感型指标,模拟氮沉降对其活性的影响非常明显,但基于所处生态系统的不同,土壤酶活性对模拟氮沉降的响应也有所差异。刘星等在油松林中进行的氮添加研究发现,氮沉降促进脲酶活性,抑制过氧化物酶和多酚氧化酶的活性[8];吴建波等在高寒草原进行的氮添加研究表明,氮沉降提高脲酶和磷酸酶活性,降低多酚氧化酶和过氧化氢酶活性[9];而刘红梅等在温带草原中进行的氮添加研究表明,各氮沉降处理均降低了脲酶、酸性磷酸酶和过氧化氢酶的活性[10]。这些结果表明,土壤酶活性因生态系统、氮添加量及添加时间等因素而异。
青海湖位于青藏高原的东北部,是我国西北干旱区、西南高寒区和东部季风区的交汇区,青海湖是青藏高原生态的重要水体,并对整个青海西部沙漠化起到屏障保护作用,是维系青藏高原东北部生态安全的重要屏障,备受国内外研究者的关注[11-13]。近年来,学者们对青海湖高寒草原生态系统多样性[14]、高寒草地生态系统对气候变化的特征[15]、气候变化下的湿地演变[16]等领域开展了诸多研究。因氮沉降急剧升高而对全球生态系统产生重要影响[17],已有诸多关于氮添加或氮沉降对荒漠草原[18]、农田[19]、森林[20]、滨海湿地[21]等生态系统影响的研究。然而氮沉降对青海湖高寒湿地生态系统土壤理化性质和土壤酶活性产生哪些影响,我们的了解还很有限[22]。因此,本文选取青海湖东岸高寒湿地为研究对象,通过野外模拟氮沉降试验,研究土壤酶活性和土壤理化性质对氮沉降的响应规律,为政府部门的湿地生态系统管理提供决策依据。
1 材料与方法
1.1 研究区概况
青海湖东岸高寒湿地(36°41′~36°42′N,100°45′~100°47′E),是青海湖水位下降遗留下来的高寒沼泽化湿地,平均海拔在3 200 m左右,具有典型的高原大陆性气候,光照充足,雨量较少,降水主要集中于6—9月,多年平均降水量370 mm左右[23];土壤为水成性阴育性土壤,以沼泽土和草甸土为主[24]。研究区主要植物为华扁穗草(Blysmussinocompressus)、禾叶嵩草(Kobresiagraminifolia)、藏嵩草(K.tibetica) 小嵩草(K.humilis)和苔草(Carexarenaria)等[25]。
1.2 研究方法
1.2.1试验设计 根据祁连山海北高寒草甸生态系统大气氮沉降动态变化特征的数据[26]以及未来氮沉降持续增加的预期[27],本研究于2020年在青海湖东岸高寒湿地设置12个2 m×1 m样地,样方间隔25 m。设置4个氮梯度处理,施氮水平分别为0 g·m-2,2 g·m-2,5 g·m-2,10 g·m-2,分别用N0(对照),N2,N5,N10表示。采用田间随机区组设计,每个处理3次重复。氮肥形态为NH4NO3,分别于5—9月初按照处理水平的要求,将每个样方每次所需喷施的NH4NO3溶解于1 000 mL水中,用喷雾器人工均匀喷施于样地,对照喷施等量的水。
1.2.2土壤样品采集 土壤样品采集于2020年10月中旬进行。用螺旋取土钻在每块样方中采集浅层0~15 cm和深层15~30 cm深度的土样样品,土样放入无菌自封袋中,约400 g左右,迅速带回实验室,部分土样4℃冰箱保存,用于测定无机氮含量,另外的土样在室内自然风干,磨碎过筛后测定土壤理化性质及酶活性。
1.2.3样品测定 土壤有机碳含量用总有机碳分析仪(Elementa,Germany)测定;土壤全氮含量采用意大利NC Technologies公司Costech ESC 4024元素分析仪测定;土壤全磷含量采用硫酸-高氯酸酸溶钼锑抗比色法测定;土壤铵态氮、硝态氮含量采用全自动间断化学分析仪(CleverChem)测定。
土壤脲酶活性采用S-UE(A630)活性检测试剂盒-分光光度法测定;过氧化氢酶活性采用S-CAT(A240)活性检测试剂盒-紫外分光光度法测定;碱性蛋白酶活性采用S-ALPT(A680)活性检测试剂盒-可见分光光度法测定;土壤酸性磷酸酶活性采用pH为5的醋酸溶液测定。
1.2.4数据处理 采用IBM SPSS 19.0 软件对数据进行统计与分析,图表采用Office 2010进行绘制。方差分析用来揭示土壤理化性质与酶活性之间的差异性,相关分析用来度量土壤理化性质和酶活性之间的相关关系,逐步回归模型用来探索土壤酶活性与土壤理化性质间的关系。
2 结果与分析
2.1 施氮对土壤理化性质的影响
从表1可以看出,土壤理化性质对施氮的响应不同。随着施氮量的提高,施氮处理组浅层和深层土壤的pH值有小幅度波动,但范围较小,且与对照比较差异并不显著。氮添加显著影响了土壤有机碳含量,总体含量表现为N2>N5>N0>N10,土壤有机碳含量在N2处理下达到最高,其浅层和深层土壤有机碳含量分别比N0增加了57.43 g·kg-1和36.93 g·kg-1,与N0,N5及N10存在显著差异(P<0.05)。随着施氮浓度升高,土壤全磷含量有所改变但并不规律,不同处理同一深度土层间以及同一处理不同深度土层间均没有显著差异。
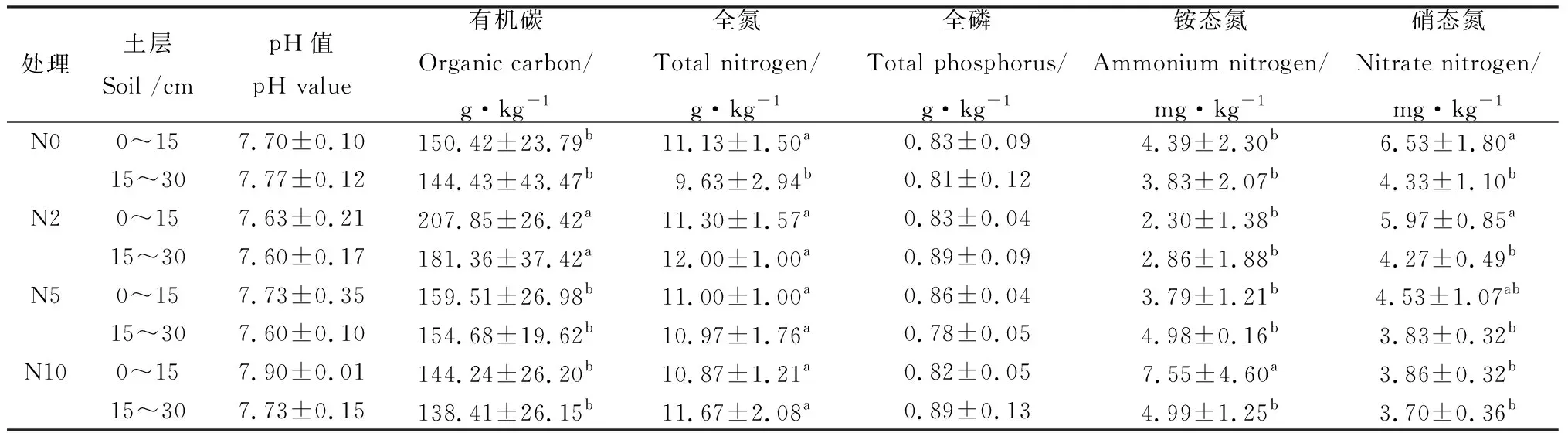
表1 不同氮沉降处理不同土层土壤理化性质Table 1 The difference of soil property in difference simulated nitrogen deposition treatment
氮添加后各处理浅层土壤中全氮含量为N2>N0>N5>N10,各处理与对照相比均无显著差异,表明浅层土壤对氮添加不敏感;深层土壤全氮表现为N2>N10>N5>N0,各处理全氮含量均显著高于对照(P<0.05),表明氮添加可显著提高深层土壤全氮含量。
在不同施氮处理的土壤中,铵态氮在浅层土壤中含量为N10>N0>N5>N2,仅N10处理下在浅层土壤中达到7.55 mg·kg-1,显著高于对照及其它各处理;深层土壤铵态氮含量为N10>N5>N0>N2,各处理与对照无显著差异;硝态氮含量随氮添加浓度上升而逐渐下降,浅层土壤中N0硝态氮含量显著高于N10处理,而深层土壤中,对照及各处理间的硝态氮含量无显著差异。
2.2 氮沉降对土壤酶活性的影响
由图1可知,土壤酶活性在不同施氮梯度及不同土层深度的变化有一定的差异。酸性磷酸酶活性均表现为浅层土壤高于深层土壤,随着施氮量的增加,酸性磷酸酶活性由大到小表现为N10>N0>N5>N2,其中,N10处理酸性磷酸酶活性最大且与其它施氮处理和对照差异显著(P<0.05)(图1a)。
施氮肥提高了浅层土壤脲酶活性,N10处理中脲酶活性最高,显著高于N2,N5和N0处理,且差异显著(P<0.05);深层土壤脲酶活性随施氮量增加呈先减少后递增趋势,脲酶活性在N10处理中最高,与N0,N2和N5差异显著(P<0.05)(图1b)。
浅层土壤碱性蛋白酶活性随着氮沉降的增加呈“N”型,表现为先增加后降低再增加的趋势,各处理间差异不显著;深层土壤碱性蛋白酶则呈倒“V”型,随着施氮量的增加呈先增加后减少趋势。N2处理下土壤碱性蛋白酶活性最高,但各处理间差异均不显著(图1c)。
氮沉降对过氧化氢酶活性有抑制作用,在0~15 cm土层中,酶活性随浓度上升呈下降趋势,对照过氧化氢酶活性显著高于各施氮处理组,但N2,N5和N10处理间差异不显著;在15~30 cm土层中,酶活性随施氮量增加呈降低趋势,对照与N2比较差异不显著,N5和N10间无差异,但显著低于对照及N2(P<0.05)(图1d)。

图1 不同氮沉降处理不同土层土壤酶活性特征Fig.1 The characteristics of soil enzyme activities in different nitrogen deposition treatments and layers
在同一浓度处理下,酸性磷酸酶和脲酶活性随施氮量增加呈增加趋势,碱性蛋白酶无明显变化规律,过氧化氢酶活性随施氮量增加而降低。同一施氮水平下,酸性磷酸酶、碱性蛋白酶和过氧化氢酶活性表现为浅层土壤高于深层土壤。
2.3 土壤酶活性与土壤理化性质的关系
由表2可知,土壤pH值、全磷含量、全氮含量与土壤酶活性均无显著相关性。脲酶、酸性磷酸酶活性与铵态氮含量显著正相关(P<0.05),其相关系数分别为0.772和0.745;碱性蛋白酶活性与有机碳含量极显著正相关(P<0.01),与铵态氮含量负相关,但相关性不显著;过氧化氢酶活性与硝态氮含量显著正相关(P<0.05),其相关系数为0.732。整体来看,土壤理化性质与酶活性存在显著的相关关系。
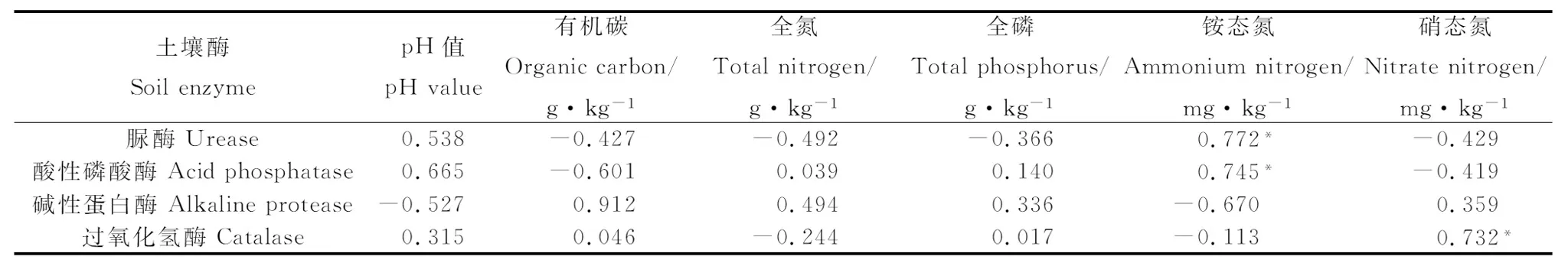
表2 土壤酶活性与土壤理化性质的相关关系Table 2 The relationship between soil enzyme activity and soil property
从研究结果中可以得出,土壤酶活性与土壤理化性质间存在一定相关性,使用逐步回归分析进一步对土壤酶活性与土壤理化性质建立回归模型,模型结果见表3。模型结果显示速效钾、铵态氮和速效磷含量是影响土壤脲酶活性的重要因子,其中铵态氮和速效磷是影响脲酶活性最大的因子;速效钾、全磷、速效磷、有机质、铵态氮和硝态氮是影响酸性磷酸酶的重要因子,其中全磷和硝态氮是影响土壤酸性磷酸酶的最大因子;水分、pH值、全磷、全钾和速效钾是影响碱性蛋白酶活性的重要因子,其中pH和全磷是影响最大的因子;水分、pH值、速效氮、速效磷和铵态氮是影响过氧化氢酶活性的重要因子,其中pH值、速效磷和铵态氮是影响最大的因子。

表3 土壤酶活性与土壤性质的逐步回归模型Table 3 Liner modeling about soil enzyme and soil property
3 讨论
3.1 氮沉降对土壤理化性质的影响
本研究中,施氮后引起土壤酸碱度下降,但降低幅度与对照相比差异不显著,这可能与施氮时间短、施氮量小有关,也可能与样地地下水位较高,加之土壤本身呈弱碱性,缓冲了施氮后对土壤酸碱度的影响有关。在温带草地的施氮研究结果表明[28-29],土壤pH值显著降低与施氮量和施氮后的年限有关,土壤pH值的降幅随土壤深度的增加而降低。
土壤有机碳是土壤的重要组分,在土壤功能和生态系统价值中发挥重要作用,影响全球碳循环。已有的研究表明,施氮对土壤有机碳的影响与施氮类型、施氮量以及持续时间等相关。刘永万等[30]研究表明,随着施氮量的增加,土壤有机碳含量存在上升的趋势。在本研究中,土壤有机碳含量随氮添加的增加呈先上升后逐渐下降的趋势,有机碳含量随土层深度的加深逐渐降低,即土壤有机碳含量随土壤深度呈现递减趋势,土壤有机碳主要来自湿地植物光合产物的积累。这一结果与刘英等[13]对环青海湖高寒湿地土壤有机碳研究得出结论基本一致。
氮素是衡量土壤肥力的重要指标,通常认为氮素对植物的生长起重要作用[31]。诸多研究发现,湿地生态系统中的全氮含量存在随土层深度的加深而呈减少的趋势[32-34]。而本研究发现,全氮含量在浅层土壤中各处理与对照间无显著差异,此结果与向雪梅等的研究结果一致[35];深层土壤全氮含量均显著高于对照,这可能是因为氮添加后促进了植物的同化作用,从而增加了深层土壤中全氮含量。
本研究中的土壤铵态氮含量在N10处理中显著增加,随着氮沉降增加,微生物的硝化作用增强,使土壤中铵态氮含量增多。土壤中铵态氮含量与氮添加量密切相关,施氮量越高,湿地土壤中铵态氮含量也就越高,这一结果与已有的研究相吻合[36-37]。硝态氮含量依外源氮添加的增加而逐渐减少,浅层土壤中高于深层土壤,一方面可能是由于随着土层深度的增加,地下水位交替变化,导致硝态氮下渗和损失;另一方面植物通过根系优先吸收利用硝态氮,促进植物生长并吸收更多硝态氮,从而加速消耗深层土壤中的硝态氮,使湿地土壤氮添加后反而降低了土壤中硝态氮含量,这与刘高军等[38]等的研究类似。
氮添加后土壤全磷含量在各处理的不同深度土壤中并无显著变化,这可能与施加的氮肥种类有关,此结果与陈林等[39]研究结果吻合。
3.2 氮沉降对土壤酶活性的影响
土壤的养分循环情况可通过与碳、氮循环相关的土壤酶活性变化得以反映,且因酶的敏感性,微小的环境变化就可引发酶活性的改变。氮沉降改变土壤有效氮含量后,可缓解土壤微生物受氮素限制的状况,反而受限于碳素含量及对其的摄取,进而改变微生物区系组成和丰富度。此外,氮添加也可能影响土壤中难降解物质的分解转化,土壤养分浓度发生改变后,反过来又影响了土壤酶的活性[40]。
本研究结果表明,随着氮添加含量的增加,土壤酸性磷酸酶活性存在升高的趋势,且N10显著高于对照和其它处理,说明施氮提高酸性磷酸酶活性,其促进作用与施氮多少有关,施氮量越大则酶活性越高。土壤脲酶活性与土壤中氮素循环有关,脲酶活性随氮沉降增加而提高,与已有的研究[41-42]结果基本一致。
土壤有效氮含量因外源氮添加而增加,由此刺激微生物分泌脲酶以分解有机物来满足菌体生长的需求。另外,施氮也可能提升了脲酶的底物浓度,正向反馈提升了其活性。
过氧化氢酶是广泛存在于细胞内的一类防御性质的酶,通过分解过氧化氢达到降低其对细胞的伤害的作用[43]。本研究结果显示,氮添加均降低了浅层土壤中过氧化氢酶的活性,深层(15~30 cm)土壤中过氧化氢酶活性低于浅层,可能源自高寒湿地土壤透气性差,在缺氧环境中过氧化氢含量随之降低,进而减少了过氧化氢酶的生成。
土壤碱性蛋白酶活性与土壤中氮素营养的转化状况有极其重要的关系,在土壤中的分布具有明显的层次性[44]。而在本研究中,碱性蛋白酶活性与施氮量之间并无显著相关性,土壤中蛋白酶活性有所变化但并不规律,深层土壤中蛋白酶活性随施氮量增加呈先上升后下降趋势,这与郑洪元等[45]研究结果不同,表明高寒湿地土壤中碱性蛋白酶的变化规律需要进一步的研究。
3.3 土壤酶与土壤理化性质的关系
施氮会导致土壤中的碳、氮、磷含量及酶活性发生变化,外源氮添加改变了土壤养分状态及微生物活性,间接地提高了土壤酶活性[46]。本研究中的脲酶活性、酸性磷酸酶活性与铵态氮呈现显著正相关关系,表明氮的添加影响了脲酶和酸性磷酸酶的活性,这与沈芳芳等人[47]的研究结论一致,说明氮添加影响了氮和碳的循环过程,同时促进了植物分解。
碱性蛋白酶是在碱性条件下(pH 9.0~11.0)水解蛋白质肽键的酶[48],其最适反应pH值为10.5[49]。在本研究中,试验环境pH呈弱碱性,在氮添加后各处理土壤pH与对照比较并无显著差异,因此对酶活性影响不大;碱性蛋白酶活性含量与有机碳活性含量呈极显著正相关,N2处理下有机碳含量显著高于对照及其它处理,碱性蛋白酶活性也达到最高,但与对照及其它处理比较差异不显著,氮添加并未显著提高碱性蛋白酶活性,这可能与湿地弱碱性环境有关。湿地土壤中碱性蛋白酶活性与土壤理化性质之间的关系还需深入研究。
过氧化氢酶活性与硝态氮含量显著正相关,与宋学贵等[50]的研究相吻合,这可能是氮添加后铵态氮的淋失改变了土壤的理化性质和微生物组成,最终改变了微生物对底物的利用,抑制了过氧化氢酶活性。
综上可以看出,氮添加影响高原湿地生态系统的物质循环过程,且氮添加的过程对不同酶活性具有差异性。而对影响酶活性的因子进行探索时,发现土壤全碳、氮含量是影响土壤酶活性的主要因子,而全磷含量对4种酶活性的影响无显著差异。
4 结论
在青海湖高寒湿地通过氮添加方式研究土壤理化性质与酶活性之间的关系,结果表明:土壤硝态氮和有机碳含量随施氮梯度上升逐渐降低;脲酶活性、酸性磷酸酶活性与铵态氮含量显著正相关,过氧化氢酶活性与硝态氮含量呈显著正相关,碱性蛋白酶活性与土壤有机碳含量呈极显著正相关;4种酶活性对氮沉降的响应有差异,土壤全碳和氮含量是影响土壤酶活性的主要因素。

