高效液相色谱-串联质谱法检测猪可食性组织中加米霉素残留
李伟岭 , 范小平 , 杨 芳 , 刘 波 , 岳永波 , 吴鹏飞 , 罗 妍 , 赵 盼 , 王金阳
(1.保定冀中药业有限公司 , 河北 保定 071500 ; 2.石家庄冀中药业有限公司 , 河北 石家庄 050066 ;3.海南省动物疫病预防控制中心 , 海南 海口 571100)
加米霉素(Gamithromycin)是新一代半合成、十五元氮杂大环内酯类动物专用抗菌药,由法国梅里亚(Merial)开发成兽用注射液(商品名Zactran®),用于防治溶血性曼氏杆菌、多杀性巴氏杆菌和睡眠嗜组织菌引起的牛呼吸系统疾病,由胸膜肺炎放线杆菌、多杀性巴氏杆菌和猪嗜血杆菌引起的猪呼吸系统疾病,以及由恶性节瘤偶蹄形菌和坏死梭杆菌引起的绵羊腐蹄病[1-5]。加米霉素具有抗菌活性强、抗菌谱广、吸收迅速、生物利用度高等优点,在兽医临床具有广泛的应用前景[6-15]。为了保障动物源性食品安全与维护人体健康,兽药残留问题已成为关注的焦点。动物源性食品中兽药残留检测方法有高效液相色谱法(HLPC)、高效液相色谱-串联质谱法(HPLC-MS/MS)、超高效液相色谱-串联质谱法(UPLC-MS/MS)等[16-17]。本试验建立了一种可靠、灵敏的检测猪可食性组织中加米霉素残留量的高效液相色谱-串联质谱分析方法。
1 材料与方法
1.1 仪器与设备 高效液相色谱-串联质谱仪(Waters Quattro Premier);BSA224S-CW型电子天平(Sartorius公司);5424R型高速冷冻离心机(Eppendorf公司);VORTEX2-涡旋混合器(IKA公司);CM-12型水浴氮吹仪(北京成萌伟业科技有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);Oasis MCX 3CC固相萃取柱(Waters公司)。
1.2 试剂 加米霉素(TRC公司,含量98.7%);甲醇、乙腈、正己烷均为色谱纯(Merk公司);甲酸为质谱纯(Sigma公司);乙酸、乙酸铵、氨水均为国产分析纯;水为Miili-Q级。
1.3 溶液配制 乙腈-甲醇混合溶液(70∶30,V/V):准确量取350 mL乙腈和150 mL甲醇于500 mL试剂瓶中,混匀,备用。5%氨化乙腈-甲醇混合溶液(70∶30,V/V):移取5 mL氨水于95 mL乙腈-甲醇混合溶液(70∶30,V/V)中,混匀。0.1 mol/L乙酸铵溶液:称取7.7 g乙酸铵,用1 L水溶解,乙酸调节pH至4.5。10 mmol/L乙酸铵溶液:准确称取0.77 g乙酸铵溶于1 L水中,乙酸调节pH至3.6。乙腈饱和正己烷:将乙腈和正己烷按1∶1比例混合即可。加米霉素标准储备液(1 mg/mL):精密称取加米霉素标准品10.2 mg于10 mL量瓶中,用乙腈溶解并稀释至刻度,摇匀,置于-20 ℃冰箱中保存。加米霉素标准工作液(10 μg/mL):精密量取0.1 mL加米霉素标准储备液于10 mL量瓶中,用乙腈稀释至刻度,摇匀,置于4 ℃保存。
1.4 试料的制备与保存 取适量新鲜或解冻的空白或供试组织均质;取均质的供试样品作为供试试料,取均质的空白样品作为空白试料;取均质的空白样品,添加适宜浓度的标准工作液,作为空白添加试料。试料均于-20 ℃保存。
1.5 样品提取 准确称取(2.0±0.02) g试料于50 mL离心管中,加入乙腈6 mL,涡旋混合器涡旋5 min,超声提取10 min,12 000 r/min离心10 min,将上清液转移至50 mL离心管中,残渣加入6 mL乙腈重复上述操作1次,合并上清液,加入5 mL乙腈饱和正己烷去脂,涡旋混合器涡旋3 min,12 000 r/min离心5 min,除去上层有机层,下层为备用液,待净化。
1.6 样品净化 Oasis MCX 3CC固相萃取柱依次用3 mL甲醇和3 mL 0.1 mol/L乙酸铵(pH=4.5)活化后,将备用液全部过柱,待备用液全部流出后,依次用6 mL 0.1 mol/L乙酸铵(pH=4.5)、6 mL乙腈-甲醇(70∶30)混合溶液淋洗,抽干,用5 mL 5%氨化乙腈-甲醇混合溶液洗脱,抽干,洗脱液用氮气吹干。残余物用2 mL初始流动相复溶,12 000 r/min离心5 min,经0.22 μm有机滤膜过滤,供液相色谱-串联质谱仪测定。
1.7 色谱条件 色谱柱:Kinetex C18(50 mm×2.1 mm,2.6 μm,100 Å,Phenomenex);流动相:0.1%甲酸水溶液-0.1%甲酸乙腈溶液,梯度洗脱,洗脱程序见表1;流速:0.4 mL/min;柱温:25 ℃;进样体积:2 μL。
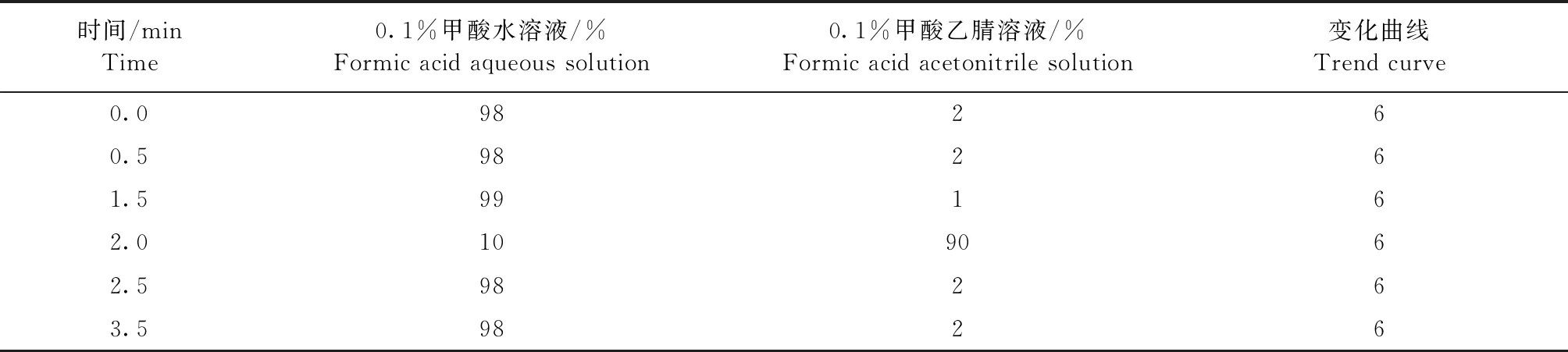
表1 梯度洗脱条件
1.8 质谱条件 离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测方式:多反应监测;离子源温度:140 ℃;毛细管电压:3.0 kV;雾化温度:350 ℃;雾化气流速:900 L/h;定性、定量离子对及锥孔电压、碰撞能量见表2。

表2 定性、定量离子对与锥孔电压、碰撞能量
1.9 基质匹配标准曲线的测定 取6份空白样品,经提取、净化后,精密量取适量加米霉素标准工作液,加入到空白基质,制得5、10、50、100、500 ng/mL和1 000 ng/mL系列基质添加浓度,经0.22 μm有机滤膜过滤后供液相色谱-串联质谱仪测定,每个浓度重复测定3次。以加米霉素特征离子质量色谱峰面积为纵坐标,对应浓度为横坐标,绘制标准曲线,求回归方程和相关系数。
1.10 检测限与定量限 在4种空白组织(猪肌肉、肝脏、肾脏和脂肪)中分别添加系列不同浓度的加米霉素,分别制得1~10 μg/kg添加浓度的试料,经提取、净化后测定。加米霉素特征离子色谱峰的信噪比S/N≥10时的添加浓度为定量限(LOQ),信噪比S/N≥3时的添加浓度为检测限(LOD)。
1.11 准确度与精密度 对猪肌肉、肝脏、肾脏和脂肪分别在LOQ、0.5最大残留限量(MRL)、MRL和2MRL进行添加回收试验。欧洲药品管理局规定猪肌肉、猪脂肪和猪肝脏的MRL为100 μg/kg,猪肾脏的MRL为300 μg/kg[3]。在空白组织中添加加米霉素,使猪肌肉、脂肪和肝脏的药物浓度为5、50、100 μg/kg和200 μg/kg,猪肾脏中药物浓度为5、150、300 μg/kg和600 μg/kg,每种组织每个浓度3个批次,每个批次同一浓度做5次平行试验,检查方法的准确度与精密度。
2 结果
2.1 基质匹配标准曲线 加米霉素标准溶液在肌肉、肝脏、脂肪和肾脏的基质匹配曲线的线性范围为5~1 000 μg/kg,相关系数>0.99,4种组织的基质匹配标准曲线见表3。
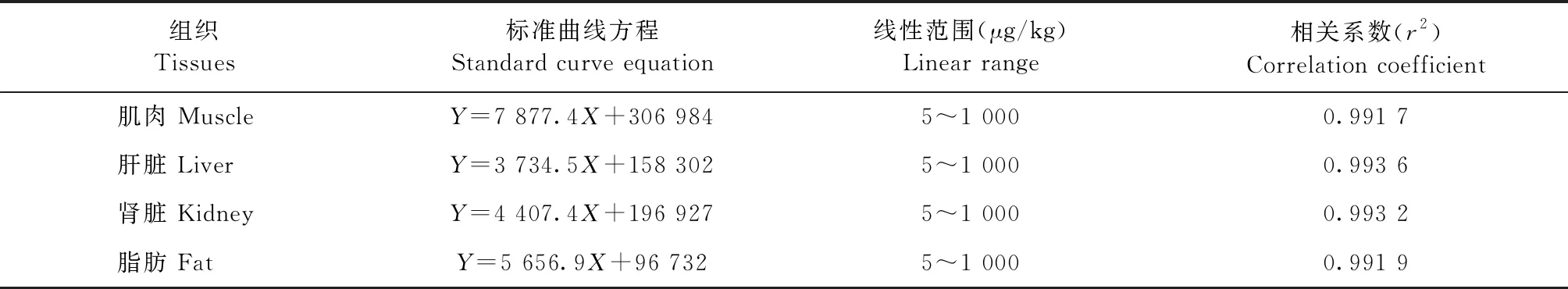
表3 加米霉素基质匹配标准曲线
2.2 检测限与定量限 加米霉素在猪肌肉、肝脏、肾脏和脂肪中的残留检测限均为3 μg/kg,其残留定量限均为5 μg/kg。
2.3 准确度与精密度 各组织样品的回收率试验结果见表4和表5,加米霉素在猪肌肉、肝脏、脂肪和肾脏可食性组织中的平均回收率为66.69%~90.75%;变异系数结果见表6和表7,批间变异系数≤11.94%,符合兽药残留检测标准要求。
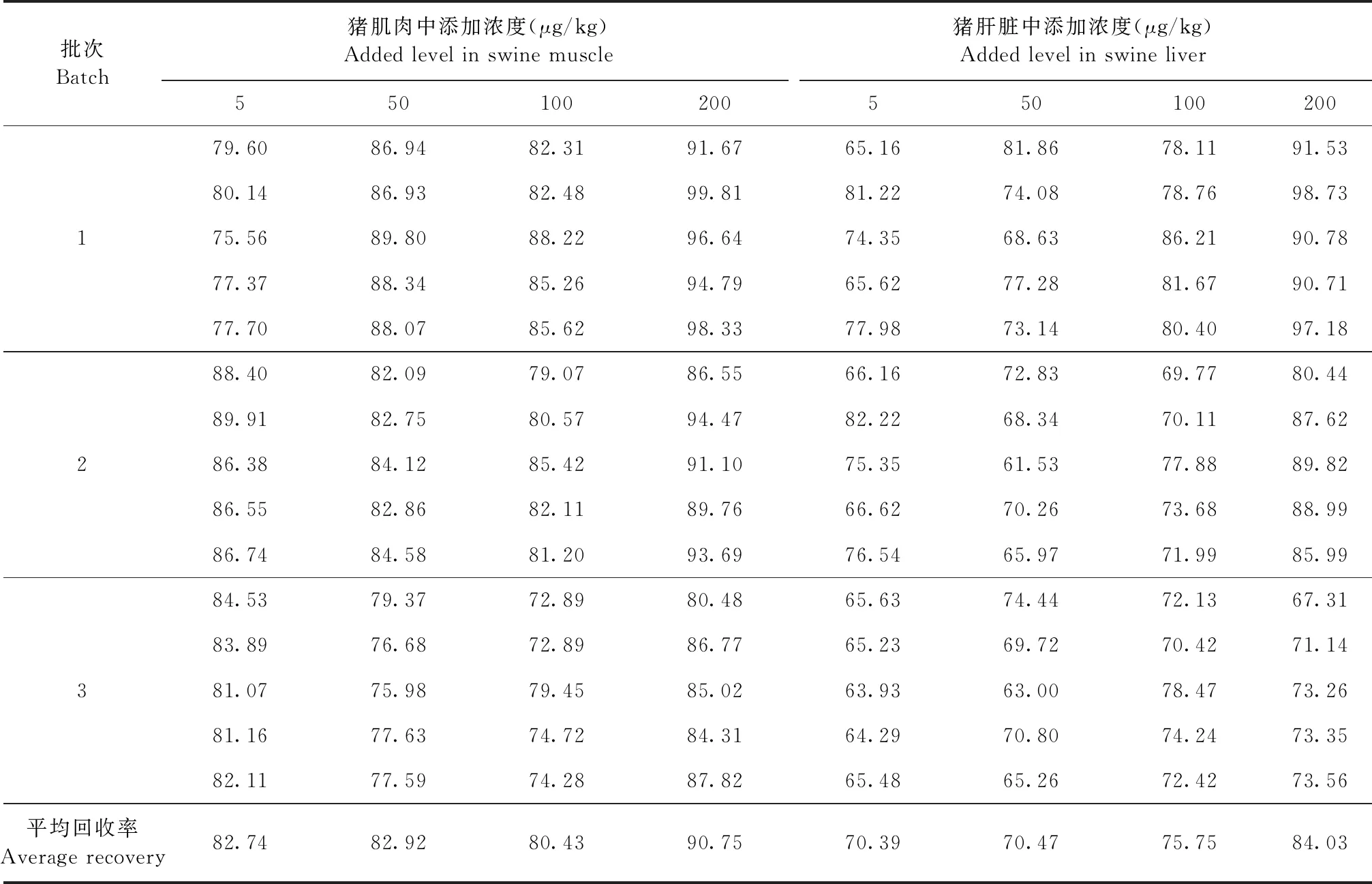
表4 猪肌肉和猪肝脏中加米霉素的回收率
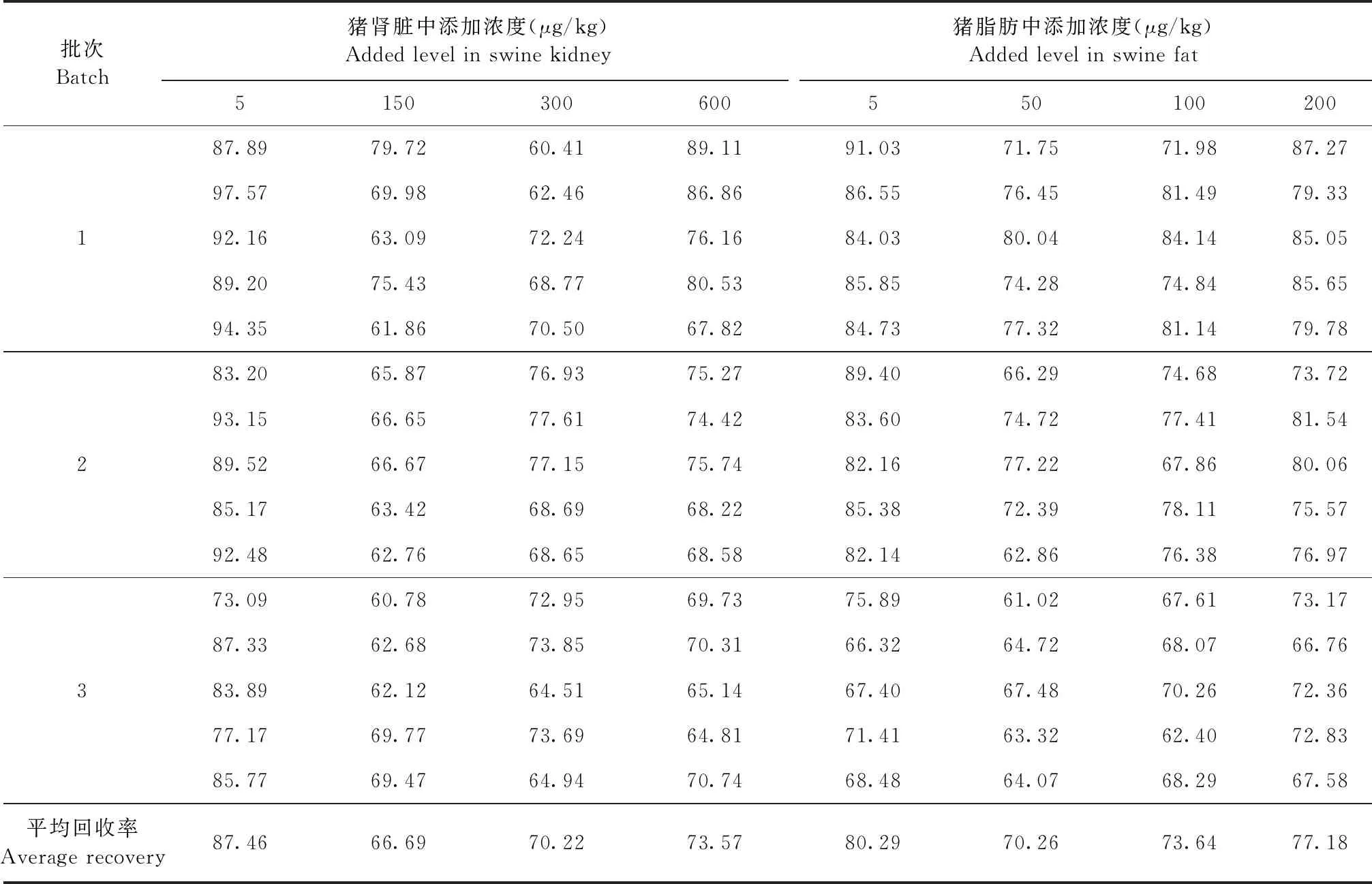
表5 猪肾脏和猪脂肪中加米霉素的回收率
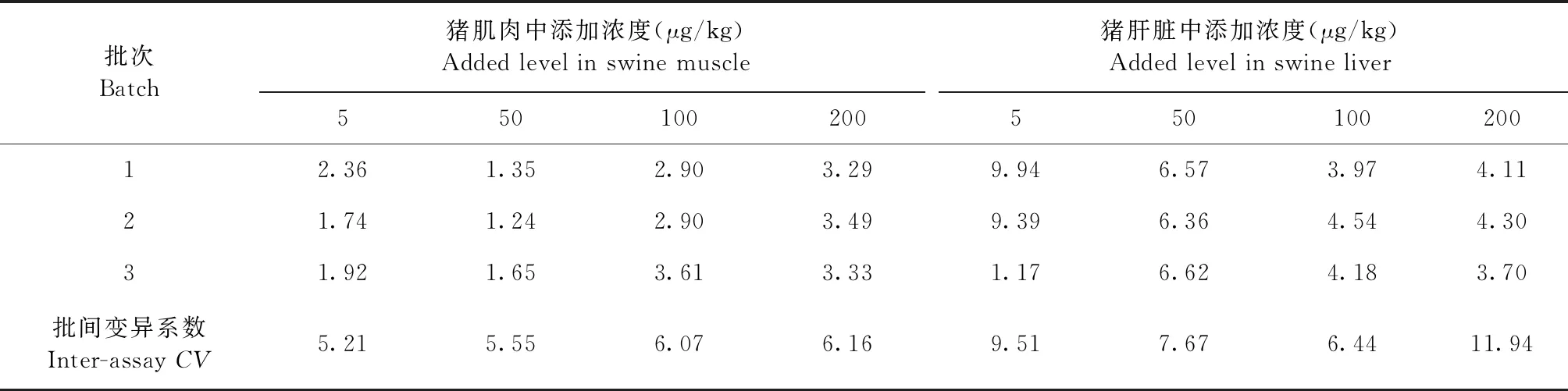
表6 猪肌肉和猪肝脏中加米霉素的变异系数
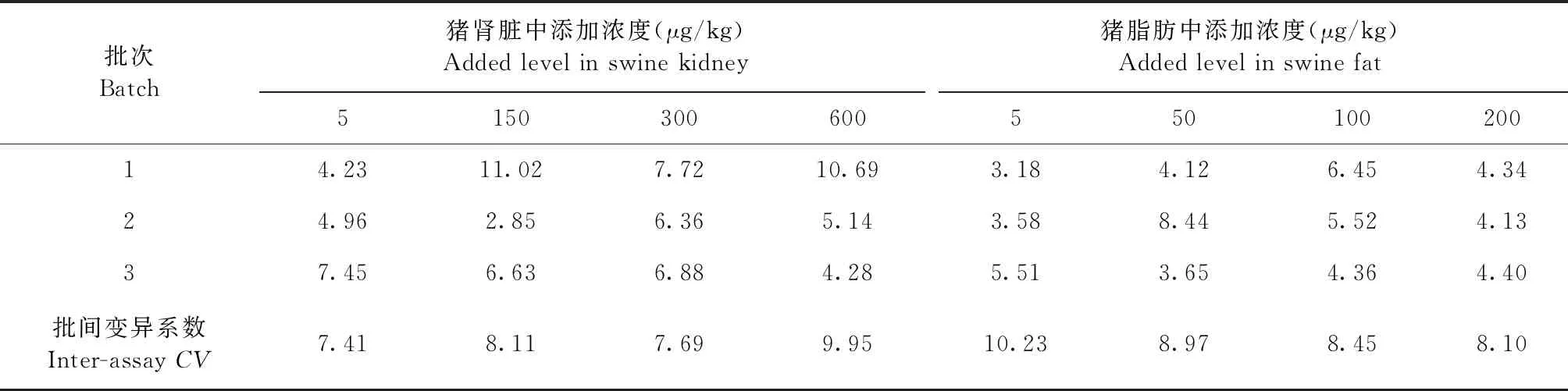
表7 猪肾脏和猪脂肪中加米霉素的变异系数
3 讨论
本试验筛选了1%甲酸乙腈溶液[18]、90%乙腈水溶液[19]和乙腈3种提取溶剂,并对其提取效果进行对比。1%甲酸乙腈溶液易将色素类杂质提取出来致使提取液颜色较深及后续净化难度增大;加米霉素为弱极性化合物,且在水中几乎不溶,90%乙腈水溶液的提取效率不及乙腈。对比3种提取溶剂的提取结果,最终采用乙腈为提取溶剂。考察了不同色谱柱[Kinetex C18(50 mm×2.1 mm,2.6 μm,100 Å,Phenomenex)和Poroshell 120 EC-C18(100 mm×2.1 mm,2.7 μm,120 Å,Agilent)]、柱温(25 ℃和30 ℃)、流速(0.2、0.3 mL/min和0.4 mL/min)和进样体积(2 μL和10 μL)的影响,结果表明本试验选用的色谱条件耐用性良好。通过优化毛细管电压(3.0 kV和5.0 kV)、雾化温度(350 ℃和325 ℃)、碰撞能量(40 eV和47 eV)等质谱参数,使用不同质谱仪(Wsters Quattro Premier和Agilent Infinity Lab)优选的定性离子对(m/z)、定量离子对(m/z)分别为777.6>158.2、777.6>619.3和777.4>157.8、777.4>619.4,可略有差异。本试验建立的测定猪肌肉、肝脏、脂肪和肾脏中加米霉素残留量的HPLC-MS/MS方法,样品处理简便、灵敏度高、线性范围广、准确可靠,可推广应用于猪可食性组织中加米霉素残留的检测。

