3种细胞穿透肽对体外转录mRNA的递送效果
王军华 , 罗画叶 , 张翠玲 , 李军伟
(青岛农业大学动物医学院 , 山东 青岛 266109)
mRNA疫苗是近年来发展的一种新型疫苗,相对于传统疫苗和DNA疫苗,mRNA疫苗具有多方面优势,包括:在胞质中自我表达;不能整合到细胞的基因组上;具有诱导细胞免疫应答的能力,制备成本低,生产周期仅需要1个月左右[1-3]。mRNA疫苗必须到达靶细胞的细胞质内才能被表达,但由于mRNA不稳定,易被细胞质中的RNA酶降解,如果直接注射裸露的mRNA进入机体,会很快被降解,达不到预期的免疫效果;如果采用物理方法递送,细胞会受到物理伤害,导致细胞死亡。因此,如何安全递送外源性的mRNA并提高其表达效率便成为近年来mRNA疫苗研究领域的热点和难点,而设计高效的递送载体成为mRNA疫苗研究的核心问题。研究发现,细胞穿透肽(Cell-penetrating peptides,CPPs)可以结合带负电荷的RNA分子,而从狂犬病病毒糖蛋白(Rabies virus glycoprotein,RVG)中提取的含有29个氨基酸残基的多肽片段是一种很有前景的细胞穿透肽,因此,本试验比较了来源于狂犬病病毒糖蛋白的细胞穿透肽RVG及其衍生物RVG9dR、RVG11dR对体外转录mRNA的递送效果。
1 材料与方法
1.1 质粒、细胞、实验动物、细胞穿透肽、主要试剂 质粒pVax1-EGFP、质粒pVax1、293T细胞由本实验室保存;7周龄BALB/c雌鼠,购自山东省实验动物中心;3种细胞穿透肽:RVG、RVG9dR、RVG11dR(序列见表1),由生工生物工程(上海)股份有限公司合成;MEGAscriptTMT7 Transcription Kit、LiCl Precipitation Solution、Lipofectamine 2000转染试剂,均购自赛默飞世尔科技公司;E.coliPoly(A) Polymerase、Vaccinia Capping System,均购自NEB(北京)有限公司;DMEM培养液、MEM培养液、胰酶、胎牛血清、非必需氨基酸(100×),均购自Gibco公司。

表1 3种细胞穿透肽序列
1.2 mRNA的体外转录 设计引物,通过PCR扩增绿色荧光蛋白mRNA(mRNA-EGFP)的体外转录模板(T7-EGFP-1F:TAATACGACTCACTATAGGGA;T7-EGFP-900R:AGGAAAGGACAGTGGGAGT),按照转录试剂盒说明书进行体外转录获得初始mRNA, 使用氯化锂(LiCl)溶液进行纯化,按照加帽加尾试剂盒说明书进行加帽加尾的修饰后再次使用LiCl进行纯化,获得能够稳定表达的mRNA-EGFP,并用Lipofectamine 2000在293T细胞上进行转染,24 h后在荧光显微镜下观察荧光表达情况,证明获得的mRNA在细胞内有功能。
1.3 凝胶阻滞试验 测定mRNA-EGFP浓度后,将1 μg mRNA-EGFP与RVG按照4∶1、2∶1、1∶1、1∶2、1∶4和 1∶8的质量比例混合;另将1 μg mRNA-EGFP与RVG9dR按照2∶1、1∶1、1∶2、1∶4、1∶8和1∶16的质量比例混合;再将1 μg mRNA-EGFP与RVG11dR按照8∶1、4∶1、2∶1、1∶1、1∶2和1∶4的质量比例混合,室温静置20 min,分别进行电泳,利用紫外凝胶成像系统观察分析结果。
1.4 细胞毒性试验 在75 cm2细胞培养瓶中培养293T细胞,待细胞长满单层时,将细胞用胰酶消化、悬浮后铺在96孔细胞培养板,每个孔加入100 μL细胞悬液,每孔的细胞密度达到4×103个/孔,将培养板放入37 ℃、5% CO2细胞培养箱中过夜培养。将3种细胞穿透肽设置相同的试验梯度,分别为0.01、0.1、1、10 μmol/L和100 μmol/L,每组重复3次;加入配制的混合液放入细胞培养箱孵育24 h;每孔加入20 μL MTT溶液,继续培养4 h;吸弃上清,每孔加入150 μL二甲基亚砜(DMSO),室温下静置20 min,使结晶物充分溶解;酶联免疫检测仪在OD490 nm处测量各孔的吸光值,利用Prism软件进行数据比较分析。
1.5 RNA酶保护试验 在6孔板内每孔平铺1×106个 293T细胞,置37 ℃、5% CO2细胞培养箱中过夜培养。试验前1 h,将6孔板内原培养液弃掉,用PBS磷酸盐缓冲液清洗293T细胞2次除去血清;每孔中加入1 mL Opti-MEM培养基,置于37 ℃细胞培养箱。取灭菌后的1.5 mL离心管6个,分别加入100 μL Opti-MEM,1~3号加入1 μg mRNA-EGFP,4~6号加入10 μg RVG、8 μg RVG9dR、6 μg RVG11dR,将1~3号对应加到4~6号离心管中,室温静置5 min后,将二者混合均匀室温静置20 min;向静置后的4~6号离心管中各加入2 μL RNase A,于37 ℃的水浴锅中温育20 min;取出6孔板,将标记为4~6号的离心管混合液加入到相应6孔板中,添加空白对照孔;培养7 h后,将Opti-MEM无血清培养基替换为正常的培养基,继续培养24 h,使用倒置荧光显微镜观察试验结果并拍照。
1.6 细胞荧光试验 在6孔板内每孔平铺1×106个 293T细胞,置37 ℃、5% CO2细胞培养箱中过夜培养。试验前1 h,将6孔板内原培养液弃掉,用磷酸盐缓冲液(PBS)清洗293T细胞2次除去血清。试验分为 3个组,第1组:RVG 8 μg、10 μg、12 μg; 第2组:RVG9dR 6 μg、8 μg、10 μg;第3组:RVG11dR 4 μg、6 μg、8 μg,各组分别转染1 μg mRNA-EGFP, 并设置1个空白对照孔,于37 ℃、5% CO2培养箱中培养7 h,将Opti-MEM无血清培养基替换为正常的培养基,继续培养24 h,在倒置荧光显微镜下观察绿色荧光情况并拍照。
2 结果
2.1 凝胶阻滞试验 3种细胞穿透肽RVG、RVG9dR、RVG11dR分别与1 μg mRNA-EGFP以不同的比例混匀,利用紫外凝胶成像系统观察结果,如图1所示,mRNA-EGFP与RVG的最适比例为1∶8;mRNA- EGFP与RVG9dR的最适比例为1∶4;mRNA-EGFP 与RVG11dR的最适比例为1∶2。
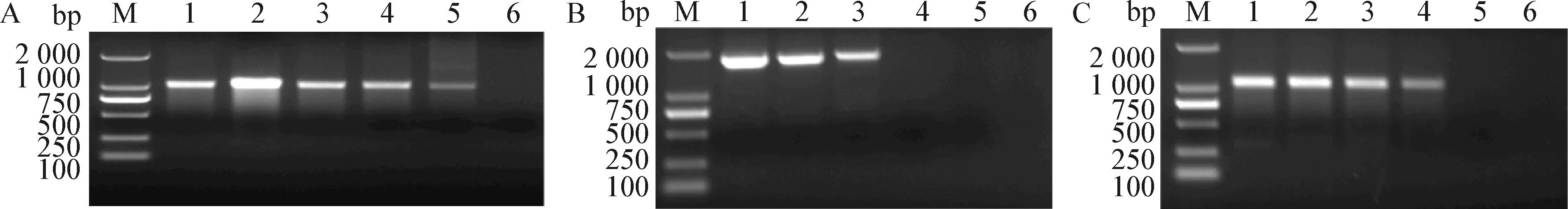
图1 3种细胞穿透肽和mRNA-EGFP的凝胶阻滞试验
2.2 细胞毒性试验 3种细胞穿透肽RVG、RVG9dR、RVG11dR对293T细胞的细胞毒性结果如图2所示,3种细胞穿透肽对293T细胞的半抑制浓度(50% inhibiting concentration, IC50)分别是95、90 μmol/L和81 μmol/L,说明在RVG的C末端添加多精氨酸可导致其细胞毒性的增加。
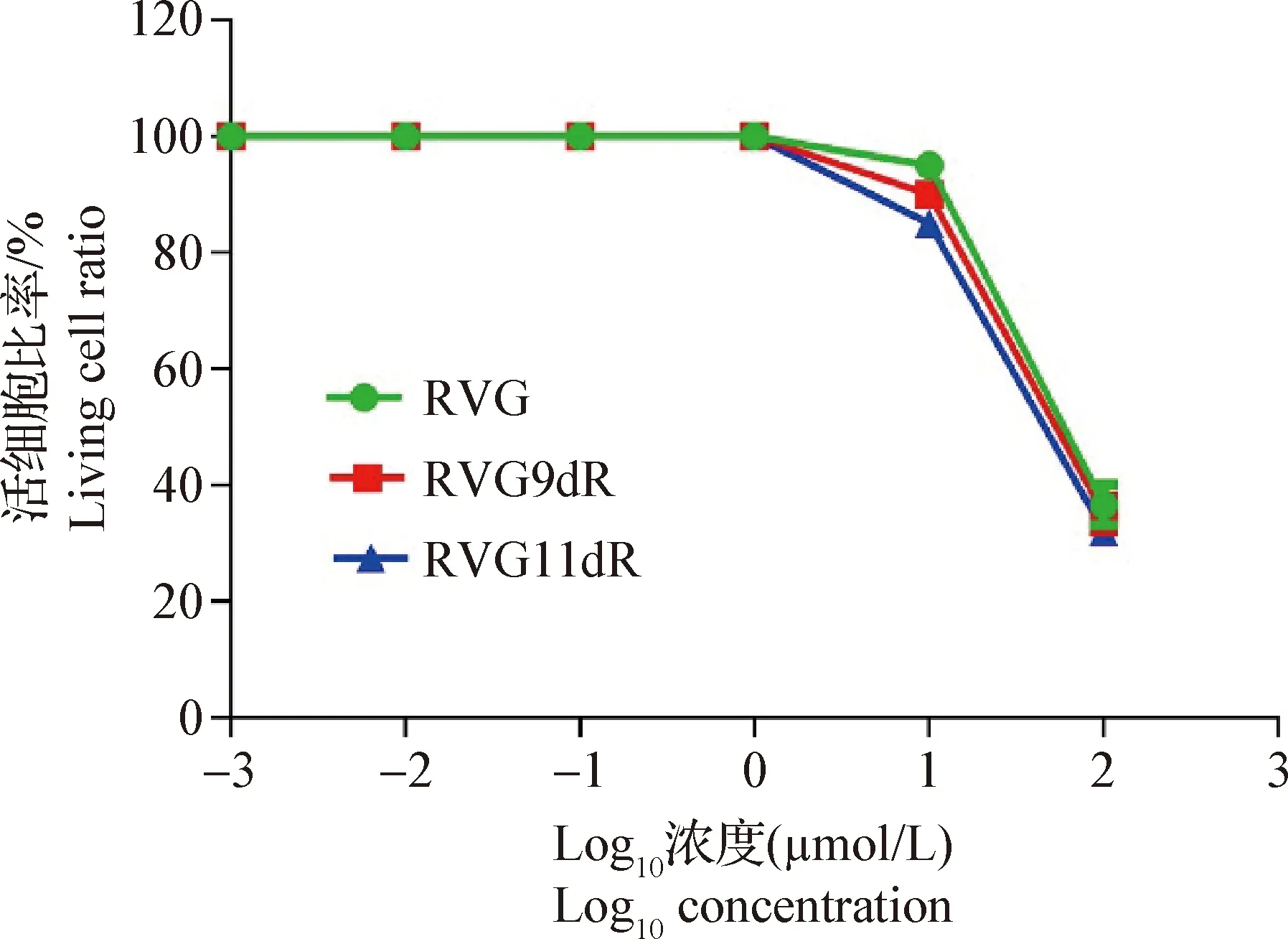
图2 RVG、RVG9dR、RVG11dR对293T细胞的细胞毒性
2.3 RNA酶保护试验 分别用RVG、RVG9dR、RVG11dR将mRNA-EGFP包被后,再与RNase A作用后转染293T细胞,24 h后在倒置荧光显微镜观察,结果如图3所示,mRNA-EGFP在细胞内都能正常表达,说明3种细胞穿透肽都能保护mRNA-EGFP不被RNA酶所降解。
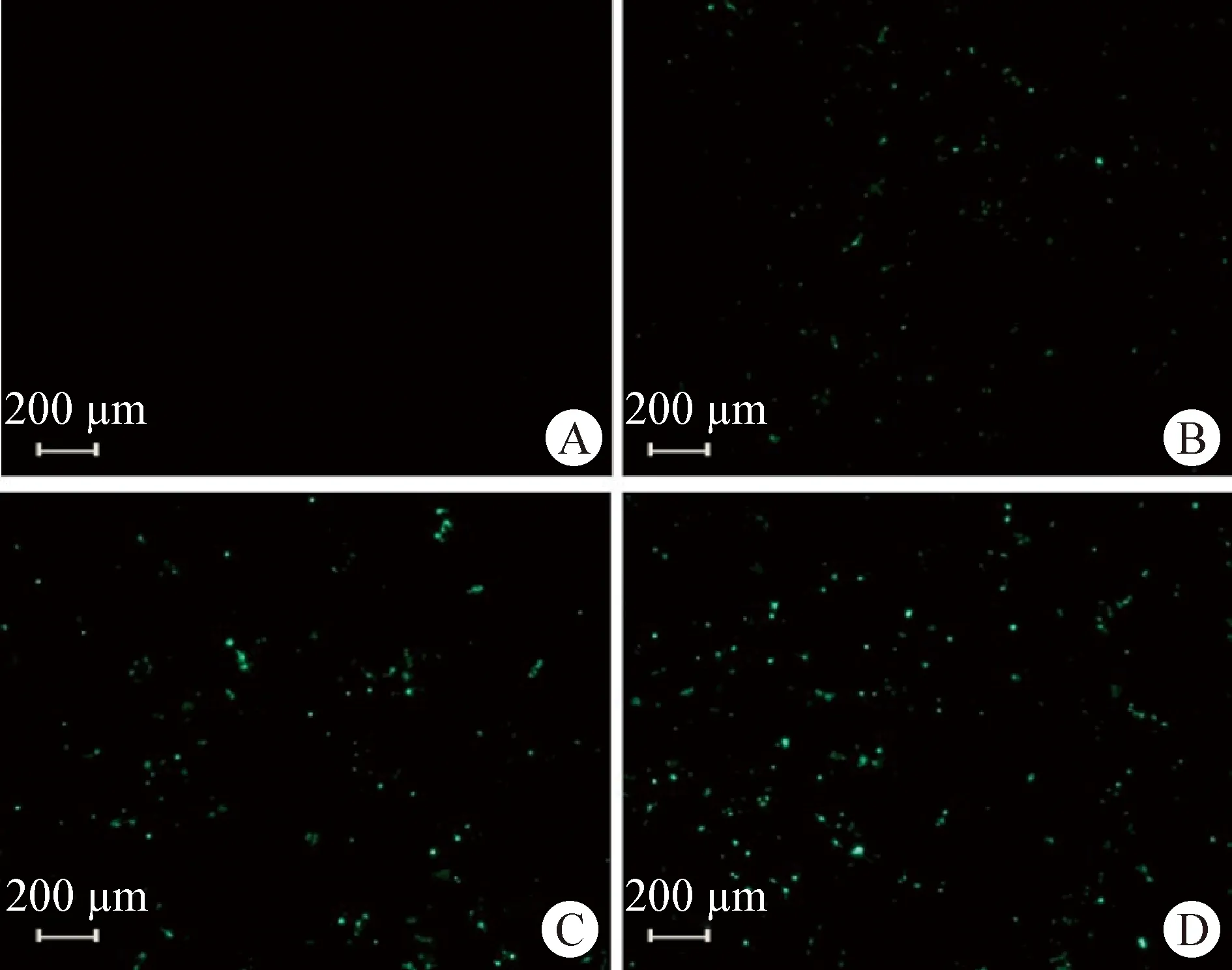
图3 RNase A 保护试验细胞荧光结果
2.4 细胞荧光试验 根据凝胶阻滞试验的结果将第1组细胞穿透肽RVG分别以8 μg、10 μg、12 μg与1 μg的mRNA-EGFP作用;将第2组细胞穿透肽RVG9dR分别以6 μg、8 μg、10 μg与1 μg的mRNA-EGFP作用;将第3组细胞穿透肽RVG11dR分别以4 μg、6 μg、8 μg与 1 μg的mRNA-EGFP作用,然后转染293T细胞,24 h后在倒置荧光显微镜下观察结果,如图4所示,RVG11dR 6 μg(图4K)和RVG11dR 8 μg(图4L)作用的细胞内荧光最强,说明3个细胞穿透肽中,RVG11dR对mRNA-EGFP的转运效果最好,但是6 μg和8 μg RVG11dR对mRNA-EGFP 的转运效果基本没有差别。

图4 细胞荧光试验结果
3 讨论
mRNA的生产是通过体外转录技术获得,体外转录是利用T7、T3或Sp6噬菌体RNA聚合酶以一个线性化的、编码目的基因mRNA的质粒DNA(Plasmid DNA,pDNA)作为模板进行转录后获得前体mRNA[4]。而本试验中采用的体外转录技术是利用含有T7启动子的线性化的DNA作为模板,用于体外转录的模板至少包含1个启动子、1个编码目的基因的开放阅读框(Open reading frame,ORF),然后用RNA聚合酶进行转录,再用DNA酶消化处理后就可以排除残留的线性化的DNA[5]。目前,mRNA的体外转录技术并不是十分完善,只通过普通的体外转录试剂盒转录出的mRNA极其不稳定,为了提高其稳定性,需要在前体mRNA的5′端通过5′-5′三磷酸连接1个帽子结构[6],在转录过程中添加帽子类似物有可能转录出带有帽子结构的mRNA, 而本试验采用的是在转录结束后利用加帽试剂盒添加帽子结构[7],在三磷酸酶、鸟苷基转移酶和(鸟嘌呤-7-)甲基转移酶的共同作用下在RNA的5′三磷酸添加1个帽子结构[8],这可以增加蛋白的表达量,提高mRNA的稳定性,保护其免遭核酸外切酶的攻击[9]。同时,还需要在前体mRNA的3′端添加一段Poly(A)尾巴结构,可以采用在pDNA后添加1个Poly(A)序列用于转录成Poly(A)尾巴,同样这一步骤本试验中也采用在转录后使用加尾试剂盒进行添加[10],Poly(A)尾巴可以增强mRNA翻译效率,提高mRNA的稳定性。经过加帽、加尾之后才能形成具有生物活性的mRNA,进一步提高mRNA的蛋白表达。
细胞穿透肽是一种短肽,在递送载体中扮演着十分重要的角色,它能够不依赖特异性膜受体独立穿过细胞膜,甚至有些细胞穿透肽的入胞并不依赖能量[11],其具有良好的生物相容性,且细胞毒性小,完成入胞转运后可降解,并能与生物活性蛋白直接融合进行重组表达[12]。细胞穿透肽的组成和结构多种多样,因此各类细胞穿透肽穿透细胞膜的方式和效率也各不相同。本试验中比较了来源于狂犬病糖蛋白的细胞穿透肽以及其衍生物对体外转录mRNA的递送效果。
从狂犬病病毒糖蛋白中提取的含有29个氨基酸残基的多肽片段RVG,作为一种阳离子细胞穿透肽,除了具有前面介绍的特点之外,它还有独特的优势:嗜神经性、血脑屏障通透性和生物安全性。RVG可以穿过血脑屏障(Blood-brain barrier,BBB)进入脑细胞[13],到目前为止已被证明可以成功地用于携带质粒[14]、siRNA[15]、蛋白质[16]和纳米颗粒[17]进入脑细胞。有研究表明,含有少精氨酸残基的嵌合RVG(RVG-9R)可以通过电荷相互作用与siRNA结合,并将其转运进树突状细胞(DCs)从而抑制流感病毒的复制[18]。另有研究发现,RVG-9R融合肽将DNA疫苗靶向转运进DCs可有效提高针对牛痘和西尼罗河病毒感染的免疫应答,精氨酸的低聚物使其具有更高的穿膜效率[19],此外,还有研究发现,精氨酸的数量和排列顺序对其穿膜能力有着重要的影响[20]。
本试验合成了来源于狂犬病病毒糖蛋白的细胞穿透肽RVG并设计、合成其衍生物RVG9dR、RVG11dR。结果显示:3种细胞穿透肽都对mRNA具有一定的包被、保护和递送效果,其中RVG11dR的包被效果最好、递送效率最高。有研究证实,带有29个精氨酸的RVG能够递送荧光蛋白到特定细胞内进行表达[21],因此可以适当增加精氨酸的数量来提高RVG的递送和保护效果,在本试验中RVG9dR和RVG11dR对mRNA的递送效率皆比RVG高,说明在RVG的C末端添加多精氨酸可以提高其对mRNA的包装与转运能力,但是细胞毒性试验结果又表明在RVG的C末端添加多精氨酸也可导致其细胞毒性的增加。研究证明,阳离子脂质体纳米颗粒(Lipid nanoparticles,LNPs)可作为高效的递送小干扰RNA(siRNA)的工具[22],或许将其与细胞穿透肽结合后会对mRNA的递送和保护产生积极效果[23]。因此,以后的研究中可以考虑采用将细胞穿透肽与脂质体纳米颗粒相结合的方式提高对mRNA的递送效力。

