失效锂离子电池正极材料管道化浸出工艺
陈世贤, 苏昊, 戴曦
(中南大学冶金与环境学院,长沙 410083)
0 引 言
当前,能源缺乏和环境污染问题已成为世界关注的焦点问题,因此,清洁无污染且可再生的新能源已成为世界共同需求。锂离子电池凭借着自放电率低、额定电压高等特性,广泛应用于电子领域,是蓄电池的重要发展方向[1-2]。中国不仅是世界上最大的锂离子电池生产基地,而且还是锂离子电池出口第一大国[3]。目前,全球正加快研究新能源汽车,锂离子动力电池因而得到了广泛应用,其耗费呈现出增长趋势,但随之而来的是金属资源出现过度消耗,并且废旧的锂离子电池不断地增长等问题[4]。我国新能源汽车销量也从2016年的50.7万辆[5-7]增长到2020年的116.8万辆[8],2021年全年销量将很可能突破300万辆[9],而普通锂离子动力电池使用寿命只有3~5年,估计到2025年,电池的报废量达111.70 GWh[10],根据以往的数据进行预测,至2030年,我国的电池报废量将会持续地快速增长,预计会高达116万吨[11]。如废旧锂离子电池处理办法不当,其中的有机含氟电解质、金属会对环境造成危害,而且失效锂离子电池中钴、锂、镍、铜等金属是非常重要且可以被回收的资源[12-15]。因此,对于失效锂离子电池的回收利用,具有极高的环保价值和经济价值。
已失效的锂离子电池先经过放电[16-17],再进行破碎拆解预处理[18]。目前采用的物理预处理方法主要包括破碎风选[19]、超声再生[20-21]、破碎浮选[22-23]、机械研磨[24]。预处理后,电池材料可通过化学等方法进行再处理。目前采用的化学方法主要包括火法冶金法[25]、熔盐化学焙烧法[26]、湿法冶金法[27-28]。火法冶金工艺操作简便、效率高、反应速度快,适合大规模失效锂离子电池的回收处理,但反应会产生有毒气体,需要加装烟气净化设备,严格控制处理温度,建设成本高;熔盐化学焙烧简化了工艺流程,避免浸出酸的使用,但产生的硫化物种类多,不利于后续金属的分离。湿法冶金具有反应时间长,试剂消耗量大,废水后续处理较困难等缺点,但其获得产品的纯度很高,湿法工艺是目前最为成熟的处理工艺[29]。湿法处理得到的富集液,可通过沉淀法[7]、电沉积法[30-31]、萃取法[32-33]、盐析法[34]等方法析出目的金属。除了上述方法,还有学者采用微生物法[35-38]、电极材料直接修复技术[39]进行处理,但是还不是很成熟。
通过以上分析和总结可知,湿法工艺是目前失效锂离子正极材料回收的主要方法,浸出是该方法的一个关键流程,工业生产中通常采用槽式浸出,但该体系不是封闭的,反应过程中,由于物料中残余的杂质在酸性体系下产生了气体,会严重恶化生产环境,且反应会消耗大量酸碱试剂和氧化剂,并产生大量的废水废酸。针对上述问题,本研究提出采用管式反应器浸出失效钴酸锂正极材料的方案,从而达到缩短浸出时间、增强传热传质效果,提高浸出效率、减少设备投资、优化浸出环境,进而实行强化浸出过程的目的。
1 实 验
1.1 实验原料
实验所用的原料是由某厂提供的失效钴酸锂正极材料,是废旧电池拆解后得到的正极经破碎筛分制得。采用四分法对原料进行取样,在真空干燥箱中烘干24 h后,采用扫描电子显微镜分析(SEM)、X射线衍射分析(XRD)、X射线能谱分析(EDS)对样品进行分析。化学成分分析结果见表1,原料的主要金属成分是Co和Li,C含量较低。原料的X射线衍射分析结果见图1,原料中的主要物相为LiCoO2。原料的SEM分析结果见图2,原料的微观形貌为类球状和棒状,原料粒径分布较均匀,晶体规整度较高,而且颗粒分散性比较好,有较强的颗粒感,并有少量团聚现象。对原料背散射电子像不同衬度区域(标记为a、b点)进行EDS分析,分析结果见图3和表2,可以看出原料主要含3种元素C、Co、O,黑色部分C含量高,含有少量的F和Al,主要是受电解质和铝箔的影响。

图3 失效钴酸锂正极材料背散射电子图像Fig.3 BSE image of failed lithium cobalt oxide cathode material
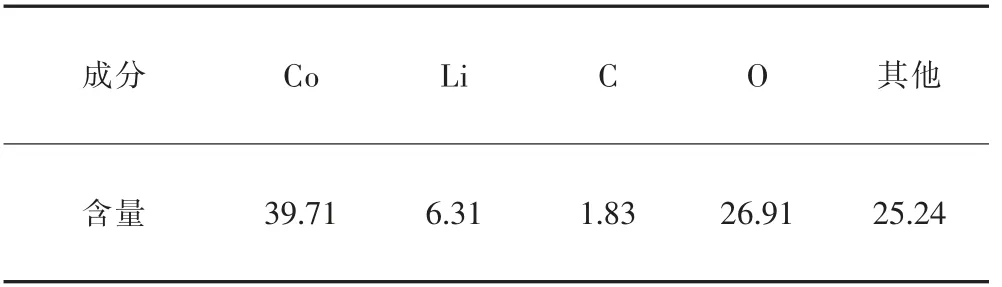
表1 失效钴酸锂正极材料的化学成分Table 1 Chemical composition of failed lithium cobalt oxide cathode material单位:质量分数,%
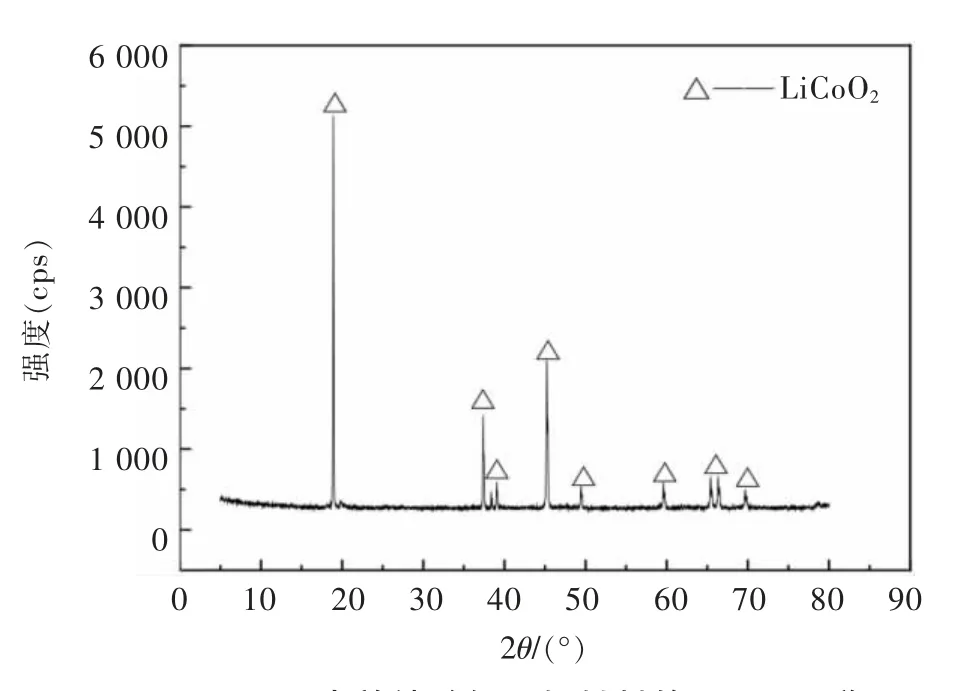
图1 失效钴酸锂正极材料的XRD图谱Fig.1 XRD pattern of failed lithium cobalt oxide cathode material
1.2 实验设备
本实验的实验装置是自行设计的管道浸出装置,其中不锈钢管道通过自吸泵进行连接,料浆则在泵的作用下在管道中循环流动,安装接触式调压器对管道进行加热和保温,还原剂溶液通过蠕动泵加入管道中。实验装置的结构图见图4。
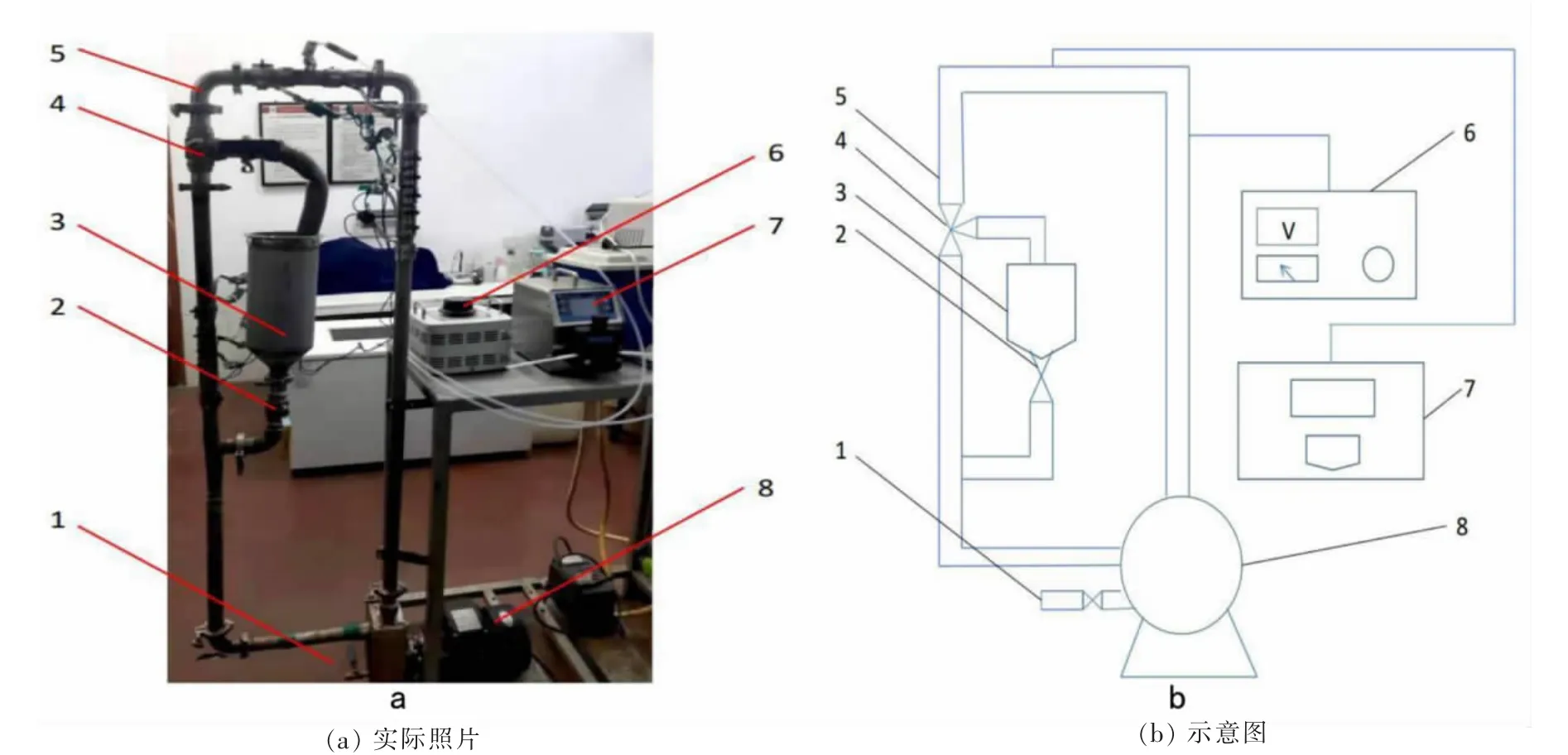
图4 实验装置Fig.4 Experimental device diagram
1.3 实验过程
称取适量的LiCoO2正极材料(已放入80℃真空干燥箱中烘干24 h)放入2 000 mL的烧杯中,加去离子水搅拌得到料浆,加入适量的硫酸溶液,最后得到给定体积的料浆。将料浆通过加料口加入已预热的管道化溶出实验装置中,并开启自吸泵使料浆在管道中循环流动,还原剂溶液通过蠕动泵匀速加入管道中,达到反应时间后,将浸出溶液从取液口处排出,最后对浸出后料浆进行抽滤,使酸浸液和浸出渣分离,用去离子水洗涤浸出渣2~3次后,将浸出渣置于烘箱中烘干24 h,取出后,称重浸出渣,研磨后取样进行分析检测。

式(1)、式(2)中:C(Co),C(Li)分别为失效钴酸锂正极材料中钴、锂的浸出率,%;m0、m1分别为浸出前原料和浸出后滤渣的质量,g;x(Co)、x(Li)分别为浸出前原料中钴、锂的质量分数,%;y(Co)、y(Co)分别为浸出后浸出渣中钴、锂的质量分数,%。
2 结果与讨论
以失效钴酸锂正极材料中钴和锂的浸出率作为主要考察指标,采用单因素条件实验,研究在管道浸出装置中浸出时间、浸出温度、硫酸浓度、液固比(指溶液中加入的所有液体体积量(mL)与固体物料(钴酸锂)质量(g)的比值,下同)、还原剂种类等条件对钴和锂浸出率的影响规律,并对优化条件下的浸出渣进行表征。过氧化氢(H2O2)水作为还原剂,浸出反应方程式如下:

2.1 浸出时间的影响
在浸出温度为40℃,硫酸浓度为2.5 mol/L,H2O2体积分数为6%,液固比为8 mL/g的条件下,探 究 浸 出 时 间 分 别 为90、120、150、180、210 min时对失效钴酸锂正极材料中钴、锂浸出率的影响,如图5所示。
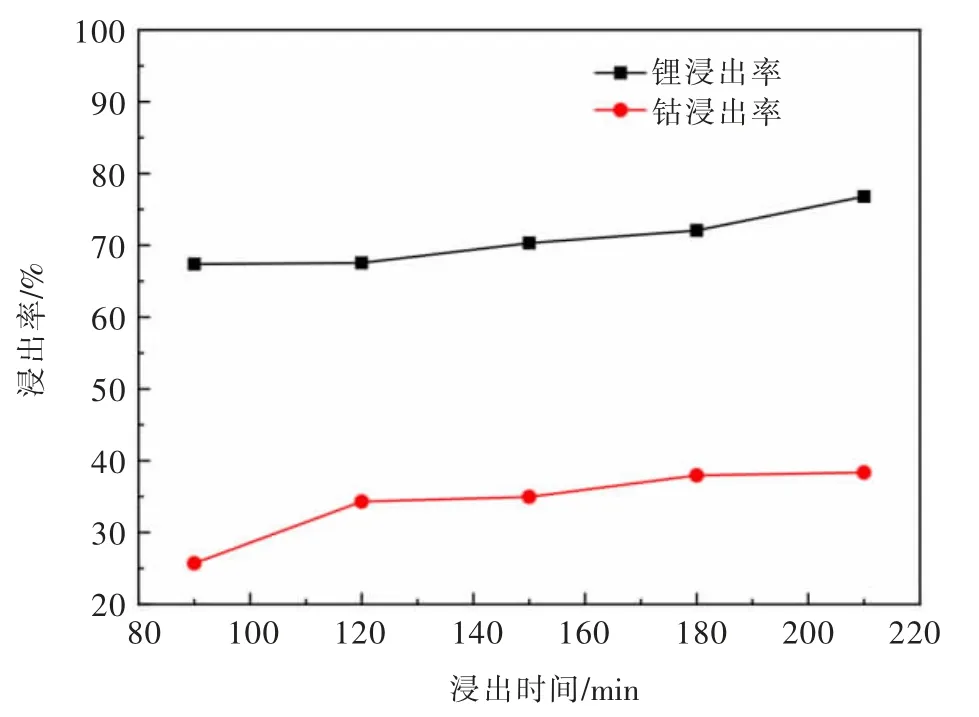
图5 浸出时间对浸出率的影响分析Fig.5 Analysis of influence of leaching time
由图5可以看出,随着浸出时间延长,失效钴酸锂正极材料中钴、锂的浸出率逐渐提高,这表明延长浸出时间能提高浸出效率,但浸出率都不高。考虑到实验过程时间以及钴、锂浸出率等因素,后续实验选用浸出时间为180 min。
2.2 浸出温度的影响
在浸出时间为180 min,硫酸浓度为2.5 mol/L,H2O2体积分数为6%,液固比为8 mL/g的条件下,研究浸出温度分别为40、53、63、76、84℃时对失效钴酸锂正极材料中钴、锂浸出率的影响,如图6所示。
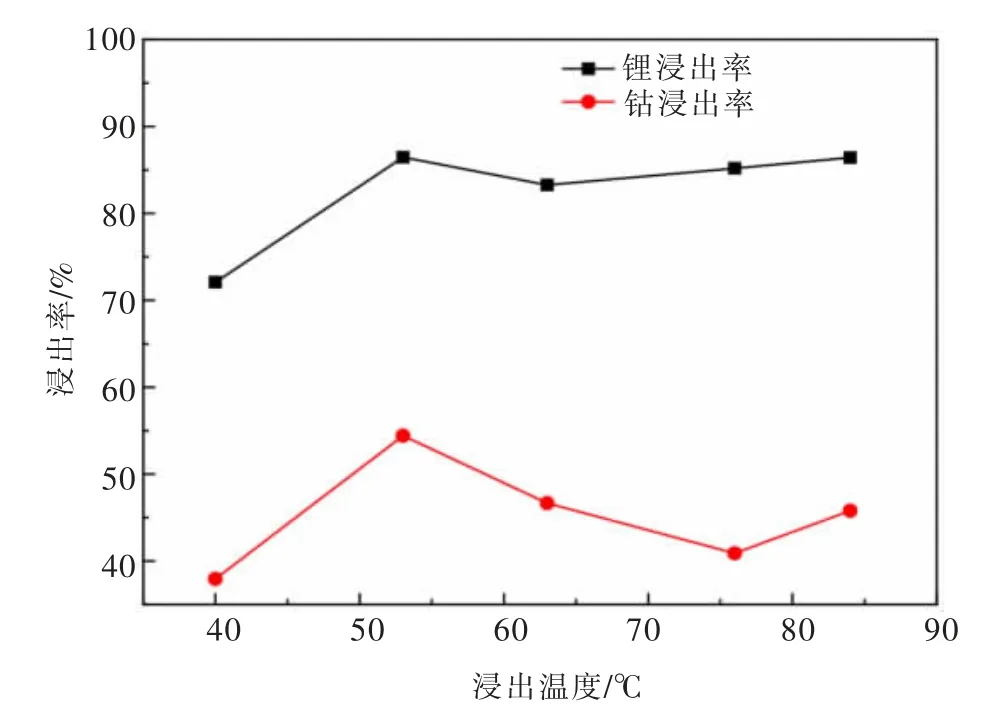
图6 浸出温度对浸出率的影响分析Fig.6 Analysis of influence of leaching temperature
由图6可以看出,随着浸出温度升高,失效钴酸锂正极材料中钴、锂的浸出率先增加再减少,最后又增加,且温度对浸出率的影响较大。
相比于其他研究机构,我国高校不仅拥有更多的科技成果,而且存在更多的技术转移转化困难。因此,本文所选的研究主题就是高校科技成果的转化,主要是对高校科技成果转化存在的问题进行深入分析,以此在其中找出进一步加快推进其转化的一些行之有效的对策,从而使得整个社会在科技成果转化上进一步加快,为经济发展注入新的活力。
由于H2O2在高温下不稳定,很容易分解,而且在剧烈搅拌下会产生大量气泡,从而降低其在溶液中的有效浓度。H2O2的分解反应方程式如下:

温度达到53℃后,随着温度升高,浸出率反而下降,这表明在此条件下,H2O2发生了自分解,降低了溶液中还原剂的有效浓度,导致浸出率下降。当温度达到76℃后,浸出率又开始升高,这表明温度继续升高,反应速率加快,浸出率提高,表明此时温度对反应速率的影响大于对H2O2自分解的影响。
考虑到工业生产中采用的是高温浸出和锂、铁浸出率等因素,后续实验选用84℃作为浸出温度。
由于在上述浸出温度条件实验中,53℃时钴和锂的浸出率是最高,高于84℃时的浸出率,温度条件实验中采用的硫酸浓度为2.5 mol/L,为了再一次验证温度对浸出率的影响,提高硫酸浓度再次进行实验,在浸出时间为180 min,H2O2体积分数为6%,硫酸浓度为3 mol/L,液固比为8 mL/g的条件下,研究对比温度分别为53、84℃时失效钴酸锂正极材料中钴、锂浸出率的影响,探究交互影响,浸出率变化见图7。
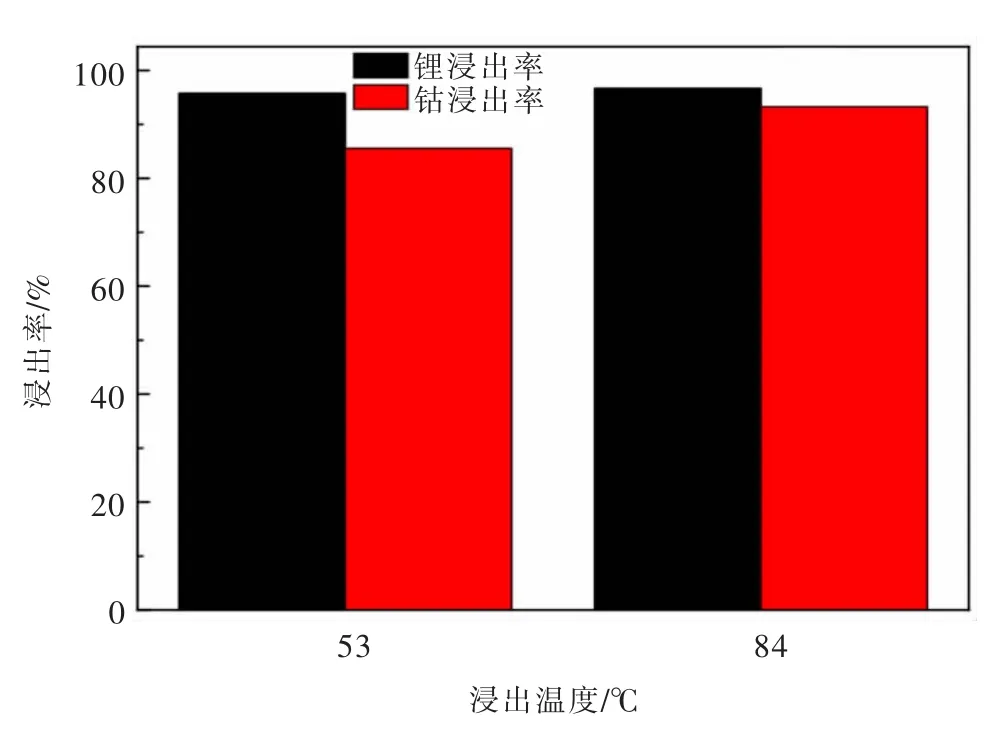
图7 浸出温度对浸出率的对比实验分析Fig.7 Analysis of the temperature contrast experiment
由图7可以看出,保持相同的硫酸浓度,浸出温度从53℃升至84℃,钴和锂的浸出率均增大,其中钴的浸出率从85.55%增至93.27%,这说明升高温度有利于提高反应速率,提高浸出率,再一次证明了升高温度有助于提高浸出率。
2.3 硫酸浓度的影响
在浸出温度为84℃,浸出时间为180 min,H2O2体积分数为6%,液固比为8 mL/g的条件下,研究硫酸浓度分别1.5、2、2.5、3、3.5 mol/L时失效钴酸锂正极材料中钴、锂浸出率的影响,如图8所示。

图8 硫酸浓度对浸出率的影响分析Fig.8 Analysis of the influence of sulfuric acid concentration
如图8所示,随着硫酸浓度的增加,锂、钴浸出率均先上升后接近平缓,但锂的浸出率增加幅度小于钴的浸出率。
实验中,当硫酸浓度高于3 mol/L时,抽滤就非常困难,需要的抽滤时间很长,综合考虑时间成本、酸用量和保证钴、锂浸出率等因素,在后续实验中选用硫酸浓度为2.5 mol/L。
2.4 液固比的影响
在浸出温度为84℃,浸出时间为180 min,H2O2体积分数为6%,硫酸浓度为2.5 mol/L的条件下,研究液固比分别为8、12、16、20 mL/g时失效钴酸锂正极材料中钴、锂浸出率影响,如图9所示。
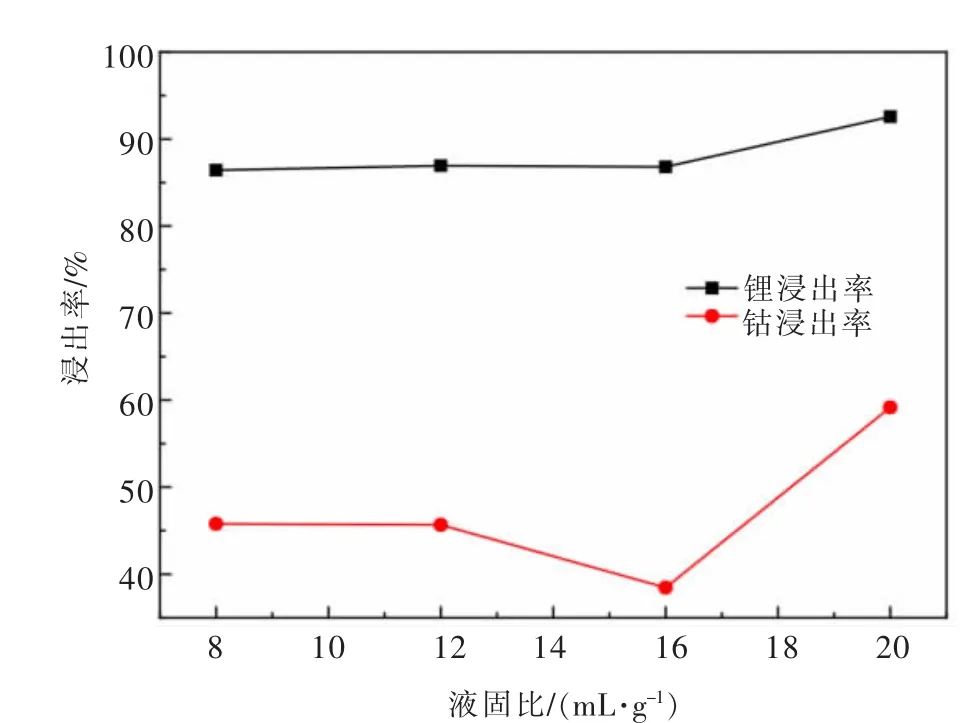
图9 液固比对浸出率的影响分析Fig.9 Analysis of the influence of the liquid-solid ratio
由图9可以看出,液固比的变化对于锂浸出率的影响不大,但对钴的浸出率影响较大,出现了一定幅度的波动。
考虑到提高钴、锂浸出率等因素,在后续实验中选用液固比为20 mL/g。
上述系列实验中浸出率并没有显著提高,特别是钴的浸出率很低,其主要原因是还原剂的选择,H2O2作为还原剂,容易发生自分解反应,从而降低其在溶液中的有效浓度,严重影响实验的效果,因此,本研究将考察还原剂种类对浸出过程的影响。
2.5 还原剂种类的影响
由于H2O2在高温下不稳定,很容易分解,而且在剧烈搅拌下会产生大量气泡,从而降低其在溶液中的有效浓度,为获得较高的钴和锂浸出率,需提高硫酸的浓度。本研究选用硫酸作为浸出剂,探究还原剂种类对反应浸出率的影响,选用的体系有硫代硫酸钠(Na2S2O3)、葡萄糖(C6H12O6)、抗坏血酸(C6H8O6),并对不同还原剂的效果进行对比。
选用硫代硫酸钠、抗坏血酸、葡萄糖作为还原剂,其反应方程式如下:

在浸出温度为84℃,浸出时间为180 min,硫酸浓度为2.5 mol/L,液固比为20 mL/g的条件下,研究还原剂种类对失效钴酸锂正极材料中钴、锂浸出率的影响,浸出率变化见图10。
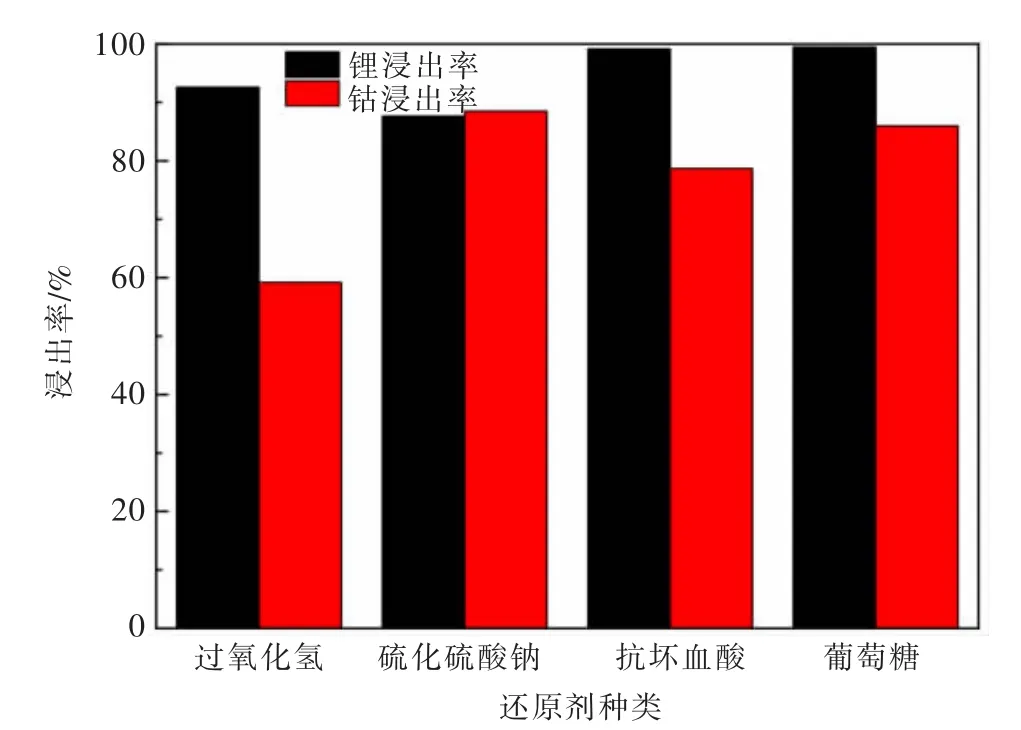
图10 还原剂种类对浸出率的影响Fig.10 Effect of reductant type on leaching rate
由图10可以看出,采用了固体还原剂后,浸出率提高,特别是钴的浸出率提高了很多,其中,葡萄糖作为还原剂时,效果最为明显,与H2O2体系相比,钴浸出率从59.18%增加到85.95%,锂浸出率从92.57%增加到99.47%,这表明固体还原剂对提高钴的浸出率效果显著。
从机理上分析,从标准还原电极电势值来看,Na2S2O3的还原能力强于H2O2。在酸性介质中H2O2易歧化分解为H2O和O2,其实Na2S2O3在酸性水溶液中也不稳定,会产生亚硫酸和原子态的硫的分解产物,但这两种产物的还原能力均强于H2O2。因此Na2S2O3比H2O2具有更好的还原效率[40]。
抗坏血酸(维生素C)是一种天然有机酸,属于酸性多羟基化合物,其在酸性环境中比较稳定。分子中第2和第3位上两个相邻的烯醇式羟基极易解离,而释放出H+,所以具有酸的形式。分子结构中C3位-OH由于受共轭效应影响,其酸性较强;而C2位的-OH由于形成了分子内氢键,其酸性极弱,所以一般表现为一元酸。其用于抗氧化剂,具有很强的还原性,二烯醇结构很容易被氧化成二酮结构,即脱氢抗坏血酸[41]。
葡萄糖是自然界中分布最广的单糖,属于多羟基醛,廉价易得。其在酸性环境中会发生醛糖氧化反应,释放出CO2和H+,起着还原剂的作用,促进由Co3+还原为Co2+,实现失效钴酸锂材料的还原强化浸出。并且,葡萄糖中间产物多为一元有机酸,可增加浸出体系的酸浓度,有利于浸出过程[42]。
2.6 浸出渣表征
为了获得更好的浸出效果,探究进一步的实验方向,分别选择钴和锂浸出率均高的浸出渣以及钴和锂浸出率均低的浸出渣进行形貌和成分分析,具体组别、实验条件及浸出效果见表3,其中,a、b、c是以H2O2为还原剂的条件实验,d、e是探究还原剂种类对浸出率影响的条件实验。
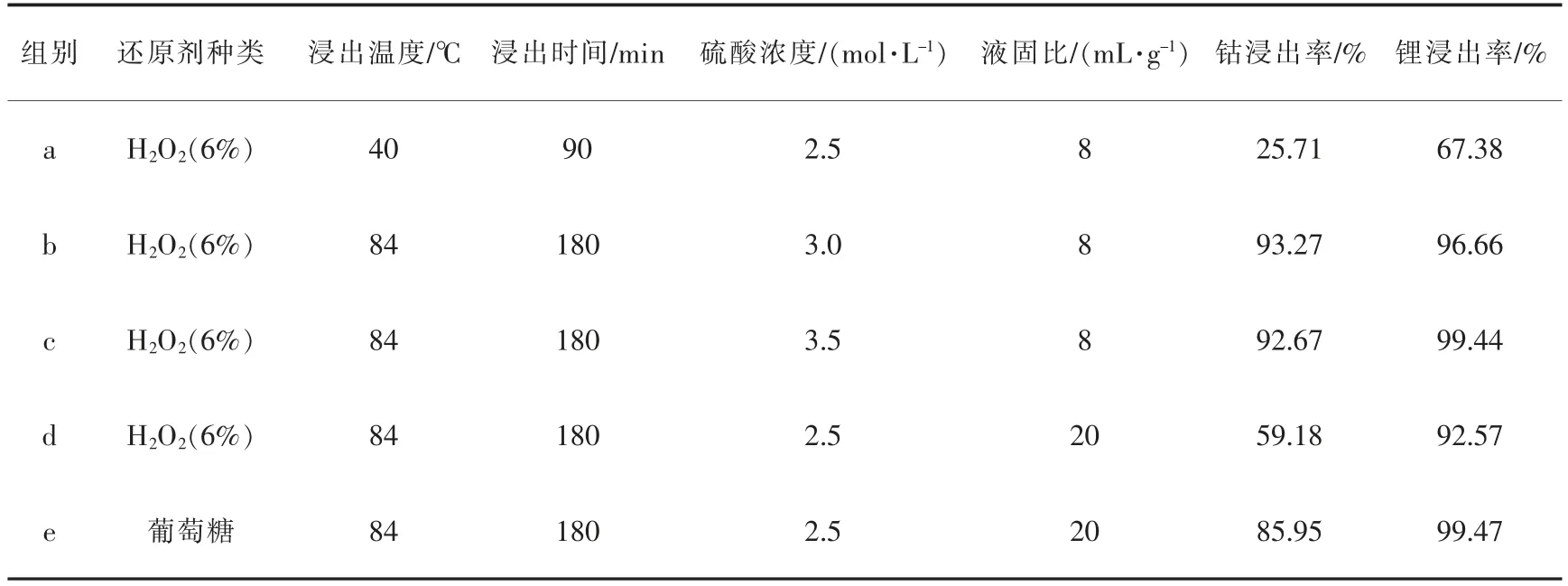
表3 选取的浸出渣的浸出条件Table 3 Leaching conditions of selected leaching residues
2.6.1 SEM结果分析
对5组浸出渣进行SEM形貌的分析,结果见图11。

图11 5组浸出渣SEM图像Fig.11 SEM of five groups of leaching residue
从图11可以看出,a组浸出渣形貌与原料很相似,晶体规整度较好,颗粒呈较为规则块状,粒径普遍较大,粒径分布均匀,孔隙率较高。b、c两组浸出渣的晶体规整度很差,颗粒呈异形块状,粒径普遍较小,且粒径分布不均匀,孔隙率明显减少,出现了明显的团聚现象。这表明在H2SO4—H2O2体系中浸出正极材料后,a组并没有充分反应,b、c两组表面包覆的碳被分开,颗粒被破坏,验证了强酸浸出能够破坏钴酸锂结构。
从图11可以看出,d组浸出渣还具有较好晶体规整度,颗粒是均匀分布的较规则的块状,有一定程度的孔隙率。e组浸出渣的晶体规整度很差,颗粒呈异形块状,粒径普遍较小,且粒径分布不均匀,孔隙率明显减少。这表明在葡萄糖—硫酸体系中浸出正极材料后,表面包覆了碳的LiCoO2正极材料颗粒被破坏,葡萄糖充分发挥了还原作用,促进了由Co3+向Co2+的还原过程,实现失效钴酸锂材料的还原强化浸出。另一方面,葡萄糖在反应过程中的中间产物也多为一元有机酸,可以增加浸出体系的酸浓度,也有利于浸出过程。因此,加入葡萄糖浸出能够很好地促进破坏钴酸锂结构。
2.6.2 EDS结果分析
对a、b和c组浸出渣进行EDS成分分析,对每组浸出渣不同衬度区域成分进行分析,如图12和表4所示。
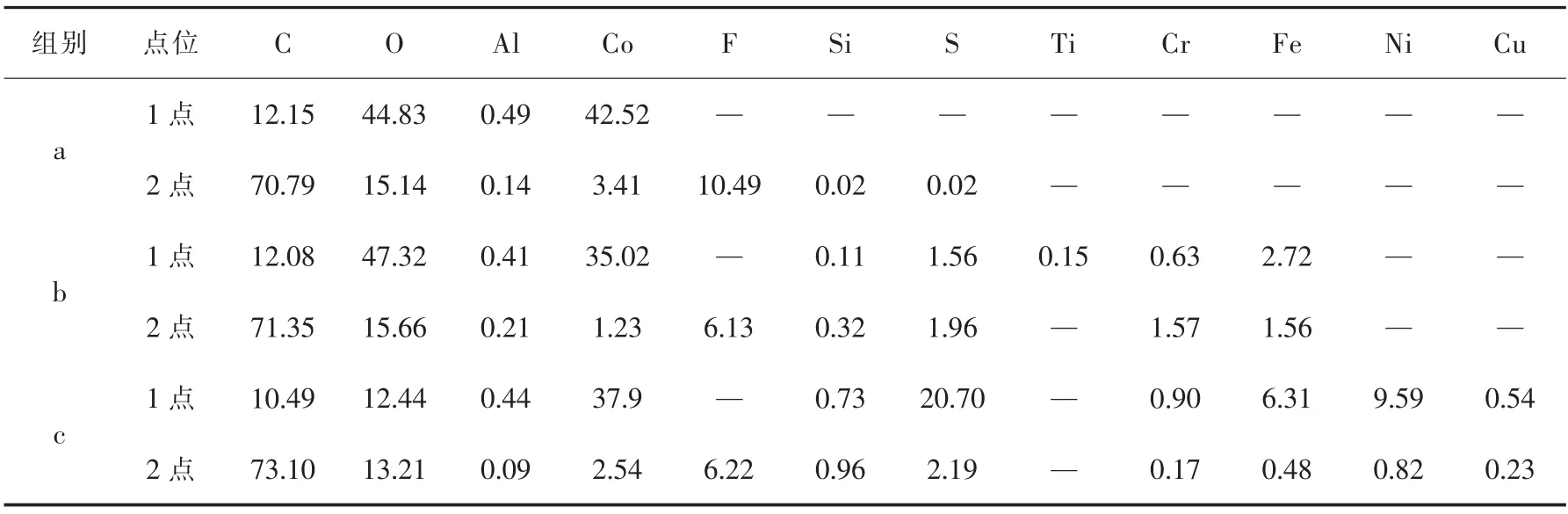
表4 EDS元素含量分析Table 4 EDSelement content analysis 单位:质量分数,%

图12 3组浸出渣背散射电子像Fig.12 BSE image of leaching residues of three groups
由图12和表4可以看出,a组浸出渣与原料很相似,主要含3种元素C、Co、O,黑色部分C含量高,含有少量的F和Al,主要是受电解质和铝箔的影响。与浸出率低的a组浸出渣相比,b、c两组浸出渣中S含量增加得明显,说明高浓度硫酸体系增加了浸出渣中的S含量,且高浓度硫酸体系加速了腐蚀不锈钢浸出管道,使浸出渣中含有少量Fe、Cr等不锈钢的合金元素。
3 结 论
1)失效钴酸锂正极材料管道化浸出,在浸出时间为180 min,浸出温度为84℃,H2O2体积分数为6%,硫酸浓度为3.5 mol/L、液固比为8 mL/g条件下,钴、锂浸出率分别达到92.67%和99.44%。
2)失效钴酸锂正极材料管道化浸出实验中,研究浸出条件对浸出效果的影响,H2O2浸出效果不太理想。H2O2的高浸出率必须以高酸作为条件,可采用葡萄糖等固体还原剂进行替代。
3)失效钴酸锂正极材料管道化浸出,研究不同还原剂对浸出效果的影响,在浸出温度为84℃,浸出时间为180 min,硫酸浓度为2.5 mol/L、液固比为20 mL/g条件下,硫代硫酸钠体系中,钴、锂浸出率分别为88.50%和87.61%;抗坏血酸体系中,钴、锂浸出率分别为78.66%和99.12%;葡萄糖体系中,钴、锂浸出率分别为85.95%和99.47%,表明在固体还原剂体系中,葡萄糖的浸出效果较好。

