紫玉兰叶中木脂素类成分及抗炎活性研究
丁林芬,刘 佳,宋京风,雷 铁,聂 伟,宋流东,吴兴德
紫玉兰叶中木脂素类成分及抗炎活性研究
丁林芬1,刘 佳3#,宋京风1,雷 铁1,聂 伟1,宋流东1*,吴兴德2, 4*
1. 昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500 2. 云南民族大学 民族药资源化学国家民族事务委员会-教育部重点实验室,云南 昆明 650500 3. 昆明医科大学海源学院,云南 昆明 650101 4. 中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650201
研究紫玉兰叶中木脂素类化学成分及其抗炎活性。采用硅胶、MCI gel、Sephadex LH-20、半制备HPLC等色谱方法进行分离纯化,根据波谱数据鉴定化合物的结构;通过测定化合物对脂多糖(lipopolysaccharide,LPS)诱导小鼠RAW 264.7巨噬细胞释放炎症介质NO的抑制能力,评价化合物的抗炎活性。从紫玉兰95%乙醇提取物中分离得到16个木脂素,分别鉴定为burcellin(1)、(7S,8S,1′S)-3,4,1′-三甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯-6′-酮(2)、(7S,8S,1′R)-3,4,5,1′-四甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯-6′-酮(3)、(7S,8S,1′S)-3,4,5,5′-四甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮(4)、(7S,8S,1′R)-3,4,5,5′-四甲氧基-1′,4′-二氢- 7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮(5)、(7S,8S,1′R)-3,4,5′-三甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮(6)、(7R,8S,1′S)-3,4-亚甲二氧基-5′-甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮(7)、simulanol(8)、落叶松树脂醇(9)、5′-甲氧基落叶松树脂醇(10)、5,5′-二甲氧基落叶松树脂醇(11)、nectandrin A(12)、nectandrin B(13)、杜仲树脂酚(14)、丁香脂素(15)和松脂醇(16)。化合物8、10、11、13和16对LPS诱导RAW 264.7细胞释放NO具有显著抑制作用,其半数抑制浓度(median inhibition concentration,IC50)分别为(8.38±0.07)、(16.24±0.35)、(229.71±1.30)、(21.68±0.72)、(19.74±0.39)μmol/L。化合物2、4~6、8、10、11和13为首次从木兰属植物中分离得到;所有化合物均为首次从该植物中分离得到,首次报道化合物1的1H-和13C-NMR数据,并且首次报道化合物2和4的13C-NMR数据。化合物8、10、11、13和16具有潜在的抗炎作用。
木兰属;紫玉兰;木脂素;抗炎活性;burcellin;(7S,8S,1′S)-3,4,1′-三甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯-6′-酮;5′-甲氧基落叶松树脂醇
紫玉兰Desr.为木兰科(Magnoliaceae)木兰属Linn.落叶灌木。产于我国福建、湖北、四川、云南,生于海拔300~1600 m的山坡林缘。紫玉兰与玉兰Desr.同为我国2千多年的传统花卉,在我国大部分城市均有栽培,并已被引种至欧美各国,其树皮、叶和花蕾均可入药,常用作镇痛消炎剂[1]。据《新华本草纲要》记载,紫玉兰具有祛风散寒,通鼻窍的功效,用于治疗鼻塞、鼻渊、风寒头痛、浊涕等症,是民间药材辛夷的重要来源之一[2]。文献报道紫玉兰中含有木脂素、生物碱、挥发油等成分[3-5],药理研究表明其木脂素和挥发油具有抗炎、抗氧化、抗植物致病性真菌等活性[6-8]。基于此,本实验对紫玉兰叶开展系统深入的化学成分研究,灵活运用各种色谱方法从紫玉兰叶的95%乙醇提取物中分离得到16个木脂素(图1),分别鉴定为burcellin(1)、(7S,8S,1′S)-3,4,1′-三甲氧基-1′,6′-二氢-7,4′-环氧8,3′-新木脂烷-8′-烯-6′-酮[(7S,8S,1′S)-3,4,1′- trimethoxy-1′,6′-dihydro-7,4′-epoxy-8,3′-neoligna-8′-en- 6′-one,2]、(7S,8S,1′R)-3,4,5,1′-四甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯-6′-酮[(7S,8S, 1′R)-3,4,5,1′-tetramethoxy-1′,6′-dihydro-7,4′-epoxy- 8,3′-neoligna-8′-en-6′-one,3]、(7S,8S,1′S)-3,4,5,5′-四甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯- 4′-酮[(7S,8S,1′S)-3,4,5,5′-tetramethoxy-1′,4′-dihydro- 7,2′-epoxy-8,1′-neoligna-8′-en-4′-one,4]、(7S,8S, 1′R)-3,4,5,5′-四甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮[(7S,8S,1′R)-3,4,5,5′- tetramethoxy-1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna- 8′-en-4′-one,5]、(7S,8S,1′R)-3,4,5′-三甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮(7R,8S, 1′S)-3,4,5′-trimethoxy-1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna-8′-en-4′-one,6)、(7R,8S,1′S)-3,4-亚甲二氧基-5′-甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷- 8′-烯-4′-酮[(7S,8S,1′R)-3,4-methylenedioxy-5′-methoxy- 1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna-8′-en-4′-one,7]、simulanol(8)、落叶松树脂醇(lariciresinol,9)、5′-甲氧基落叶松树脂醇(5′- methoxylariciresinol,10)、5,5′-二甲氧基落叶松树脂醇(5,5′-dimethoxy lariciresinol,11)、nectandrin A(12)、nectandrin B(13)、杜仲树脂酚(medioresinol,14)、丁香脂素(syringaresinol,15),以及松脂醇(pinoresinol,16)。化合物2、4~6、8、10、11和13为首次从木兰属植物中分离得到;所有化合物均为首次从该植物中分离得到,首次报道化合物1的1H-和13C-NMR数据,并且首次报道化合物2和4的13C-NMR数据。同时对化合物1~16进行脂多糖(lipopolysaccharide,LPS)诱导RAW264.7巨噬细胞释放NO的抑制活性评价,发现化合物8、10、11、13和16具有显著抑制作用,其半数抑制浓度(median inhibition concentration,IC50)分别为(8.38±0.07)、(16.24±0.35)、(22.71±1.30)、(21.68±0.72)和(19.74±0.39)μmol/L。
1 仪器与材料
Shimadzu UV-2700紫外可见分光光度仪(日本Shimadzu公司);Jasco P-1020型全自动数字旋光仪(日本Jasco公司);Thermo NICOLET iS10中红外(美国Thermo公司);Bruker Avance III 500 MHz、Avance III 600 MHz、AV 800 MHz核磁共振仪(德国Bruker公司);Agilent 1260高效液相色谱仪(美国Agilent公司);色谱柱为Zorbax SB-C18(Agilent公司,150 mm×9.6 mm,5 μm,美国);柱色谱硅胶(临沂市海祥化工厂,100~200、200~300目);GF254薄层色谱硅胶板(临沂市海祥化工厂);Sephadex LH-20(Pharmacia公司,瑞典);MCI gel(CHP 20P,75~150 μm;日本三菱化学株式会社);显色剂(10%硫酸乙醇溶液,喷洒后适当加热);色谱甲醇(玉溪新蓝景化学工业有限公司);分析甲醇(玉溪新蓝景化学工业有限公司);所有溶剂均为工业溶剂重蒸后使用。

图1 化合物1~16的结构
药材紫玉兰于2018年6月采自云南昆明,由中国科学院昆明植物研究所成晓副研究员鉴定为紫玉兰Desr.的干燥叶,标本(20180603m)存放在中国科学院昆明植物研究所植物化学与西部资源持续利用国家重点实验室。
2 提取与分离
紫玉兰叶6 kg用95%乙醇浸泡提取3次,每次48 h,合并提取液,减压蒸馏去除有机溶剂。将提取物分散于水中,用醋酸乙酯萃取4次,回收溶剂得醋酸乙酯部分220 g。用聚酰胺粉(1∶1.5)拌样,经MCI gel柱色谱,用甲醇-水(40∶60→100∶0)梯度洗脱,TLC检测合并相同部分得Fr. 1~11。Fr. 4(2.7 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(8∶2)洗脱得到Fr. 4.1~4.9。Fr. 4.4(96 mg)经正相硅胶柱色谱,以石油醚-丙酮(8∶2)洗脱得到化合物13(16.8 mg)。Fr. 4.5(76 mg)经正相硅胶柱色谱,以石油醚-丙酮(8∶2)洗脱,再经三氯甲烷-丙酮(20∶1)和Sephadex LH-20(甲醇)洗脱得到化合物8(7.6 mg)和15(2.3 mg)。Fr. 4.7(90 mg)经正相硅胶柱色谱,以石油醚-丙酮(8∶2)洗脱,再经三氯甲烷-丙酮(20∶1)和Sephadex LH-20(甲醇)洗脱得到12(13 mg)和14(1.5 mg)。Fr. 5(5.3 g)经正相硅胶柱色谱,以三氯甲烷-丙酮(300∶1→1∶1)洗脱得到Fr. 5.1~5.11。Fr. 5.1(300 mg)经正相硅胶柱色谱洗脱得到Fr. 5.1.1~5.1.3。Fr. 5.1.2(80 mg)经正相硅胶柱色谱,以石油醚-丙酮(9∶1)洗脱,再经石油醚-醋酸乙酯(8∶2)和Sephadex LH-20(甲醇)得到化合物10(9.0 mg)。Fr. 5.1.3(47 mg)经半制备HPLC色谱仪(乙腈-水30∶70,3 mL/min)制备得化合物1(R= 12.5 min,2.8 mg)、2(R= 11.5 min,1.3 mg)、5(R= 9.0 min,1.4 mg)、6(R= 15.3 min,1.7 mg)。Fr. 5.6(150 mg)经正相硅胶柱色谱,以石油醚-丙酮(8∶2)洗脱,再经石油醚-醋酸乙酯(8∶2)和Sephadex LH-20(甲醇)洗脱得到化合物4(1.4 mg)和11(8.0 mg)。Fr. 5.9(475 mg)经正相硅胶柱色谱,以石油醚-丙酮(7∶3)洗脱得到Fr. 5.9.1~5.9.4。Fr. 5.9.2(144 mg)经正相硅胶柱色谱,以三氯甲烷-甲醇(9.5∶0.5)洗脱得到化合物7(72.6 mg)和9(8.5 mg)。Fr. 5.9.3(88 mg)经正相硅胶柱色谱,以三氯甲烷-甲醇(9.5∶0.5)和Sephadex LH-20(甲醇)洗脱得到化合物3(2.7 mg)和15(2.7 mg)。Fr. 5.10(542 mg)经正相硅胶柱色谱,以石油醚-丙酮(7∶3),再经三氯甲烷-丙酮(9∶1)洗脱得到化合物16(1.4 mg)。
3 抗炎活性实验
取对数生长期的RAW 264.7巨噬细胞接种至96孔板,用1 μg/mL LPS进行诱导刺激,同时加入待测化合物处理(终浓度从50 μmol/L开始2倍稀释),设空白对照组和G-甲基--精氨酸乙酸盐(G-monomethyl--arginine, monoacetate salt,-NMMA)阳性对照组,细胞培养24 h后取培养基检测NO生成,在570 nm处测定吸光度()值。剩余培养基利用MTS法检测细胞存活率,排除化合物对细胞生长的影响。IC50按Reed&Muench法计算。
NO生成抑制率=(空白对照组570-样品组570)/空白对照组570
4 结构鉴定
化合物1:为无色油状物,[α]20.6 D+43.84 (0.10, MeOH);(nm): 208 (4.58)。根据正离子HRESIMS/: 409.162 2 [M+Na]+,计算值为409.162 2和13C-NMR数据推断其分子式为C22H26O6,不饱和度为10。IR光谱中显示苯环(1611、1508、1463 cm−1)、酮羰(基1730 cm−1)、烯烃(1652 cm−1)等官能团信号峰。分析1H- 和13C-NMR数据(表1)可知,该化合物含有1个1,3,4,5-四取代苯环[H6.54 (2H, s, H-2, 6),C133.3 (C-1), 103.0 (C-2, 6), 153.7 (C-3, 5), 138.6 (C-4)],1个烯丙基[H2.53 (1H, dd,= 13.2, 7.5 Hz, H-7′a), 2.48 (1H, dd,= 13.2, 7.3 Hz, H-7′b), 5.69 (1H, m, H-8′), 5.07 (2H, m, H-9′),C45.4 (C-7′), 131.0 (C-8′), 119.2 (C-9′)],1个β位氧取代的α,β不饱和酮结构单元[5.71 (1H, s, H-5′),C172.3 (C-4′), 99.6 (C-5′), 200.0 (C-6′)],1个三取代双键[H6.21 (1H, s, H-2′),C134.7 (C-2′), 140.1 (C-3′)],1个氧取代次甲基[H5.05 (1H, brs, H-7),C93.9 (C-7)],1个被氧化的叔碳[C81.5 (C-1′)],1个次甲基[H3.05 (1H, m, H-8),C42.4 (C-8)],1个甲基[H1.36 (3H, d,= 6.8 Hz, H-9),C16.4 (C-9)],4个甲氧基[H3.88 (6H, s, 3, 5-OCH3),H3.86 (3H, s, 4-OCH3),H3.18 (3H, s, 1′-OCH3);C56.2 (3, 5-OCH3), 60.9 (4-OCH3), 54.0 (1′-OCH3)]。上述核磁数据分析表明化合物1为苯并呋喃酮型木脂素,其1H-和13C-NMR数据和化合物3相似。化合物3的结构通过和文献中报道的1H-和13C-NMR数据比较确定为(7S,8S,1′R)-3,4,5,1′-四甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯- 6′-酮[9-10]。进一步通过HMBC、HSQC、1H-1H COSY谱(图2)分析确定化合物1和3具有相同的平面结构。ROESY谱(图2)中H-6/H-8, H-7/H-9相关,表明化合物1的C-7, C-8位相对立体构型和化合物3一致,其H-7和H-9均为β朝向。进一步分析化合物1和3的13C NMR数据,仅发现化合物1的C-1′ (∆C−0.7)、C-6′ (∆C−0.4)、C-7′ (∆C−0.5) 碳谱数据向高场,其余碳谱数据高度一致,说明C-1′的立体构型与化合物3相反。因此,化合物1的结构鉴定为化合物3的C-1′差向异构体。经检索化合物1的结构在文献中有报道(burcellin),然而未见波谱数据和物理常数报道[11-12]。本研究首次利用1D和2D NMR解析并确证化合物1的结构,并首次报道其1H-和13C-NMR数据。
表1 化合物1~4的1H-NMR (CDCl3)数据
Table 1 1H-NMR (CDCl3) data of compounds 1-4
碳位1 (600 MHz)2 (800 MHz)3 (600 MHz)4 (800 MHz) 26.54 (1H, s)6.85 (1H, d, J = 1.8 Hz)6.53 (1H, s)6.57 (1H, s) 5 6.89 (1H, d, J = 8.2 Hz) 66.54 (1H, s)6.91 (1H, dd, J = 8.2, 1.8 Hz)6.53 (1H, s)6.57 (1H, s) 75.05 (1H, brs)5.07 (1H, overlapped)5.05 (1H, overlapped)5.36 (1H, brs) 83.05 (1H, m)3.06 (1H, m)3.05 (1H, m)2.73 (1H, q, J = 7.3 Hz) 91.36 (1H, d, J = 6.8 Hz)1.35 (1H, d, J = 6.8 Hz)1.40 (1H, d, J = 6.8 Hz)1.22 (1H, d, J = 7.3 Hz) 2′6.21 (1H, s)6.20 (1H, s)6.21 (1H, s) 3′ 5.87 (1H, s) 5′5.71 (1H, s)5.69 (1H, s)5.72 (1H, s) 6′ 5.45 (1H, s) 7′a2.53 (1H, dd, J = 13.2, 7.5 Hz)2.54 (1H, dd, J =13.2, 7.3 Hz)2.52 (2H, d, J =7.3 Hz)2.30 (1H, dd, J =13.5, 8.0 Hz) 7′b2.48 (1H, dd, J = 13.2, 7.3 Hz)2.47 (1H, dd, J =13.2, 7.3 Hz) 2.23 (1H, dd, J =13.5, 6.8 Hz) 8′5.69 (1H, m)5.69 (1H, m)5.70 (1H, m)5.53 (1H, m) 9′a5.07 (2H, m)5.06 (2H, overlapped)5.06 (2H, overlapped)5.03 (1H, dd, J =10.0, 1.3 Hz) 9′b 4.65 (1H, dd, J =17.0, 1.3 Hz) 3-OCH33.88 (3H, s)3.89 (3H, s)3.88 (3H, s)3.89 (3H, s) 4-OCH33.86 (3H, s)3.90 (3H, s)3.85 (3H, s)3.86 (3H, s) 5-OCH33.88 (3H, s) 3.88 (3H, s)3.89 (3H, s) 1′-OCH33.18 (3H, s)3.18 (3H, s)3.14 (3H, s) 5′-OCH3 3.68 (3H, s)
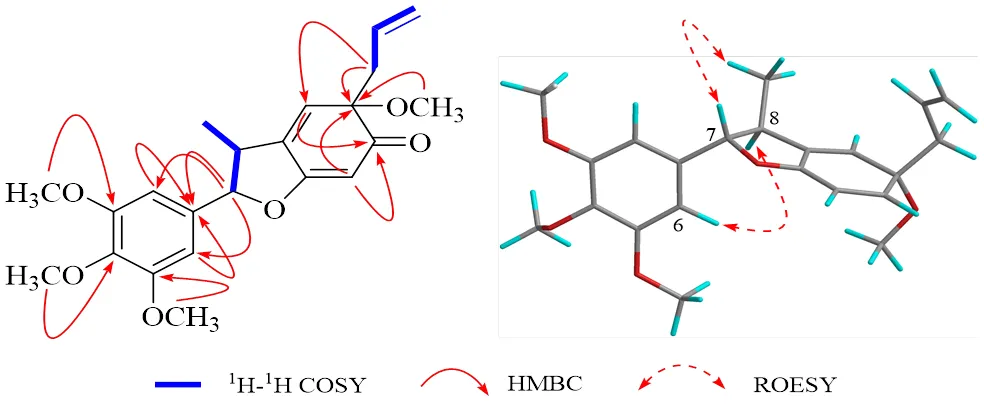
图2 化合物1的主要1H-1H COSY、HMBC和ROESY相关
化合物2和4通过与文献报道的1H-NMR数据进行对比分析,分别鉴定为(7S,8S,1′S)-3,4,1′-三甲氧基-1′,6′-二氢-7,4′-环氧-8,3′-新木脂烷-8′-烯-6′-酮[13]和(7S,8S,1′)-3,4,5,5′-四甲氧基-1′,4′-二氢- 7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮[9],但未见其13C-NMR数据报道。本研究进一步利用HSQC、HMBC、1H-1H COSY、ROESY谱图分析确证了化合物2和4的结构,并首次报道其13C-NMR数据(表2)。
表2 化合物1~4的13C-NMR (CDCl3) 数据
Table 2 13C-NMR (CDCl3) data of compounds 1-4
碳位1 (150 MHz)2 (200 MHz)3 (150 MHz)4 (200 MHz) 1133.3130.0133.4136.5 2103.0108.9103.0101.2 3153.7149.5153.7153.6 4138.6149.8138.6137.4 5153.7111.1153.7153.6 6103.0119.0103.0101.2 793.993.993.992.8 842.442.242.744.6 916.416.116.318.9 1′81.581.580.852.8 2′134.7134.5134.4181.7 3′140.1140.3140.2102.9 4′172.3172.4172.2182.5 5′99.699.599.8152.8 6′200.0200.1199.6108.9 7′45.445.444.946.1 8′131.0131.1131.0131.7 9′119.2119.2119.2120.2 3-OCH356.256.056.256.3 4-OCH360.956.060.961.0 5-OCH356.2 56.256.3 1′-OCH354.053.953.6 5′-OCH3 55.3
化合物5:无色油状物,ESI-MS/:409 [M+Na]+。1H-NMR (800 MHz, CDCl3): 6.48 (2H, s, H-2, 6), 5.83 (1H, s, H-3′), 5.55 (1H, m, H-8′), 5.43 (1H, s,H-6′), 5.18 (1H, d,= 9.9 Hz, H-7), 5.10 (1H, d,= 10.1 Hz, H-9′a), 5.02 (1H, d,= 17.0 Hz, H-9′b), 3.87 (6H, s, 3, 5-OCH3), 3.85 (3H, s, 4-OCH3), 3.69 (3H, s, 5′-OCH3), 2.55 (1H, q,= 6.9 Hz, H-8), 2.35 (1H, dd,= 13.5, 7.4 Hz, H-7′a), 2.30 (1H, dd,= 13.5, 6.9 Hz, H-7′b), 1.18 (3H, d,= 6.9 Hz, H-9);13C-NMR (200 MHz, CDCl3): 133.3 (C-1), 103.5 (C-2, 6), 153.6 (C-3, 5), 138.6 (C-4), 91.2 (C-7), 49.5 (C-8), 8.6 (C-9), 51.0 (C-1′), 181.4 (C-2′), 102.2 (C-3′, 9′), 182.9 (C-4′), 153.5 (C-5′), 107.8 (C-6′), 36.8 (C-7′), 130.9 (C-8′), 56.2 (3, 5-OCH3), 60.9 (4-OCH3), 55.4 (5′-OCH3)。以上数据与文献报道基本一致[14],故鉴定化合物为(7*,8*,1′*)-3,4,5,5′-四甲氧基-1′,4′-二氢-7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮。
化合物6:无色油状物,ESI-MS/:379 [M+Na]+。1H-NMR (800 MHz, CDCl3): 6.87 (2H, brs, H-2, 6), 6.77 (1H, brs, H-5), 5.82 (1H, s, H-3′), 5.55 (1H, m, H-8′), 5.43 (1H, s, H-6′), 5.21 (1H, d,= 9.9 Hz, H-7), 5.09 (1H, d,= 10.5 Hz, H-9′a), 5.01 (1H, d,= 17.0 Hz, H-9′b), 3.88 (3H, s, 3-OCH3), 3.89 (3H, s, 4-OCH3), 3.69 (3H, s, 5′-OCH3), 2.56 (1H, q,= 6.9 Hz, H-8), 2.35 (1H, dd,= 13.6, 7.4 Hz, H-7′a), 2.31 (1H, dd,= 13.6, 6.9 Hz, H-7′b), 1.19 (1H, d,= 6.9 Hz, H-9);13C-NMR (200 MHz, CDCl3): 130.0 (C-1), 109.2 (C-2), 149.4 (C-3, 4), 110.0 (C-5), 120.1 (C-6), 91.2 (C-7), 49.4 (C-8), 8.5 (C-9), 51.0 (C-1′), 181.5 (C-2′), 102.1 (C-3′), 182.9 (C-4′), 153.5 (C-5′), 107.9 (C-6′), 36.7 (C-7′), 130.9 (C-8′), 119.5 (C-9′), 56.0 (3, 4-OCH3), 55.4 (5′-OCH3)。以上数据与文献中报道的数据基本一致[14],故鉴定化合物6为(7*,8*,1′*)-3,4,5′-三甲氧基-1′,4′-二氢- 7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮。
化合物7:无色油状物,ESI-MS/363 [M+Na]+。1H-NMR (500 MHz, CDCl3): 6.81 (1H, d,= 7.8 Hz, H-5), 6.70 (1H, s, H-2), 6.69 (1H, d,= 7.8 Hz, H-6), 5.97 (2H, s, -OCH2O-), 5.92 (1H, d,= 5.1 Hz, H-7), 5.85 (1H, s, H-3′), 5.73 (1H, m, H-8′), 5.49 (1H, s, H-6′), 5.16 (2H, m, H-9′), 5.19 (1H, d,= 10.1 Hz, H-9′a), 5.12(1H, d,= 16.9 Hz, H-9′b), 3.66 (3H, s, 5′-OCH3), 2.68 (2H, m, H-7′a, 8), 2.52 (1H, dd,= 13.7, 6.8 Hz, H-7′b), 0.50 (3H, d,= 7.3 Hz, H-9);13C-NMR (125 MHz, CDCl3): 130.5 (C-1), 106.2 (C-2), 148.0 (C-3), 147.4 (C-4), 109.1 (C-5), 118.9 (C-6), 87.3 (C-7), 44.7 (C-8), 12.1 (C-9), 54.0 (C-1′), 181.5 (C-2′), 102.1 (C-3′), 182.7 (C-4′), 152.9 (C-5′), 108.3 (C-6′), 44.0 (C-7′), 131.8 (C-8′), 120.3 (C-9′), 55.3 (5′-OCH3), 101.3 (-OCH2O-)。以上数据与文献中报道的数据基本一致[13,15],故鉴定化合物7为(7*,8*,1′*)-3,4-亚甲二氧基-5′-甲氧基-1′,4′-二氢- 7,2′-环氧-8,1′-新木脂烷-8′-烯-4′-酮。
化合物8:无色油状物,ESI-MS/:411 [M+Na]+。1H-NMR (500 MHz, acetone-6): 6.97 (1H, s, H-2′), 6.94 (1H, s, H-6′), 6.74 (2H, s, H-2, 6), 6.52 (1H, d,= 15.8 Hz, H-7′), 6.23 (1H, td,= 15.8, 5.5 Hz, H-8′), 5.54 (1H, d,= 6.8 Hz, H-7), 3.86 (3H, s, 3′-OCH3), 3.79 (3H, s, 2, 6-OCH3), 4.19 (2H, d,= 5.6, Hz, H-9′a), 3.82 (2H, m, H-9′), 3.54 (1H, m, H-8);13C-NMR (125 MHz, acetone-6): 133.3 (C-1), 104.5 (C-2, 6), 148.7 (C-3, 5), 136.7 (C-4), 88.7 (C-7), 54.8 (C-8), 64.5 (C-9), 131.9 (C-1ʹ), 116.0 (C-2ʹ), 130.4 (C-3ʹ), 148.9 (C-4ʹ), 145.1 (C-5ʹ), 111.7 (C-6ʹ), 130.5 (C-7ʹ), 128.4 (C-8ʹ), 63.4 (C-9ʹ), 56.6 (3′, 5′-OCH3), 56.4 (3-OCH3)。以上数据与文献中报道的数据基本一致[16],故鉴定化合物8为simulanol。
化合物9:白色粉末,ESI-MS/:383 [M+Na]+。1H NMR (500 MHz, acetone-6): 6.95 (1H, s, H-2), 6.80 (2H, m, H-5, 6), 6.78 (1H, s, H-2′), 6.74 (1H, d,= 8.0 Hz, H-5′), 6.66 (21H, dd,= 8.0, 1.2 Hz, H-6′), 4.80 (1H, d,= 6.3 Hz, H-7), 3.96 (1H, m, H-9′a), 3.87 (1H, m, H-9a), 3.79 (s, 3-OCH3), 3.78 (s, 3′-OCH3), 3.68 (2H, m, H-9b, 9′b);13C NMR (125 MHz, acetone-6): 136.5 (C-1), 110.2 (C-2), 148.2 (C-3), 146.4 (C-4), 115.4 (C-5), 119.3 (C-6), 83.2 (C-7), 53.9 (C-8), 60.4 (C-9), 133.4 (C-1′), 113.0 (C-2′), 148.1 (C-3′), 145.6 (C-4′), 115.7 (C-5′), 121.9 (C-6′), 33.5 (C-7′), 43.4 (C-8′), 73.1 (C-9′), 56.2 (3, 3′-OCH3)。以上数据与文献中报道数据基本一致[17],故鉴定化合物9为落叶松树脂醇。
化合物10:白色粉末,ESI-MS/:413 [M+Na]+。1H-NMR (500 MHz, acetone-6): 6.82 (1H, d,= 1.8 Hz, H-2′), 6.73 (1H, d,= 8.0 Hz, H-5′), 6.65 (1H, dd,= 8.0, 1.8 Hz, H-6′), 6.63 (2H, s, H-2, 6), 4.80 (1H, d,= 6.0 Hz, H-7), 3.95 (1H, dd,= 8.2, 6.7 Hz, H-9′a), 3.86 (1H, m, H-9a), 3.81 (6H, s, 3′-OCH3), 3.79 (6H, s, 3, 5-OCH3), 3.70 (1H, dd,= 6.3, 4.2 Hz, H-9b), 3.67 (1H, dd,= 8.2, 8.0 Hz, H-9′b);13C-NMR (125 MHz, acetone-6): 135.6 (C-1), 104.0 (C-2, 6), 148.5 (C-3, 5), 135.7 (C-4), 83.4 (C-7), 53.9 (C-8), 60.4 (C-9), 133.3 (C-1′), 113.0 (C-2′), 148.2 (C-3′), 145.6 (C-4′), 115.7 (C-5′), 121.8 (C-6′), 33.5 (C-7′), 43.4 (C-8′), 73.1 (C-9′), 56.5 (3, 5-OCH3), 56.2 (3′-OCH3)。以上数据与文献中报道的数据基本一致[18],故鉴定化合物10为5′-甲氧基落叶松树脂醇。
化合物11:白色粉末,ESI-MS/:443 [M+Na]+。1H-NMR (500 MHz, acetone-6): 6.63 (2H, m, H-2, 6), 6.51 (2H, s, H-2′, 6′), 4.78 (1H, d,= 6.1 Hz, H-7), 3.95 (1H, dd,= 8.2, 6.7 Hz, H-9′a), 3.85 (1H, m, H-9a), 3.79 (12H, s, 3, 5, 3′, 5′-OCH3), 3.68 (2H, m, H-9b, 9′b);13C-NMR (125 MHz, acetone-6): 135.0 (C-1), 104.1 (C-2, 6), 148.5 (C-3, 5), 135.8 (C-4), 34.0 (C-7), 54.0 (C-8), 83.4 (C-9), 132.4 (C-1′), 106.9 (C-2′, 6′), 135.6 (C-4), 148.6 (C-3′, 5′), 73.1 (C-7′), 43.3 (C-8′), 60.4 (C-9′), 56.6 (3, 5, 3′, 5′-OCH3)。以上数据与文献中报道的数据基本一致[19],故鉴定化合物11为5,5′-二甲氧基落叶松树脂醇。
化合物12:无色油状物,ESI-MS/:381 [M+Na]+。1H-NMR (500 MHz, CDCl3): 6.83~7.00 (6H, m, H-2, 2′, 5, 5′, 6, 6′), 4.50 (2H, d,= 6.2 Hz, H-7), 3.88 (6H, s, 3, 3′-OCH3), 3.87 (3H, s, 4-OCH3), 2.23 (1H, m, H-8, 8′), 1.03 (3H, d,= 6.4 Hz, H-9), 1.04 (3H, d,= 6.4 Hz, H-9′);13C-NMR (125 MHz, CDCl3): 134.8 (C-1), 109.8 (C-2), 148.9 (C-3), 148.5 (C-4), 110.9 (C-5), 118.6 (C-6), 87.3 (C-7), 44.4 (C-8), 13.0 (C-9), 134.2 (C-1′), 109.2 (C-2′), 146.5 (C-3′), 145.1 (C-4′), 114.2 (C-5′), 119.3 (C-6′), 87.4 (C-7′), 44.3 (C-8′), 12.9 (C-9′), 55.9 (3-OCH3), 56.0 (4-OCH3), 55.8 (3′-OCH3)。以上数据与文献报道的数据基本一致[20],故鉴定化合物12为nectandrin A。
化合物13:白色粉末,ESI-MS/:367 [M+Na]+。1H-NMR (500 MHz, CDCl3): 6.96 (2H, d,= 1.5 Hz, H-2, 2′), 6.92 (2H, dd,= 8.0, 1.5 Hz, H-6, 6′), 6.89 (1H, d,= 8.0 Hz, H-5), 5.58 (2H, d,= 6.3 Hz, H-7, 7′), 2.32 (2H, m, H-8, 8′), 1.03 (6H, d,= 6.4 Hz, H-9, 9′);13C-NMR (125 MHz, CDCl3): 134.2 (C-1), 109.2 (C-2, 2′), 146.5 (C-3, 3′), 145.0 (C-4, 4′), 114.1 (C-5, 5′), 119.3 (C-6, 6′), 87.4 (C-7, 7′), 44.3 (C-8, 8′), 12.9 (C-9, 9′), 55.9 (3, 3′-OCH3)。以上数据与文献中报道的数据基本一致[21],故鉴定化合物13为nectandrin B。
化合物14:白色粉末, ESI-MS/:411 [M+Na]+。1H-NMR (800 MHz, CDCl3): 6.90 (1H, d,= 1.9 Hz, H-2′), 6.89 (1H, d,= 8.1 Hz, H-6′), 6.82 (1H, dd,= 8.1, 1.6 Hz, H-5′), 6.58 (2H, s, H-2, 6), 4.75 (1H, d,= 4.9 Hz, H-7′), 4.72 (1H, d,= 4.9 Hz, H-7), 4.26 (2H, m, H-9a, 9′a), 3.89 (2H, m, H-9b, 9′b), 3.10 (2H, m, H-8, 8′), 3.90 (3H, s, 3′-OCH3), 3.91 (6H, s, 3, 5-OCH3);13C-NMR (200 MHz, CDCl3): 132.1 (C-1), 102.7 (C-2, 6), 147.1 (C-3, 5), 134.2 (C-4), 86.1 (C-7), 54.1 (C-8), 71.9 (C-9), 132.9 (C-1′), 108.6 (C-2′), 146.7 (C-3′), 145.2 (C-4′), 114.2 (C-5′), 118.9 (C-6′), 85.8 (C-7′), 54.4 (C-8′), 71.6 (C-9′), 56.0 (3′-OCH3), 56.4 (3, 5-OCH3)。以上数据与文献中报道的数据基本一致[22],故鉴定化合物14为杜仲树脂酚。
化合物15:白色粉末,ESI-MS/:441 [M+Na]+。1H-NMR (600 MHz, CDCl3): 6.57 (4H, s, H-2, 2′, 6, 6′), 4.73 (2H, d,= 3.3 Hz, H-7, 7′), 4.28 (2H, m, H-9a, 9′a), 3.90 (2H, m, H-9b, 9′b), 3.09 (2H, s, H-8, 8′), 3.89 (12H, s, 3, 3′, 5, 5′-OCH3);13C-NMR (150 MHz, CDCl3): 132.0 (C-1, 1′), 102.6 (C-2, 2′, 6, 6′), 147.1 (C-3, 3′, 5, 5′), 134.2 (C-4, 4′), 86.0 (C-7, 7′), 54.3 (C-8, 8′), 71.8 (C-9, 9′), 56.3 (3, 3′, 5, 5′-OCH3)。以上数据与文献中报道的数据基本一致[23],故鉴定化合物15为丁香脂素。
化合物16:白色粉末, ESI-MS/:381 [M+Na]+。1H-NMR (800 MHz, CDCl3): 6.90 (2H, d,= 1.5 Hz, H-2, 2′), 6.89 (2H, d,= 8.1 Hz, H-6, 6′), 6.82 (2H, dd,= 8.1, 1.5 Hz, H-5, 5′), 4.74 (2H, d,= 4.2 Hz, H-7, 7′), 4.24 (2H, m, H-9a, 9′a), 3.88 (2H, dd,= 9.3, 3.7 Hz, H-9b, 9′b), 3.10 (2H, dd,= 6.4 , 4.7 Hz, H-8, 8′), 3.91 (6H, s, 3, 3′-OCH3);13C-NMR (200 MHz, CDCl3): 132.9 (C-1, 1′), 108.6 (C-2, 2′), 146.7 (C-3, 3′), 145.2 (C-4, 4′), 114.2 (C-5, 5′), 119.0 (C-6, 6′), 85.9 (C-7, 7′), 54.2 (C-8, 8′), 71.7 (C-9, 9′), 56.0 (3, 3′-OCH3)。以上数据与文献中报道的数据基本一致[23],故鉴定化合物16为松脂醇。
4 抗炎活性结果
利用LPS诱导小鼠RAW 264.7巨噬细胞释放炎症介质NO模型,对化合物1~16进行抗炎活性评价(表3)。采用MTS实验测试所有化合物对RAW 264.7细胞活力的影响,实验结果表明所有测试化合物在50 μmol/L浓度下对细胞生长无影响,细胞存活率均大于90%。进一步对化合物1~16进行NO生成抑制活性评价,结果显示化合物8、10、11、13和16具有显著的抑制活性,其IC50值分别为(8.38±0.07)、(16.24±0.35)、(22.71±1.30)、(21.68±0.72)、(19.74±0.39)μmol/L。其余化合物对LPS诱导的RAW 264. 7巨噬细胞释放炎症介质NO抑制作用很弱,其IC50值大于50 μmol/L。
表3 化合物对LPS诱导的RAW264.7细胞释放炎症介质NO的抑制活性()
Table 3 Inhibitory effects of compounds on LPS-induced NO production in RAW264.7 cells()
化合物50 μmol·L−1下细胞存活率/%IC50/(μmol·L−1) 8 99.41±1.38 8.38±0.07 10101.91±0.6316.24±0.35 11 99.20±1.0922.71±1.30 13 96.91±0.6021.68±0.72 16102.14±2.5619.74±0.39 L-NMMA100.24±2.8935.39±1.17
5 讨论
本研究采用多种色谱方法从紫玉兰叶的95%乙醇提取物中分离得到16个木脂素类化合物,包括8个苯并呋喃型木脂素(1~8)、5个四氢呋喃型木脂素(9~13)和3个双四氢呋喃型木脂素(14~16),丰富了紫玉兰中化合物结构类型。通过活性评价发现化合物8、10、11、13和16具有显著的抗炎活性,初步阐明紫玉兰民间作为镇痛消炎剂的药效物质基础,为进一步研究紫玉兰药效物质和促进其综合利用奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1996: 140-141.
[2] 江苏省植物研究所, 中国医学科学院药物研究所, 中国科学院昆明植物研究所. 新华本草纲要 (第一册) [M]. 上海: 上海科学技术出版社, 1988: 58.
[3] Iida T, Ito K. Four phenolic neolignans from[J]., 1983, 22(3): 763-766.
[4] 刘婷婷, 武海波, 王文蜀, 等. 畲药紫玉兰花蕾化学成分研究 [J]. 中草药, 2013, 44(11): 1397-1399.
[5] Talapatra B, Chaudhuri P K, Talapatra S K. (−)-Maglifloenone, a novel spirocyclohexadienone neolignan and other constituents from[J]., 1982, 21(3): 747-750.
[6] Wang W S, Lan X C, Wu H B,. Lignans from the flower buds ofDesr [J]., 2012, 78(2): 141-147.
[7] Wu H B, Liu T T, Zhang Z X,. Leaves ofDesr. as a high-potential by-product: Lignans composition, antioxidant, anti-inflammatory, anti- phytopathogenic fungal and phytotoxic activities [J]., 2018, 125: 416-424.
[8] Bajpai V K, Yoon J I, Kang S C. Antioxidant and antidermatophytic activities of essential oil and extracts ofDesr [J]., 2009, 47(10): 2606-2612.
[9] Aiba C J, Fernandes J B, Gottlieb O R,. Neolignans from anspecies [J]., 1975, 14(7): 1597-1604.
[10] Wenkert E, Gottlieb H E, Gottlieb O R,.13C NMR spectroscopy of neolignans [J]., 1976, 15(10): 1547-1551.
[11] Li J, Tanaka M, Kurasawa K,. Lignan and neolignan derivatives from[J].(), 2005, 53(2): 235-237.
[12] Kuroyanagi M, Yoshida K, Yamamoto A,. Bicyclo [3.2.1]octane and 6-oxabicyclo[3.2.2]nonane type neolignans from[J].(), 2000, 48(6): 832-837.
[13] de H Cavalcante S, Giesbrecht A M, Gottlieb O R,. Lanthanide shift reagents in neolignan analysis: Revision of structure of canellin-B [J]., 1978, 17(5): 983-985.
[14] Filho R B, Figliuolo R, Gottlieb O R. Neolignans from aspecies [J]., 1980, 19(4): 659-662.
[15] Nguyen T T M, Nguyen T T, Lee H S,. Neolignan derivatives from the flower ofpamp. and their effects on IL-2 expression in T-cells [J]., 2017, 23(2): 119.
[16] Zhu J X, Ren J, Qin J J,. Phenylpropanoids and lignanoids from[J]., 2012, 35(10): 1739-1747.
[17] Xie L H, Akao T, Hamasaki K,. Biotransformation of pinoresinol diglucoside to mammalian lignans by human intestinal microflora, and isolation ofstrain PDG-1 responsible for the transformation of (+)-pinoresinol to (+)-lariciresinol [J]., 2003, 51(5): 508-515.
[18] Duh C Y, Phoebe C H Jr, Pezzuto J M,. Plant anticancer agents, XLII. cytotoxic constituents from[J]., 1986, 49(4): 706-709.
[19] Ida Y, Satoh Y, Ohtsuka M,. Phenolic constituents ofbark [J]., 1993, 35(1): 209-215.
[20] Morais S K R, Teixeira A F, Torres Z E D S,. Biological activities of lignoids from Amazon Myristicaceae species:, V. mollissima, V. pavonis and[J]., 2009, 20(6): 1110-1118.
[21] Hattori M, Hada S, Kawata Y,. New 2, 5-bis-aryl-3, 4-dimethyltetrahydrofuran lignans from the aril of[J]., 1987, 35(8): 3315-3322.
[22] 李玉洁, 唐浩轩, 李娟, 等. 红树植物瓶花木枝叶中化学成分研究 [J]. 中草药, 2019, 50(23): 5677-5682.
[23] 谢章巧, 丁林芬, 王德升, 等. 山玉兰叶化学成分研究 [J]. 中草药, 2018, 49(21): 5040-5045.
Lignans from leaves ofand their anti-inflammatory activities
DING Lin-fen1, LIU Jia3, SONG Jing-feng1, LEI Tie1, NIE Wei1, SONG Liu-dong1, WU Xing-de2, 4
1. Yunnan Key Laboratory of Pharmacology for Natural Products, School of Pharmaceutical Science, Kunming Medical University, Kunming 650500, China 2. Key Laboratory of Ethnic Medicine Resource Chemistry, State Ethnic Affairs Commission & Ministry of Education, Yunnan Minzu University, Kunming, 650500, China 3. Haiyuan College, Kunming Medical University, Kunming 650101, China 4. State Key Laboratroy of Phytochemistry and Plant Resources in Western China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China
To study the lignans fromand their anti-inflammatory activities.Chemical constituents were separated and purified by column chromatography on silica gel, MCI gel, Sephadex LH-20, and semepreparative HPLC. The structures were characterized via spectroscopic data analysis. All isolated compounds were evaluated their inhibitory activity on lipopolysaccharide (LPS) induced nitric oxide (NO) production in RAW 264.7 macrophages.Sixteen compounds were isolated from 95% ethanol extract of. Their structures were identified as burcellin (1), (7S,8S,1′S)-3,4,1′-trimethoxy-1′,6′-dihydro-7,4′-epoxy-8,3′-neoligna-8′-en-6′-one (2), (7S,8S,1′R)-3,4,5,1′-tetramethoxy-1′,6′- dihydro-7,4′-epoxy-8,3′-neoligna-8′-en-6′-one (3), (7S,8S,1′S)-3,4,5,5′-tetramethoxy-1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna-8′-en- 4′-one (4), (7S,8S,1′R)-3,4,5,5′-tetramethoxy-1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna-8′-en-4′-one (5), (7R,8S,1′S)-3,4,5′- trimethoxy-1′,4′-dihydro-7,2′-epoxy-8,1′-neoligna-8′-en-4′-one (6), (7S,8S,1′R)-3,4-methylenedioxy-5′-methoxy-1′,4′-dihydro- 7,2′-epoxy-8,1′-neoligna-8′-en-4′-one (7), simulanol (8), lariciresinol (9), 5′-methoxylariciresinol (10), 5,5′-dimethoxylariciresinol (11), nectandrin A (12), nectandrin B (13), medioresinol (14), syringaresinol (15), pinoresinol (16). Compounds 8, 10, 11, 13, and 16 displayed potent NO inhibitory activities, with IC50values of (8.38 ± 0.07), (16.24 ± 0.35), (22.71 ± 1.30), (21.68 ± 0.72), and (19.74 ± 0.39) μmol/L, respectively.Compounds 2, 4—6, 8, 10, 11, and 13 are isolated from the genus offor the first time. All compounds were obtained fromfor the first time. The1H- and13C-NMR spectroscopic data of 1 was reported for the first time. In addition, the13C-NMR spectroscopic data of 2 and 4 were also reported for the first time. Compounds 8, 10, 11, 13, and 16 indicate their potential anti-inflammatory effects.
Linn.;Desr.; lignans; anti-inflammatory activity; burcellin; (7S,8S,1′S)-3,4,1′-trimethoxy- 1′,6′-dihydro-7,4′-epoxy-8,3′-neoligna-8′-en-6′-one; 5′-methoxylariciresinol
R284.1
A
0253 - 2670(2022)13 - 3912 - 08
10.7501/j.issn.0253-2670.2022.13.004
2022-02-11
云南省科技厅-昆明医科大学应用基础研究联合专项基金资助项目(2019FE001-028);云南省教育厅科学研究基金项目(2021J0876);云南省万人计划“教学名师”(宋流东)资助项目;云南省创新团队(202005AE160004)
丁林芬(1985—),女,博士,高级实验师,从事天然药物化学研究。E-mail: dinglinfen@kmmu.edu.cn
吴兴德(1984—),男,博士,副研究员,从事天然药物化学研究。E- mail: wuxingde@mail.kib.ac.cn
宋流东(1966—),男,教授,博士生导师,从事天然药物化学研究。E-mail: ynsld@126.com
#共同第一作者:刘 佳(1983—),女,副教授,从事天然药物化学和药剂学研究。E-mail: 1020674159@qq.com
[责任编辑 王文倩]

