金线莲组培苗快速培养研究
王跃华,吴佳琪,王习著,胡 域,刘真珍,魏博坤,阎婷婷
(1.成都大学 食品与生物工程学院,四川 成都 610106; 2.湖北省浠水县农业农村局,湖北 黄冈 438200)
0 引 言
金线莲(Anoectochilusroxburghii(Wall.) Lindl.)又名金线兰、金丝草,为兰科开唇兰属多年生草本植物,具有镇咳、清热与止痛等功效[1-2].在自然环境中,金线莲种子的萌发需要相关真菌伴生,自然萌发率较低[3],而且金线莲的适应性较差,对生长环境要求十分苛刻.近年来,人为过量采挖,造成金线莲植物赖以生存的环境条件被破坏,野生金线莲资源锐减[4].本研究采用生物工程的组织培育技术,筛选出金线莲愈伤诱导组织、不定芽诱导分化和无根苗壮苗生根的最佳培养基配方,最终建立金线莲再生植株的快速繁育体系,为金线莲植物的快速繁殖及大规模栽种提供理论依据及技术支持.
1 材料与方法
1.1 材 料
实验所用金线莲采自四川省都江堰市,经鉴定为兰科(Orchidaceae)开唇兰属的金线莲(Anoectochilusroxburghii(Wall.) Lindl.).
1.2 方 法
1.2.1 不同外植体诱导愈伤组织
选取生长健壮的金线莲植物,放在超净工作台上用75%乙醇消毒10 s后,用无菌水冲洗3次,再放入0.1%的氯化汞中消毒8 min后,用无菌水冲洗3次,吸干水分后,切取叶柄、叶片、根、茎和芽各器官作为外植体,接入1/2 MS +NAA 0.6 mg/L+6-BA 1 mg/L的培养基中进行愈伤组织诱导.
1.2.2 不同激素配比对叶柄诱导愈伤组织的影响
以金线莲叶柄为外植体,采用L9(33)正交试验进一步筛选出不同激素配比对叶柄诱导愈伤组织的影响,具体因素水平见表1.

表1 诱导愈伤组织因素水平表
1.2.3 不同激素对愈伤组织诱导分化不定芽的影响
选取由“1.2.2”项下叶柄诱导获得的质地较紧致愈伤组织,将其切成0.5 cm3大小接种到表2诱导不定芽的培养基中进行诱导培养.

表2 诱导不定芽因素水平表
1.2.4 不同激素对无根苗壮苗生根的影响
选取由“1.2.3”项下培养的生长1.5~2 cm的不定芽为无根苗,接入以1/2 MS+活性炭1 g/L为基本培养基,并分别添加了不同浓度的6-BA和NAA,在温度为(23±2)℃,光照强度为1 500~2 000 lx和光照时间为12 h/d的条件下诱导生根培养.
1.2.5 炼苗与移栽
在培养室中,将组培瓶盖打开放置12 h后,选取生长有3~5片叶,苗高在4 cm以上的组培苗,用水冲洗掉根部的培养基后,移栽到育苗盆中,在温度(20±2)℃,相对湿度在90%左右和光照强度为400 lx的条件下培养.
1.3 计算方法
愈伤组织诱导率=(诱导愈伤组织数/接种外植体数)×100%
不定芽诱导率=(产生不定芽数/接种外植体数)×100%
生根率=(生根数/接种数)×100%
存活率=(存活的外植体数/移栽组培苗数)×100%
2 结果与分析
2.1 不同外植体诱导愈伤组织
采用叶片、叶柄、根、茎和芽作为外植体,接入在1/2 MS +NAA 0.6 mg/L+6-BA 1 mg/L的培养基中,培养40 d后统计愈伤组织诱导率结果见表3.

表3 不同外植体诱导愈伤组织结果
由表3可知,以上5种外植体中,仅有叶柄和茎能诱导出愈伤组织,而其他部位的外植体都未能成功诱导出愈伤组织.
通过观察可知,各外植体接入培养基后,随着培养时间的增加,出现了各种不同的情况.首先根外植体在接入培养基4 d后就出现了褐化情况,随着培养时间的延长,根外植体褐化严重逐渐开始死亡;芽外植体接入培养基后,没有出现愈伤化进一步产生愈伤组织,而表现出明显的抽芽现象;叶片接入培养基后,最初出现叶缘卷曲现象,但随着培养时间的增加,叶片外植体变黄逐渐产生死亡;茎外植体在接入培养基13 d后,在茎着生叶的节处开始产生白色的愈伤组织,随着培养时间延长,愈伤组织颜色由白色逐渐变为绿色,培养40 d后统计愈伤组织的诱导率为20.3%;叶柄外植体在接入培养基10 d后,从叶柄的两端开始膨大,培养40 d后统计愈伤组织的诱导率为32.5%.
2.2 不同激素配比对叶柄诱导愈伤组织的影响
在超净工作台上,将消毒后的金线莲叶柄接入以1/2 MS为基本培养基,添加了不同浓度的NAA、ZT 和6-BA 组成的三因素三水平培养基中,培养50 d后统计结果见表4.
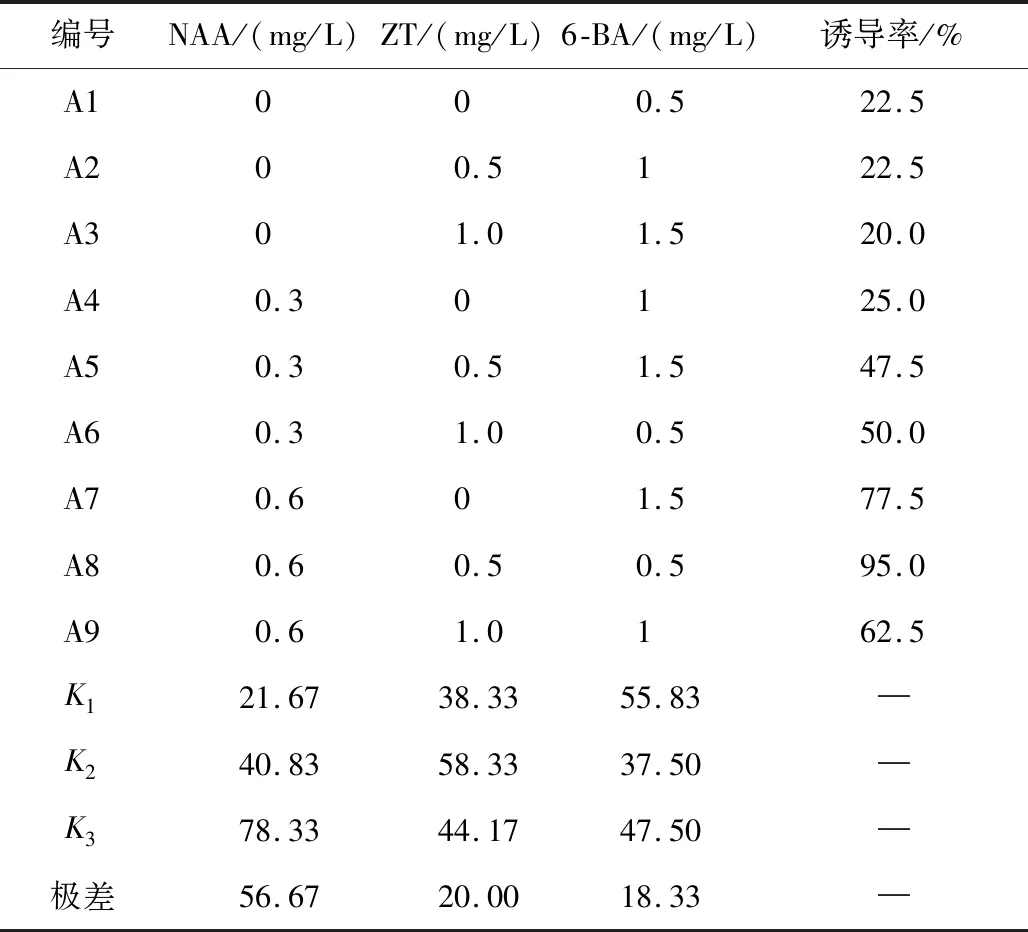
表4 不同激素配比诱导叶柄产生愈伤组织结果
由表4可知,不同浓度激素配比对叶柄愈伤组织诱导有明显的影响作用.A8组培养基配方1/2 MS+NAA 0.6 mg/L+ZT 0.5 mg/L+6-BA 0.5 mg/L,在50 d后统计愈伤组织诱导率为95.0%,且产生的愈伤组织生长速度快,质地坚硬,如图1所示.

图1 叶柄诱导愈伤组织
由极差分析可知, NAA的极差值为56.67,ZT的极差值为20.00,6-BA的极差值为18.33,由此可见NAA对叶柄诱导愈伤组织的影响最显著,3个因素中影响最大的是NAA,其次是ZT,6-BA影响最小.3个因素的方差分析见表5.
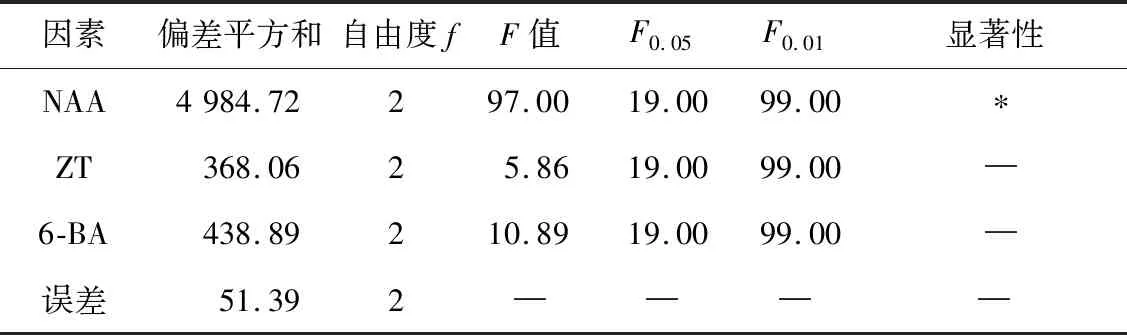
表5 方差分析表
由表5可知,在研究的3个因素中,NAA的检验值F=97.00,F0.05=19.00,F0.01=99.00,即F0.05
2.3 不同激素对愈伤组织诱导分化不定芽的影响
选取叶柄诱导获得的质地紧致愈伤组织接入不定芽诱导培养基中,30 d后统计结果见表6.
由表6可知,不同激素配比对愈伤组织诱导分化不定芽的影响效果不同.B9组培养基配方1/2 MS+ZT 0.4 mg/L+ NAA 0.5 mg/L+6-BA 1.5 mg/L是愈伤组织诱导产生不定芽的最佳培养基,30 d后统计不定芽的诱导率达93%.通过观察发现,B9组培养基中生长12 d后,在愈伤组织表面开始有黄白色的小芽产生,随着培养时间的延长,小芽逐渐长大,颜色也由黄白色开始变为黄绿色,培养30 d后小芽长出嫩绿色的叶片,如图2所示.
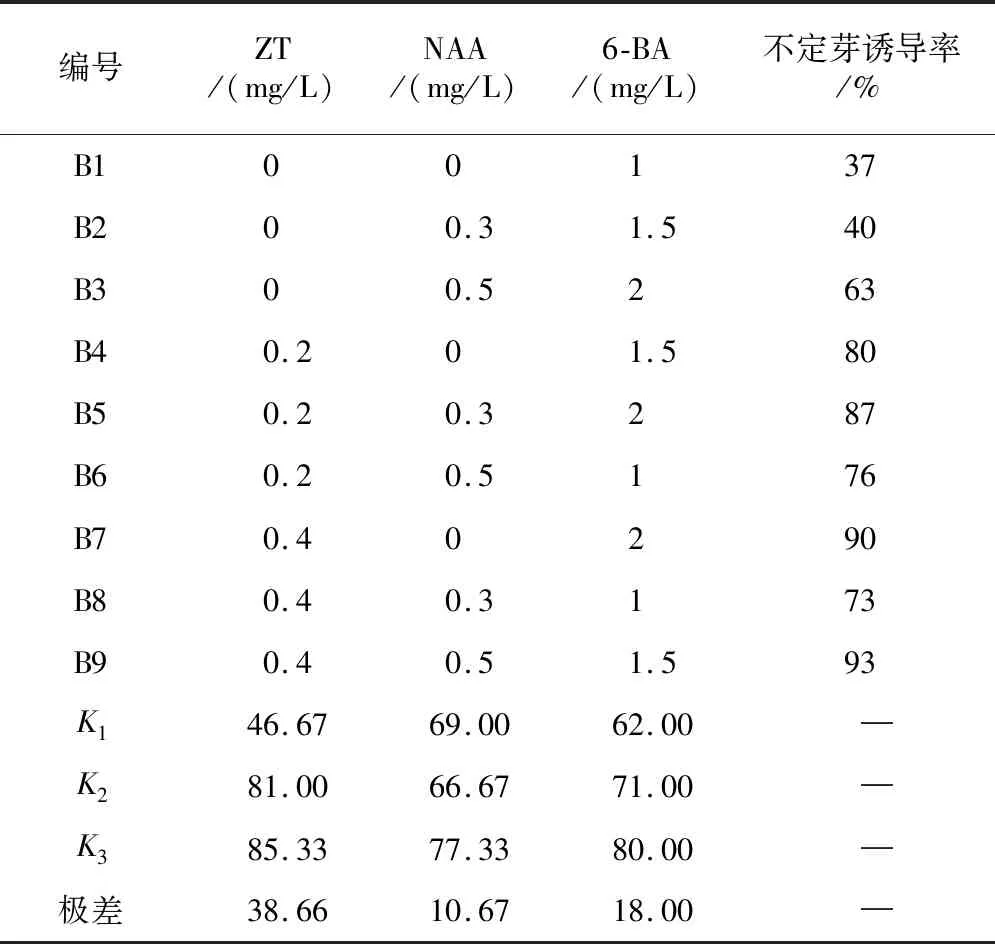
表6 不定芽诱导结果

图2 不定芽诱导产生
由表6可知,ZT的极差值为38.66,NAA的极差值为10.67,6-BA的极差值为18.00,由此可见,ZT对愈伤组织诱导分化不定芽的影响最显著,3个因素影响大小依次是ZT>6-BA>NAA.3个因素的方差分析见表7.

表7 方差分析表
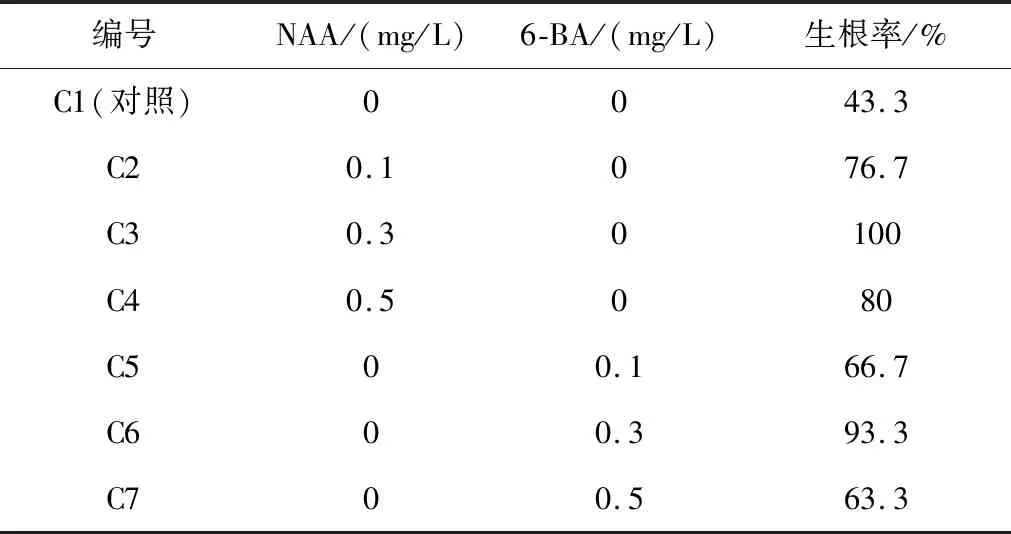
由表7可知,ZT的检验值F=109.16,F0.01=99.00,检验值F>F0.01,说明ZT对不定芽诱导有极显著影响(P<0.01);6-BA的检验值F=19.70,F0.05=19.00,F0.01=99.00,即F0.05 综合各因素的检验值分析,可以得出对不定芽诱导最显著的因素是ZT,其次是6-BA,此结果与极差分析结果一致. 切取生长1.5~2 cm的不定芽为无根苗,接入壮苗生根培养基中,30 d后统计结果见表8. 表8 无根苗生根培养结果 由表8可知,C1(对照组)在培养基中不添加任何激素的情况下,培养30 d后统计生根率最低仅为43.3%,这说明在培养基中添加NAA和6-BA两组激素对无根苗的壮苗生根具有不同程度的促进作用.C3组(NAA浓度为0.3 mg/L)和C6组(6-BA浓度为0.3 mg/L)的生根率都是最高,分别为100%和93.3%,其中激素NAA对生根的促进作用强于6-BA. C3组不定芽接入培养基10 d后,在金线莲无根苗的下部节处开始长出带有白色绒毛的不定根,并随着培养时间的延长,不定根快速生长,插入培养基中,其颜色也逐渐变为黄绿色,如图3所示. 图3 培养基C3组培苗 本实验结果可知,金线莲不定芽壮苗生根的最佳培养基是1/2 MS+活性炭1 g/L+NAA 0.3 mg/L,培养40 d统计生根率为100%,且组培苗长势健壮. 何碧珠等[5]通过实验研究表明,金线莲移栽时应选用茎粗,具有2~4条根系且长势优良的植株,不但能有效提高植株对外界的适应性,还能保证较高的成活率.本研究选取根和茎生长健壮,并长有3~5片叶,且苗高在4 cm以上的组培苗,用水冲洗掉根部的培养基后,移栽到装有草炭泥和锯末(1∶1)组成的育苗盆中,在温度(20±2)℃,相对湿度在90%左右和光照强度为400 lx的条件下培养. 在移栽25 d后,统计金线莲苗的存活率为88%.金线莲是典型的阴性植物,对其生长的环境(如温度与光照等)要求较高[6].在培育时,应保持土壤适当湿润,注意控制光照时间和强度.也有研究表明,为保证金线莲组培苗的成活率和栽种成本,金线莲在移栽时使用的基质以树皮最好,因其具有较好的透气性、表面易干和成本低等优点[7]. 明代《本草纲目》记载,金线莲全草可入药,具清热凉血、护肝、生津养颜、除湿解毒与扶正固本等功效.随着近年来对其化学成分的研究,其药理作用也逐渐得到科研人员的重视.经大量研究发现,金线莲的药理作用包括抗肿瘤、降血糖、保肝、抗乙型肝炎病毒、免疫调节、降血压、血管保护、抗感染和抗氧化等[8-9]. 金线莲不仅在医疗保健与美容行业等领域得到广泛开发应用,而且由于其株型小巧美观,因此被人们当成一种观赏价值极高的观叶珍品[10].为了解决金线莲不断扩大的市场需求量,本研究利用生物工程技术,通过诱导金线莲植物外植体脱分化和再分化形成不定芽和不定根过程,快速地培育出大量金线莲优质种苗,建立金线莲植物快速培养体系,解决了当前金线莲种苗严重短缺的问题,为金线莲产业健康发展提供了技术保障.2.4 不同激素对无根苗壮苗生根的影响

2.5 炼苗与移栽
3 讨 论

