不同宿主来源猬迭宫绦虫线粒体pcox1、pcox3和prrnS基因的系统发育分析
贺峻琳,龚腾芳,谢馨锐,李文超,陈叔玉,李 芬,刘 伟
(湖南农业大学动物医学院,湖南 长沙 410128)
裂头蚴病(Sparganosis)是由迭宫属绦虫裂头蚴引起的人畜共患绦虫蚴病,迄今为止已报道2 000 多例病例[1],主要集中在东亚和东南亚[2]。迭宫属绦虫在人体内一般以原尾蚴或裂头蚴的形式存在,可导致皮下裂头蚴病、内脏裂头蚴病、眼裂头蚴病、脑裂头蚴病等[1-3]。但在某些情况下,幼虫可能会在人体肠道内发育成熟,而被误认为是阔节裂头绦虫病[1]。
猬迭宫绦虫(Spirometra erinaceieuropaei)的分类学地位一直有较大争议,目前迭宫属绦虫有64 个名义种,但只有4 个种有效[4]。虽然传统形态学是鉴定寄生虫的主要方法,但由于环境变化和宿主差异,传统形态学方法鉴定寄生虫尤其是形态相似的虫株存在一定缺陷。线粒体DNA 具有结构简单、母系遗传、进化速度快等优点,已经广泛应用于寄生虫的鉴定和分类[5-7]。目前国内外学者将线粒体全基因组或其cox1、cox3、nad1、nad4、nad5、cytb、rrnS 以及核糖体28S rDNA、18S rDNA、ITS 等基因用于迭宫属绦虫种类鉴定和种内遗传变异研究[5,8,9-11],但国内关于不同宿主猬迭宫绦虫线粒体基因遗传变异的研究较少。鉴于此,本研究对采自7种宿主体内的猬迭宫绦虫或中绦期裂头蚴线粒体pcox1、pcox3和prrnS基因经PCR 扩增,通过分析不同宿主来源的pcox1、pcox3 和prrnS 基因序列的同源性、多样性及不同宿主的猬迭宫绦虫与其他绦虫的遗传进化关系,为猬迭宫绦虫分类学和种群遗传关系研究提供数据支持。
1 材料与方法
1.1 样品来源本实验的7 株猬迭宫绦虫或中绦期裂头蚴样品中,3 株猬迭宫绦虫裂头蚴样品分别采自湖南省不同地区的黑眉锦蛇(Elaphe taeniura)、王锦蛇(Elaphe carinata)、乌梢蛇(Ptyas dhumnades);4 株猬迭宫绦虫样品分别采自湖南省长沙市生态动物园的西伯利亚虎(Panthera tigrisssp.altaica)、白化孟加拉虎(Panthera tigrisssp.tigris)、豹猫(Prionailurus bengalensis)和湖南省长沙市宠物医院的家猫小肠内,虫体洗涤后置于70%乙醇于-20 ℃保存。
1.2 主要试剂组织DNA 提取试剂盒购自天根生化科技(北京)有限公司;蛋白酶K 购自Merck 公司;TaqDNA 聚合酶及相关试剂购自宝生物工程(大连)有限公司。
1.3 虫体DNA 的提取将7 株虫体分别剪成2 cm~3 cm,并用双蒸水洗涤5 min,重复6次。将洗涤后的虫体置于1.5 mL 离心管中,加入20 μL 蛋白酶K 混匀,56 ℃恒温消化1 h~3 h后提取虫株基因组DNA备用。
1.4 线粒体pcox1、pcox3 和prrnS 基因的PCR 扩增及测序按照参考文献并由北京擎科新业生物技术有限公司合成3对引物用于pcox1[6]、pcox3[12]和prrnS[7]基因的扩增。以1.3 中提取的7 株猬迭宫绦虫或裂头蚴DNA 为模板,采用上述引物经PCR 分别扩增pcox1、pcox3 和prrnS 基因。以超纯水作为阴性对照。PCR 扩 增 条 件 为:94 ℃5 min; 94 ℃30 s、50 ℃30 s、72 ℃30 s,35 个循环; 72 ℃5 min。PCR 产物回收纯化后由北京擎科新业生物技术有限公司双向测序。
1.5 pcox1、pcox3 和prrnS 基因序列及遗传进化分析利用DNAStar 5.0 软件对上述PCR 产物测序并经拼接后获得pcox1、pcox3 和prrnS 基因。将获得的猬迭宫绦虫上述3 种基因序列与GenBank 中其他绦虫相应基因序列利用DNAStar 5.0 软件进行种内及种间比较,分析基因序列的碱基组成和序列同源性。利用DnaSP V6.12 软件计算各基因序列单倍型数(H)、核苷酸多样性(Pi)、单倍型多样性(Hd)和平均核苷酸差异(K)。利用Mega 7.0 软件采用Kimura-2-parameter模型,利用邻接法法(Neighbor-Joining,NJ 法)绘制基于上述3 种基因的猬迭宫绦虫的遗传进化树,自举检验1 000 次。
2 结果与讨论
2.1 pcox1、pcox3 和prrnS 基因的PCR 扩增结果
以7 株猬迭宫绦虫或裂头蚴DNA 为模板PCR 扩增获得的pcox1、pcox3 和prrnS 基因序列分别约400 bp、350 bp 和300 bp,均与预期片段长度相符,且无非特异性扩增条带(图1),表明从不同宿主来源的7株猬迭宫绦虫或裂头蚴中均扩增到了各目的基因片段。

图1 猬迭宫绦虫pcox1(A)、pcox3(B)和prrnS(C)基因的PCR扩增结果Fig.1 PCR products of S.erinaceieuropaei based on pcox1(A),pcox3(B)and prrnS(C)gene
2.2 pcox1、pcox3 和prrnS 基因测序和序列分析7 株猬迭宫绦虫或裂头蚴的pcox1、pcox3 和prrnS 基因测序结果经拼接、比对、校正后,扩增的长度分别为396 bp、362 bp 和280 bp,平均A+T 碱基含量分别为62.10%、66.70%和63.60%。测序获得的pcox1、pcox3 和prrnS 基因序列已上传至GenBank 数据库,获得的基因登录号分别为MZ774075~MZ774081、MZ783069~MZ783075、MZ783076~MZ783082。
核苷酸序列同源性分析结果显示,7 株猬迭宫绦虫或裂头蚴的线粒体pcox1、pcox3 和prrnS 基因序列之间的碱基差异率分别为0~2.27%、0~1.10%和0~1.79%,其差异是碱基互换;与不同宿主猬迭宫绦虫线粒体pcox1、pcox3 和prrnS 基因序列比较后的同源性分别为97.20%~100.00%、98.90%~100.00%和97.90%~100.00%;与其他绦虫线粒体pcox1、pcox3和prrnS 基因序列同源性分别为66.70%~84.10%、51.70%~72.10%和63.80%~87.10%。上述结果表明,猬迭宫绦虫pcox1、pcox3和prrnS基因种间变异大于种内变异,因此pcox1、pcox3和prrnS基因均可以作为研究不同宿主来源猬迭宫绦虫遗传变异的分子标记。
利用DnaSP软件分析基因序列的多样性,结果显示7株猬迭宫绦虫或裂头蚴pcox1基因的H为4,Hd和Pi分别为0.714±0.181 和0.012 51±0.002 92,K 为4.952;pcox3 基因的H 为2,Hd 和Pi 分别为0.476±0.171 和0.005 26±0.001 89,K 为1.905;prrnS 基因的H为5,Hd 和Pi 分别为0.857±0.137 和0.010 20±0.001 69,K 为2.857。Hd 和Pi 作为两个重要指标可以衡量一个种群的遗传变异关系,其中Pi 具有在生物进化中更为保守的优点,是研究生物进化的更优指标。在大多数动物中Pi大于0.01就认为变异较大[13]。本研究中pcox1和prrnS 基因Pi 均大于0.01,变异较大,其中pcox1 基因的Pi 大于prrnS 基因;且碱基差异率也是pcox1>prrnS>pcox3。由此推断,pcox1基因可能更适用于猬迭宫绦虫的种内遗传多态性分析,pcox3可能更适合作为猬迭宫绦虫定种的分子标记。
2.3 pcox1、pcox3 和prrnS 基因的遗传进化分析以日本血吸虫(Schistosoma japonicum,NC_002544)为外群,分别基于pcox1(图2A)、pcox3(图2B)和prrnS(图2C)基因构建猬迭宫绦虫的系统发育进化树。3 个进化树结果均显示,7 株不同宿主来源的猬迭宫绦虫均可与其他猬迭宫绦虫聚类在同一大分支上,但内部存在两个较小的分支,推测其可能分别对应猬迭宫绦虫的2 个基因型(但至今并未有基因型系统的分类依据)。且本研究的7株虫株均能与其他属的绦虫如长膜壳绦虫(Hymenolepis diminuta,NC_002767)、细粒棘球绦虫(Echinococcus equinus,AF346403)、牛带绦虫(Taenia saginata,NC_009938)和多头带绦虫(Taenia multiceps,FJ495086)等明显的区分开来(图2A~图2C)。表明,pcox1、pcox3 和prrnS 基因均可用于不同宿主来源猬迭宫绦虫虫种的鉴定。
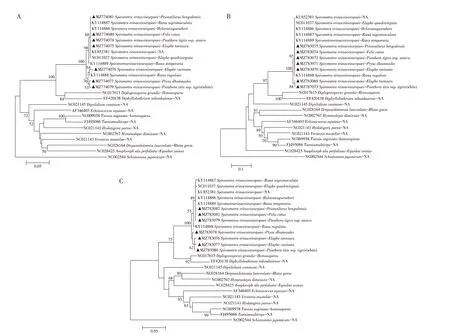
图2 基于pcox1(A)、pcox3(B)和prrnS基因(C)猬迭宫绦虫的系统发生树分析Fig.2 Phylogenetic relationship of S.erinaceieuropaei based on pcox1,pcox3 and prrnS genes,respectively
在猬迭宫绦虫的分支里,相同宿主的猬迭宫绦虫或者处于同一发育阶段的猬迭宫绦虫并未聚为同一分支,而不同宿主或不同发育阶段的猬迭宫绦虫则聚为同一分支(图2A~图2C)。Zhu 等基于cox1 基因进行序列多态性分析时,发现在澳大利亚的猬迭宫绦虫至少存在两种基因型,两种基因型分别来自非两栖宿主(犬、狐狸、猫、虎和蛇)和两栖宿主(蛙)[14];Okamoto 等研究发现从不同国家分离的猬迭宫绦虫存在不同基因型,且这些基因型不具有地理或宿主特异性[15];Zhang 等基于cytb、cox1、rrnS、28S rDNA 基因对我国西南9 个区域蛙源裂头蚴进行序列多态性分析发现,中国的两栖宿主蛙体内的猬迭宫绦虫存在两种基因型,且在上世纪中期开始分化,并推测这两种基因型可能是猬迭宫绦虫和不同气候环境下的中间宿主共同进化所导致[8]。本研究系统进化树结果显示猬迭宫绦虫存在不同基因型,且进一步推测,在不同宿主和不同地区的猬迭宫绦虫种内存在多种基因型。且相同宿主或相同发育阶段的猬迭宫绦虫并未聚类在同一分支,在同一分支里也存在不同宿主或不同发育阶段的猬迭宫绦虫,本研究结果也提示猬迭宫绦虫的遗传进化与其宿主和发育阶段无明显关联,这与Okamoto 等提出的猬迭宫绦虫的遗传进化与其宿主无明显关联的结论相符,但Okamoto 并未提及猬迭宫绦虫的不同基因型是否与虫株不同的发育阶段有关联,该研究者认为不同宿主的猬迭宫绦虫属于同一基因型是由于人类迁移或者经济活动所引起的[15]。推测可能是由于猫、犬等宠物以及西伯利亚虎、孟加拉虎等珍惜动物宿主被人为的迁徙到不同地区,猬迭宫绦虫为了适应环境变化和不同宿主,致使不同基因型的猬迭宫绦虫可以感染同一宿主,或同一基因型的猬迭宫绦虫也可以感染不同宿主。
综上所述,本研究推测在猬迭宫绦虫中存在至少两种基因型,且各基因型与猬迭宫绦虫的宿主及其发育阶段无明显关联。因此,未来需要更多样本进一步证明猬迭宫绦虫的遗传多样性。本研究通过对猬迭宫绦虫的分子流行病学研究,丰富了其宿主谱,并为其群体遗传研究提供了数据支持。

