血清miR-210、miR-181a表达水平与慢性阻塞性肺疾病稳定期患者糖皮质激素治疗效果的关系及其预测价值研究
秦克,李同林,宫帅,江美芳
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见的以气流阻塞为特征的呼吸系统疾病,可进展为呼吸衰竭,致死率、致残率均较高[1]。目前COPD的治疗以糖皮质激素为主,其中吸入性糖皮质激素(inhaled corticosteroids,ICs)以其局部抗炎作用较强、不良反应少等特点成为主要治疗药物[2]。但相关研究发现,仅40%~50%的患者对ICs具有反应性,长期使用ICs造成的不良反应促使重症肺炎风险增加[3],因此识别COPD患者对ICs的反应性并采取针对性治疗具有重要意义[4]。微小核糖核酸(mircoRNA,miR)是一种基因调控因子,已有多种miR被证实参与肺部炎症的调控[5]。近年研究发现,miR-210在多种炎症性肺疾病的发生中表达异常[6],参与免疫炎性反应过程。基础实验研究发现,miR-181a对香烟提取物诱导的大鼠肺泡巨噬细胞分泌具有抑制作用[7],提示miR-181a具有抗炎作用。本研究通过检测COPD患者ICs治疗前后血清miR-210、miR-181a水平变化,分析两种血清指标对COPD患者治疗效果的预测价值,以期为临床COPD患者ICs治疗效果的评估提供参考依据。
1 对象与方法
1.1 研究对象 选取2017年1月至2020年6月就诊于三六三医院门诊的COPD稳定期患者86例。纳入标准:(1)符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[8]中COPD稳定期的诊断标准;(2)年龄>18岁;(3)戒烟时间超过6个月;(4)就诊前3个月内未使用过抗生素治疗;(5)对本研究知情且签署知情同意书。排除标准:(1)其他呼吸系统相关疾病者;(2)严重心、肝、肾等重要器官疾病者;(3)对研究中使用的药物或成分敏感者;(4)就诊前有口服糖皮质激素治疗史者。本研究符合赫尔辛基宣言中关于医学伦理的建议(2017-01)。
1.2 方法
1.2.1 药物洗脱 所有患者根据就诊前3个月内ICs使用情况决定是否进行药物洗脱,有ICs使用史者予以丁胺醇吸入剂进行1周的ICs药物洗脱,3次/d;无ICs使用史者直接进入研究。
1.2.2 治疗方案与分组 所有患者治疗前先进行肺功能检查与慢性阻塞性肺疾病评估测试(COPD assessment test,CAT)[8],药物洗脱患者于药物洗脱后进行。患者均予以布地奈德福莫特罗粉吸入剂治疗,2吸/次,2次/d,连续治疗4周,同时常规使用支气管舒张剂、祛痰药等药物。4周后复查肺功能与CAT评分,将肺功能分级降低≥1个级别或CAT评分降低≥2分定义为有效并归为有效组,其余为无效并归为无效组。
1.2.3 肺功能检查与CAT 受试者保持端坐体位,采用肺功能仪测定用力肺活量(FVC)、吸入支气管舒张剂后的第1秒用力呼气容积(FEV1)及最大呼气流量(peek expiratory flow rate,PEF)。CAT:CAT 问卷共包含 8 个问题,对每个问题做出相应评分,每个问题分数为0~5分,问卷总分为0~40分,分值越高提示疾病对患者的影响越严重,其中0~10分为轻微影响,11~30分为较重影响,31~40分为严重影响。
1.2.4 血清miR-210、miR-181a表达水平检测 于治疗前(药物洗脱患者为药物洗脱后)、治疗4周后采集患者空腹静脉血,离心(3 000 r/min,20 min,离心半径为12 cm)后取上层血清,置于-80 ℃环境保存待检。采用miR提取分离试剂盒分离血清中的miR,反转录为cDNA,根据miR荧光定量检测试剂盒配置聚合酶链反应(polymerase chain reaction,PCR)体系:cDNA 2 μl、PreMix 10 μl、10 μmol/l上游引物与下游引物各0.4 μl、去离子水7.2 μl,在荧光定量PCR仪上进行反应:95 ℃ 15 min、94 ℃ 20 s、60 ℃ 34 s,重复 40个循环,PCR仪自动生成循环曲线后得到阈值,以U6为内参,计算miR-210、miR-181a的表达水平。
1.3 临床资料 收集COPD患者一般资料,包括年龄、性别、体质指数(BMI)、戒烟时间、病程;分析治疗前、治疗4周后肺功能指标(FVC、FEV1、PEF)、CAT评分、血清miR-210及miR-181a表达水平。
1.4 统计学方法 采用sPss 19.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,组内比较采取配对t检验;计数资料以相对数表示,组间比较采用χ2检验;采用Pearson相关分析探讨血清miR-210、miR-181a表达水平与肺功能指标及CAT评分的相关性,绘制受试者工作特征曲线(ROC曲线)以分析血清miR-210、miR-181a表达水平对COPD患者ICs治疗效果的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入COPD稳定期患者86例,其中男58例、女28例;平均年龄(60.9±7.3)岁;平均 BMI(22.3±1.4)kg/m2;病程 2~23年,平均病程(13.2±4.3)年。戒烟时间均超过半年,平均戒烟时间(5.8±1.0)年。
2.2 治疗前后COPD稳定期患者观察指标比较 ICs治疗后COPD患者FVC、FEV1、PEF较治疗前升高,CAT评分及血清miR-210、miR-181a表达水平较治疗前降低,差异有统计学意义(P<0.05),见表1。
表1 COPD患者ICs治疗前后观察指标比较(±s,n=86)Table 1 Comparison of pulmonary function parameters,CAT score,and serum miR-210 and miR-181a levels before and after four-week budesonide and formoterol inhalation treatment in COPD patients

表1 COPD患者ICs治疗前后观察指标比较(±s,n=86)Table 1 Comparison of pulmonary function parameters,CAT score,and serum miR-210 and miR-181a levels before and after four-week budesonide and formoterol inhalation treatment in COPD patients
注:FVC=用力肺活量,FEV1=第1秒用力呼气容积,PEF=最大呼气流量,CAT=慢性阻塞性肺疾病评估测试,miR=微小核糖核酸
血清miR-181a表达水平治疗前 2.49±0.76 1.38±0.443.61±0.93 16.33±4.10 22.01±6.17 1.38±0.47治疗后 2.78±0.81 1.60±0.514.32±1.03 11.57±3.27 17.41±5.29 1.09±0.32 t值 2.421 3.029 4.745 8.417 5.249 4.730 P值 0.017 0.003 <0.001 <0.001 <0.001 <0.001观察时间FVC(L)FEV1(L)PEF(L/s)CAT评分(分)血清miR-210表达水平
2.3 ICs治疗前血清miR-210、miR-181a表达水平与肺功能指标、CAT评分的相关性 ICs治疗前血清miR-210、miR-181a表达水平与CAT评分呈正相关(P<0.05),见表2。
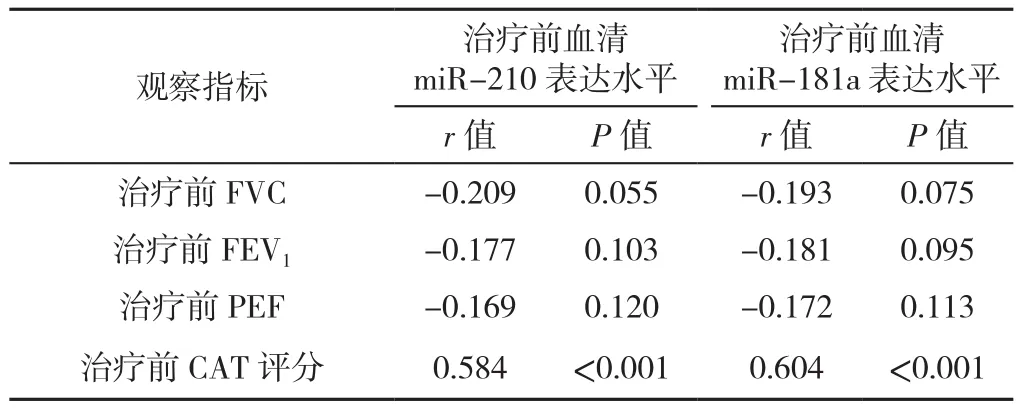
表2 ICs治疗前血清miR-210、miR-181a表达水平与肺功能指标、CAT评分的相关性分析(n=86)Table 2 Correlations of serum miR-210 and miR-181a levels with lung function parameters and CAT score in COPD patients before four-week budesonide and formoterol inhalation
2.4 ICs治疗后血清miR-210、miR-181a表达水平与肺功能指标、CAT评分的相关性 ICs治疗后血清miR-210、miR-181a表达水平与FEV1呈负相关(P<0.05),见表3。

表3 ICs治疗后血清miR-210、miR-181a表达与肺功能指标、CAT评分的相关性分析(n=86)Table 3 Correlation analysis of serum miR-210 and miR-181a levels with lung function parameters and CAT score after four-week budesonide and formoterol inhalation treatment
2.5 有效组与无效组患者临床资料比较 86例患者中共有39例(45.35%)对ICs治疗有效,47例无效(54.65%)。有效组治疗前与治疗后的血清miR-210、miR-181a表达水平低于无效组(P<0.05);有效组、无效组的年龄、男性性别、BMI、病程、戒烟时间比较,差异无统计学意义(P>0.05)。见表4。

表4 有效组与无效组患者临床资料比较Table 4 The clinical data in COPD patients with and without responses to four-week budesonide and formoterol inhalation treatment
2.6 治疗前miR-210、miR-181a表达水平对COPD稳定期患者ICs治疗效果的预测价值分析 治疗前miR-210、miR-181a表达水平预测COPD稳定期患者ICs治疗效果的ROC曲线下面积为0.807、0.844,临界值分别为19.65、1.29,灵敏度分别为0.733、0.779,特异度分别为0.767、0.802。见表5、图1。
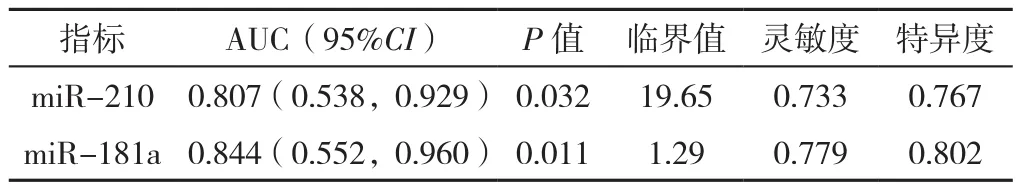
表5 治疗前血清miR-210、miR-181a表达水平对COPD稳定期患者ICs治疗效果的预测价值分析Table 5 Performance of pre-treatment serum miR-210 and miR-181a levels in predicting the treatment effect of four-week budesonide and formoterol inhalation in stable COPD patients

图1 治疗前血清miR-210、miR-181a表达水平预测COPD稳定期患者ICs治疗效果的ROC曲线Figure 1 ROC curve of pre-treatment serum miR-210 and miR-181a levels in predicting the treatment effect of four-week budesonide and formoterol inhalation in COPD patients
3 讨论
COPD是一种常见的呼吸系统疾病,具有较高的致死率和致残率。有学者指出,COPD患者气道、肺组织多存在由巨噬细胞等多种炎性细胞参与的慢性炎症[9],最显著特征为气流受限[10],COPD的治疗以减轻呼吸道炎症以及改善气流受限为主要目标[11]。COPD稳定期患者主要选择糖皮质激素治疗[12],其中ICs已被广泛应用。目前COPD患者诊疗指南主要根据患者急性加重史、改良呼吸困难评分、CAT评分综合评估临床疗效,但在实际临床工作中,ICs联合长效β2-受体激动剂使用时较难评估ICs的治疗效果,且只有部分患者对ICs治疗有效[13]。而长期使用ICs治疗会促使重症肺炎的风险大幅增加[14]。因此探讨有效预测ICs治疗效果的标志物对于评估ICs在COPD临床治疗中的使用价值及对临床治疗方案的选择具有重要的指导意义。已有证据表明,miR-210、miR-181a与COPD密切相关,与患者肺功能及炎性反应有明显相关性,可反映患者病情变化,并能在一定程度上预测COPD患者的急性加重及死亡[15]。本研究主要探讨了COPD稳定期患者血清miR-210、miR-181a表达水平与ICs治疗效果的关系及预测价值,旨在为临床评估COPD稳定期患者ICs治疗效果提供参考依据。
糖皮质激素因其抗炎、抗休克、免疫抑制等作用而广泛用于多种疾病,其运用于COPD患者时可有效抑制炎性反应,减轻气道高反应性,并可通过抑制中性粒细胞的增殖与集聚而抑制磷酸酯酶A2的生物活性、减少炎性因子合成、增加气道平滑肌对β2-受体激动剂的反应、预防气道重塑;同时还可降低病灶区域组织血管通透性,减少气道炎性细胞因子与体液渗出,进而减轻气道炎症与阻塞等[16]。本研究发现,治疗后COPD稳定期患者FVC、FEV1、PEF明显升高,CAT评分及血清miR-210、miR-181a表达水平明显降低,提示ICs治疗可有效减轻气道炎症,改善患者肺功能。布地奈德福莫特罗粉吸入剂是临床常用的一种糖皮质激素,具有高效、局部抗炎作用,不仅可增强内皮细胞的稳定性,还可有效抑制机体免疫反应,降低过敏性递质的活性并使其含量降低;同时还可减轻酶促反应,促使支气管收缩物质合成降低,最终抑制平滑肌收缩,达到治疗目的。ICs作为吸入性制剂可直接作用于患者肺组织以及气道,并具有较强的局部抗炎作用,通过直接作用于气道黏膜,减轻气道炎症程度与水肿情况,具有较高的生物利用率。
本研究结果显示,ICs治疗前血清miR-210、miR-181a表达水平与CAT评分呈正相关,ICs治疗后血清miR-210、miR-181a表达水平与FEV1呈负相关,提示血清miR-210、miR-181a表达水平可成为COPD稳定期患者治疗效果的衡量指标之一,对评估COPD患者治疗效果有一定作用。本研究结果还显示,86例患者中共有39例(45.35%)对ICs治疗有效,47例无效(54.65%),且有效组治疗前与治疗后血清miR-210、miR-181a表达水平均低于无效组,说明血清miR-210、miR-181a表达水平可反映ICs治疗效果,治疗前血清miR-210、miR-181a表达水平越低,则ICs治疗后气流受限改善程度越大,疗效越明显。研究表明,miR-210在呼吸道疾病的发生及发展中扮演着重要角色[17]。miR在细胞内具有重要的调节作用[14],可通过介导靶细胞基因转录本的降解或抑制其翻译影响细胞发育、增殖等过程。研究表明,miR参与了COPD的发生与进展,调控COPD炎性反应以及细胞凋亡,参与内皮细胞、巨噬细胞的病理过程[18],决定了COPD患者的病情严重程度与预后[19]。有研究发现,miR-210在受损的组织部位呈异常表达,其变化程度与组织损伤程度保持一致[20],因此miR-210是判断病情严重程度与预后的重要标志物之一。miR-181a是人体内组织炎性反应应激性miR,具有多种生物学效应。既往研究证实,miR-181a在肿瘤细胞生长、免疫调节方面具有重要作用[21],同时miR-181a具有炎症调控作用,可促进肿瘤细胞增殖、迁移以及侵袭能力改变等。大鼠实验证实,COPD大鼠中miR-181a表达量高于正常大鼠,miR-181a表达量升高参与了COPD的发生[22]。另外,miR-181a对评估患者预后具有很重要的指导意义,已广泛用于临床多种疾病的诊断与预后评估中[16]。本研究发现,血清miR-210、miR-181a表达水平预测COPD稳定期患者ICs治疗效果的ROC曲线下面积分别为0.807、0.844,灵敏度分别为0.733、0.779,特异度分别为0.767、0.802,提示血清miR-210、miR-181a表达水平对COPD稳定期患者ICs治疗效果有较高的预测价值。
综上所述,ICs治疗有效的COPD稳定期患者治疗前与治疗后的血清miR-210、miR-181a表达水平均低于无效患者,且治疗前血清miR-210、miR-181a表达水平可较好地预测COPD稳定期患者ICs治疗效果。未来可进一步挖掘更多的ICs治疗效果预测标志物,并通过更多标志物的联合检测来提高对ICs治疗效果的预测价值。
作者贡献:秦克提出研究思路,设计研究方案,提出研究假设,负责论文起草与最终版本修订,对文章整体负责;李同林进行研究的实施;宫帅协助研究的实施、收集入组病例、汇总基线信息;江美芳负责数据采集与统计学分析。
本文无利益冲突。

