氯化锂-匹罗卡品诱导癫痫大鼠海马组织差异表达circRNA的筛选及功能分析
黄亚辉,杨萍,朱勇,王琴,卢军,贺冰,张熙
癫痫不是具有单一表达和病因的疾病,而是具有多种危险因素和强烈遗传易感性的症状复合体。癫痫病影响所有年龄段,可致残[1-3]。癫痫发作的准确诊断至关重要,但现阶段对癫痫的筛查及防治远未能满足临床的需求[4,5]。寻找癫痫诊断或治疗的生物标志物具有重要意义。
共价闭合、单链环状的RNA(circRNA)是一类比较特殊的内源性非编码RNA,没有游离的5’帽子结构和3’poly(A)结构,且对核酸酶不敏感,比普通的线性RNA(linear RNA)更稳定[6-8]。circRNA 可能在多种疾病的发展中起作用[9-11],其在多种神经系统疾病(包括阿尔茨海默氏病、脑卒中和脑胶质瘤)中存在异常表达[12,13],但其作用机制目前尚不明确。circRNA在癫痫中鲜有研究报道,探索circRNA在癫痫中的功能机制具有重要意义。
氯化锂-匹罗卡品点燃大鼠癫痫模型是目前理想的颞叶癫痫模型,被广泛使用于颞叶癫痫发病机制及抗癫痫药物筛选研究[14]。故本研究通过构建氯化锂-匹罗卡品点燃大鼠癫痫模型,使用高通量测序方法进一步探索circRNA 在癫痫中的功能机制,以期寻找到癫痫诊断或治疗的生物标志物。
1 材料与方法
1.1 主要试剂与材料
无特定病原体级雄性SD 大鼠17 只,8~10 周龄,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司[许可证编号:SCXK(湘)2016-0002]。氯化锂(1001011078)购于Sigma 公司,匹罗卡品(ab141301)购于ABCR公司。
1.2 方法
1.2.1 氯化锂-匹罗卡品点燃癫痫大鼠模型构建及评估将17 只大鼠随机分为对照组(8 只)及癫痫组(9 只)。癫痫组大鼠先腹腔注射氯化锂溶液(3 mmol/kg),16 h后腹腔注射匹罗卡品溶液(50 mg/kg),约15~35 min后诱发癫痫发作[14]。对照组大鼠腹腔注射等量生理盐水。采用Racine 分级大鼠癫痫程度,达到4 级及以上发作入组,28 d后即癫痫大鼠造模成功。
1.2.2 HE 染色 从2 组大鼠中各随机抽取4 只处死,在冰面上快速分离出海马组织,生理盐水洗净后用4%多聚甲醛固定,依次经过不同浓度酒精脱水、石蜡包埋、切片、染色等HE 染色常规操作。观察对照组及癫痫组海马组织病理学差异。
1.2.3 circRNA 测序及差异表达基因筛选 取对照组4只、癫痫组5只大鼠,处死后取新鲜海马组织,快速用RNase-free 配制的生理盐水/PBS 清洗,吸干表面的液体,迅速将样本分割成长宽高均≤0.5 cm的小块,将样本放入Rnase-free管中,迅速投入液氮中速冻。提取总RNA,采用去除核糖体RNA(rRNA depletion)的方法构建链cDNA 文库。文库质检合格后采用Illumina Novaseq™6000 进行测序,测序读长为双端2×150 bp(PE150)。根据circRNA结构特征以及剪接序列特征,采用CIRCExploter2 和CIRI 2 款软件预测circRNA,并且依据circRNA 起始、终止位置来整合2 个软件的结果。circRNA鉴定标准:①mismatch≤2;②Back-spliced junctions reads≥1;③two splice sites 在基因组上距离≤100 kb。测序完成后,通过Tophat 2 进行序列比对,然后用cufflinks 对所有基因包括编码和非编码RNA进行定量;再使用EdgeR包进行差异分析,有生物学重复的同时满足Log2 差异倍数绝对值≥1 且P<0.05 的基因标为差异基因。
1.2.4 差异表达基因的信号通路富集 对得到的差异circRNA进行(Gene Ontology,GO)、京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)功能富集分析。
1.2.5 circRNA 与miRNA 互作分析circRNA-miRNA互作分析主要采用Targetscan 和miRanda 软件进行分析。Targetscan 基 于 种 子 区 域(seed region)进 行miRNA target 预 测;miRanda 主 要 基 于circRNA 与miRNA 两者结合自由能大小,自由能越小,两者结合能力越强。
2 结果
2.1 氯化锂-匹罗卡品点燃癫痫大鼠模型构建结果
癫痫组大鼠腹腔注射匹罗卡品溶液后,在数分钟内出现流涎、瞳孔缩小、腹泻、毛发耸立、血泪症等外周胆碱能反应,活动量明显减少,摄食摄水减少,表现呆滞,头面部轻颤,随后进展为4 级及以上的痫性发作,约15~35 min后出现癫痫发作。28 d后大鼠呈慢性自发性癫痫发作,即癫痫造模成功。对照组大鼠则表现正常,未出现上述行为学变化。HE染色结果显示对照组大鼠海马区神经元边缘清晰,形状正常,数量较多,排列规则;而癫痫组大鼠海马神经元排列紊乱,失去带状规则,海马神经元数量明显减少,再次提示模型构建成功,见图1。

图1 癫痫组与对照组大鼠海马区形态学观察(HE染色,光学显微镜,100×)
2.2 2组大鼠差异circRNA分析结果
将对照组及癫痫组的circRNA 进行差异分析获得的262 个差异circRNA,其中差异最显著的18 个见表1。通过火山图及散点图展示了它们的分布情况,见图2;并通过热图展示了部分差异circRNA 的表达,见图3。

图2 癫痫组与对照组大鼠海马组织差异表达的circRNA火山图和散点图

表1 癫痫组与对照组大鼠海马组织差异表达circRNA(最显著的18个)
2.3 2组差异circRNA的GO分析结果
在生物过程(biological process,BP)层面,差异基因富集于细胞蛋白修饰过程、蛋白质改性过程、树突形态形成的调控、高分子改性、突触前膜组织、肽基-赖氨酸改性、树突形态形成的正调控、树突发育的正向调控、树突形态发生、肽基-氨基酸修改、枝晶发育的调节、细胞组成、组织或生物形成、通过小蛋白偶联修饰蛋白质、细胞分解代谢的过程、细胞投射组织的正向调节、神经元分化调节、离子跨膜转运的调节等通路。在细胞组分(cellular component,CC)层面,差异基因主要富集于膜-有界的细胞器、细胞器、细胞内细胞器内腔、细胞器内腔、膜-封闭腔、细胞投影、核浆、核浆部分、神经元投射、突触后膜、突触等功能相关。在分子功能(molecular function,MF)层面,差异基因主要富集于二价无机阳离子跨膜转运体钙离子跨膜转运蛋白活性、酶结合、封闭的通道活动、离子门控通道活性、金属离子跨膜转运活性、大分子复杂的绑定、核苷-三磷酸酶监管组织的活动、无机阳离子跨膜转运体活化、核激素受体结合、GTPase监管活动、GTPase激活活动、电压门控离子通道活性、电压-封闭通道活动等通路相关,见图4。

图4 癫痫组与对照组大鼠海马组织差异表达circRNA的GO富集分析
2.4 2组差异circRNA的KEGG pathway分析结果
KEGG pathway 富集分析发现主要与泛素介导的蛋白水解作用、自噬、p53 信号通路、cGMP-PKG 信号通路、D-谷氨酰胺和D-谷氨酸代谢、磷酸肌醇代谢、细胞周期等相关。上述结果表明癫痫大鼠与对照大鼠海马组织存在神经信号转导相关通路上的基因表达水平的变化,差异circRNA富集为蛋白质变性、离子转运调控及神经发育等功能,见图5。

图5 癫痫组与对照组大鼠差异表达circRNA KEGG信号通路富集分析
2.5 circRNA与miRNA互作分析
通过Targetscan与miRanda两款软件进行分析,发现与circRNA 存在互作的miRNA,如miR-322-5p、miR-322-3p、miR-323-5p、miR-323-3p、miR-301a-5p、miR-301a-3p、miR-324-5p、miR-324-3p 等,见 图6。circRNA 可能通过与miRNA 或其他分子结合而在转录或转录后水平介导基因表达,然后抑制其功能。
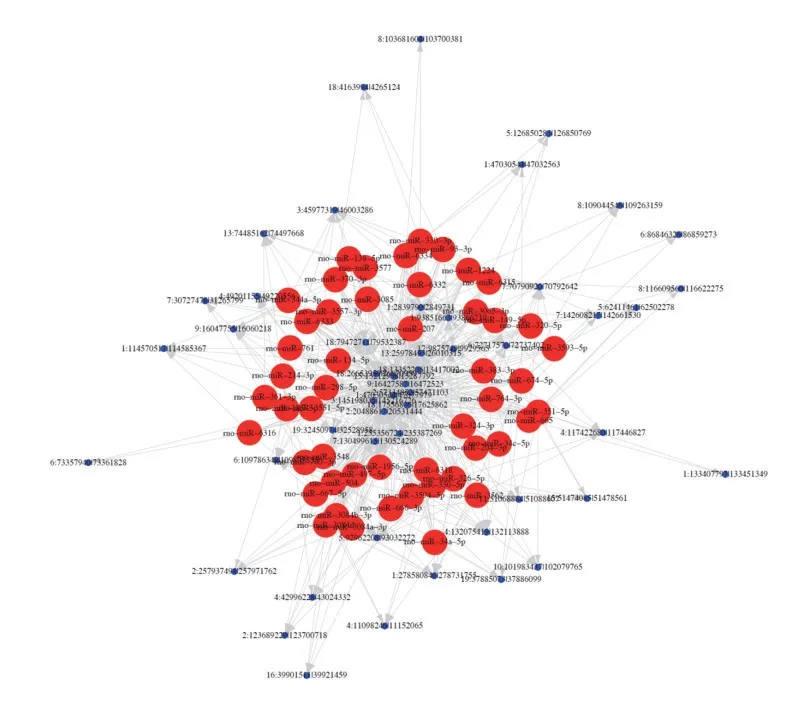
图6 癫痫组与对照组大鼠海马组织差异表达circRNA与miRNA互作网络图(相关最高的前50个)
3 讨论
本研究通过构建氯化锂-匹罗卡品点燃大鼠癫痫模型,通过行为学观察及HE染色结果确定模型构建成功后取新鲜海马组织,使用高通量测序方法进一步探索circRNA 在癫痫中的功能机制,以期寻找到癫痫诊断或治疗的生物标志物,为未来癫痫诊断和治疗寻找潜在靶点。
癫痫发展和进展是基因转录和蛋白质表达的大规模变化引起异常的网络重构和过度兴奋,导致反复发作[15-17]。circRNA 是在人体组织中发现的一类独特的非编码RNA,其来自前体-mRNA(pre-mRNA)转录本的反向剪接,与多种疾病有关。我们通过高通量测序后进行差异分析获得的262个差异circRNA,这些可能是癫痫防治的潜在靶标。目前结果虽然显示极少数circRNA 的表达发生了显著改变,但它们通过circRNA-miRNA-mRNA 相互作用靶向大量mRNA。另外,信号通路富集结果表明差异基因富集于细胞蛋白修饰过程、蛋白质变性过程、树突形态调控、神经元分化调节、离子跨膜转运的调节等通路相关。这些信号通路多数被证实与海马神经元的结构和功能的维持关系密切[18],表面circRNA 的异常可能引起神经元兴奋性改变,有可能导致神经元发生异常的、同步化放电导致癫痫症状发生及发作,在癫痫发病及疾病进展中发挥重要作用。基于文献报道[19,20],circRNA主要存在5种可能的调控机制:①细胞核内参与转录调控;②转录时与mRNA 前体发生剪切竞争;③细胞质中与mRNA竞争miRNA的靶标结合位点;④包含核糖体进入位点,可以翻译表达有效多肽或蛋白;⑤circRNA与蛋白相互作用。这部分研究目的主要针对第3种调控机制,即circRNA 作为内源性竞争RNA(ceRNA)影响miRNA转录后调控功能进行深入分析,为后续实验验证提供依据。在本研究中,与circRNA 存在互作的miRNA,如miR-322-5p、miR-323-5p、miR-324-5p 等也有少量的研究证实其与神经系统疾病相关。如金书欣等[21]研究证实通过miR-322-5p靶向影响Akt3的表达,可以抑制Th17 分化来缓解自身免疫性脑脊髓炎的疾病进程;Lian 等[22]通过使用miR-323-5p 模拟物过度表达miR-323-5p 后,其可以靶向胰岛素样生长因子1 受体,抑制人神经胶质瘤细胞中的细胞生长,凋亡和迁移;Xu等[23]研究表明过度表达的miR-324-5p可能降低神经胶质瘤细胞系的细胞存活率并提高G1/G0期速率,miR-324-5p可以通过靶向调节神经胶质瘤细胞的生长来抑制神经胶质瘤细胞的增殖。这些结果从侧面进一步证明了本研究发现的重要性。
本研究也存在一定的局限性。①因为circRNAmiRNA-mRNA网络的复杂性,相互作用在本研究中仅通过生物信息学方法可以预测;②动物样本与人体组织存在物种差异性,结果无法直接推及于人;③差异circRNA 的作用尚未得到验证,在后续实验中我们将继续思考该问题的解决方法,并将进一步完善机制实验研究。但本研究结果为揭示癫痫发生发展提供基因层面的依据,为癫痫的机制研究提供新的实验依据和线索,为癫痫的早期诊断和治疗提供新的思路及靶点。
综上所述,本研究通过构建氯化锂-匹罗卡品点燃大鼠癫痫模型,使用高通量测序方法进一步探索circRNA 在癫痫中的差异表达,系统地分析了其可能的作用功能机制,有助于寻找到癫痫诊断或治疗的生物标志物。

