颈椎前路Hybrid手术中骨性融合与异位骨化的关系
何俊波,卓 樾,刘 浩,王贝宇,丁 琛,吴廷奎,洪 瑛,孟 阳
1.四川大学华西医院骨科,成都 610041 2.四川大学华西临床医学院,成都 610041 3.四川大学华西医院麻醉手术中心,成都 610041 4.四川大学华西护理学院,成都 610041
颈椎前路手术是治疗颈椎退行性疾病的重要手术方式[1]。颈椎人工椎间盘置换术(CTDR)临床效果与传统的颈椎前路椎间盘切除融合术(ACDF)相当,同时具有维持节段活动度(ROM)、减少邻近节段异常应力、降低邻近节段退行性变风险等优势[2-4]。但CTDR手术指征严格,适用范围窄。颈椎前路Hybrid手术将2种术式结合,可为多节段颈椎病患者制订个体化手术方案,多项研究[5-6]证实该术式安全、有效。对颈椎前路手术而言,骨形成是术后重要的进程和评价指标。一方面,融合节段早期骨性融合可加速患者康复、降低医疗负担[7];但另一方面,异位骨化(HO)将影响置换节段ROM[8-9]。既往临床研究[9]发现,患者术前骨赘与术后HO形成有关;而基础研究[10-11]发现,不同来源的间充质细胞成骨表达能力不同。目前,颈椎前路手术术后骨性融合与HO之间是否存在联系尚不明确。本研究以采用颈椎前路Hybrid手术治疗的颈椎退行性疾病患者为研究对象,探讨颈椎前路Hybrid手术后融合节段的骨性融合与置换节段的HO之间的联系。
1 资料与方法
1.1 一般资料
纳入标准:①年龄>18岁;②连续双节段颈椎退行性变(椎间盘突出或骨赘形成)所致的神经根病或脊髓病;③术前至少经6周非手术治疗无效或症状加重;④随访>36个月。排除标准:①既往颈椎手术史;②合并骨质疏松症等代谢性疾病;③颈椎创伤、肿瘤、局部或全身感染;④随访资料不完整。对于退行性变较轻(术前颈椎动力位X线片上水平位移< 3.5 mm、ROM<20°)、以软性突出压迫为主的节段行CTDR,对于退行性变较严重(ROM<2°或椎间高度丢失> 50%)以及有严重小关节退行性变的节段行ACDF[2-4]。本研究为回顾性病例对照研究。根据以上标准,纳入2009年1月—2018年1月四川大学华西医院采用颈椎前路Hybrid手术治疗的51例连续双节段颈椎椎间盘退行性变患者,采用McAfee法[12]判断术后目标节段HO形成情况,其中32例术后发生HO(HO组),Ⅰ级12例、Ⅱ级13例、Ⅲ级5例、Ⅳ级2例;19例未发生术后HO(非HO组)。本研究所有操作均符合《赫尔辛基宣言》伦理要求,研究方案获四川大学华西医院生物医学伦理委员会审批备案。
1.2 疗效评价
术前及末次随访时,采用日本骨科学会(JOA)评分[13]、颈椎功能障碍指数(NDI)[14]、疼痛视觉模拟量表(VAS)评分[15]分别评估脊髓神经功能、颈部功能障碍及颈肩部疼痛情况。
1.3 影像学评价
患者术后随访时常规摄颈椎正侧位及功能位(过伸过屈位)X线片和颈椎CT,必要时行MRI检查。采用Cobb法[16]在X线片上测量颈椎整体曲度、C2~7ROM、置换节段前凸角、置换节段ROM。颈椎整体曲度为侧位X线片上C2椎体下缘与C7椎体下缘连线间的夹角;置换节段前凸角为侧位X线片上置换节段上位椎体下缘及下位椎体上缘连线间的夹角(图1a)。功能位X线片和颈椎CT上,棘突间距变化< 1 mm且颈椎CT上有连续骨桥形成[17-18]即为骨性融合(图1b)。功能位X线片上颈椎整体曲度的变化即为C2~7ROM,置换节段前凸角的变化即为置换节段ROM(图1c、d)。所有影像学测量工作均在本院影像归档和通信系统(PACS)上完成。
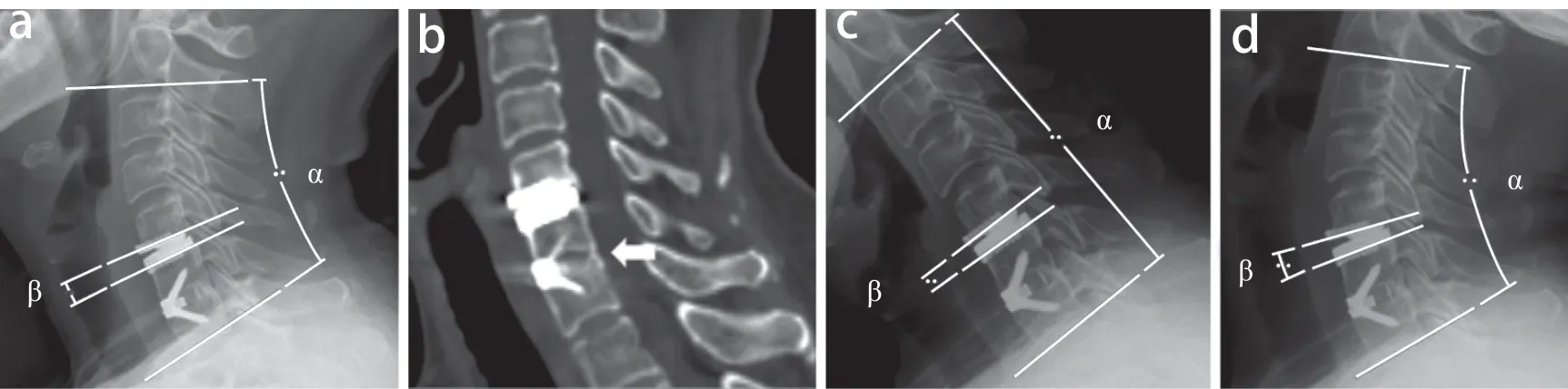
图1 颈椎影像学参数测量Fig. 1 Measurement of cervical radiographical parametersa:术后侧位X线片上颈椎整体曲度(α)及节段前凸角(β) b:术后CT示连续骨桥形成(箭头) c:术后过屈位X线片上颈椎整体曲度(α)及节段前凸角(β) d:术后过伸位X线片上颈椎整体曲度(α)及节段前凸角(β)a:Cervical overall curvature(α) and segmental lordosis angle(β) on postoperative lateral roentgenograph b:Postoperative CT shows bone bridge formation(arrow) c:Cervical overall curvature(α) and segmental lordosis angle(β) on postoperative flexion roentgenograph d:Cervical overall curvature(α) and segmental lordosis angle(β) on postoperative extension roentgenograph
1.4 统计学处理
采用SPSS 24.0软件对数据进行统计分析。符合正态分布的计量资料以±s表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用非参数Mann-WhitneyU检验;计数资料采用例数和百分数表示,组间比较采用χ2检验或Fisher精确概率法;以P< 0.05为差异有统计学意义。
2 结果
2组患者性别、年龄、体质量指数(BMI)、手术节段、手术时间、术中出血量及手术前后碱性磷酸酶、血钙、血磷差异均无统计学意义(P>0.05,表1)。末次随访时2组患者JOA评分、NDI及VAS评分均较术前明显改善,差异有统计学意义(P<0.05,表2),组间差异无统计学意义(P>0.05,表2)。术后3个月时HO组融合率明显高于非HO组,差异有统计学意义(P<0.05,表3)。末次随访时,2组颈椎曲度均较术前增大,差异有统计学意义(P<0.05,表4),组间差异无统计学意义(P>0.05,表4)。末次随访时,HO组C2~7ROM较术前降低,差异有统计学意义(P<0.05,表4);非HO组C2~7ROM与术前相比,差异无统计学意义(P>0.05,表4);组间比较,差异有统计学意义(P<0.05,表4)。末次随访时,HO组置换节段ROM较术前降低,差异有统计学意义(P<0.05,表4);非HO组置换节段ROM与术前相比,差异无统计学意义(P>0.05,表4);组间比较,差异有统计学意义(P<0.05,表4)。末次随访时,2组置换节段前凸角与术前相比均无明显变化,组间差异亦无统计学意义(P>0.05,表4)。
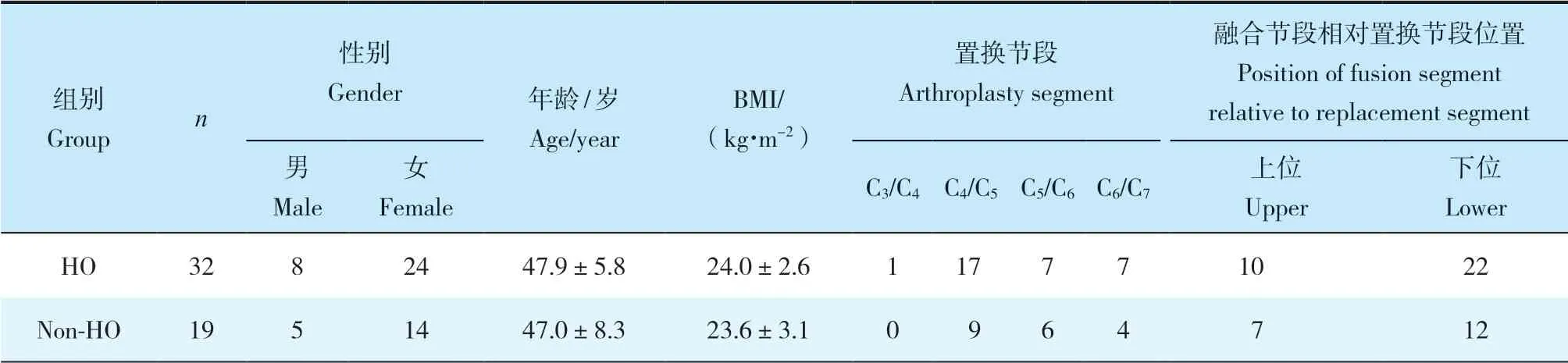
表1 2组患者基线资料Tab. 1 Baseline characteristics of 2 groups

表1 (续)
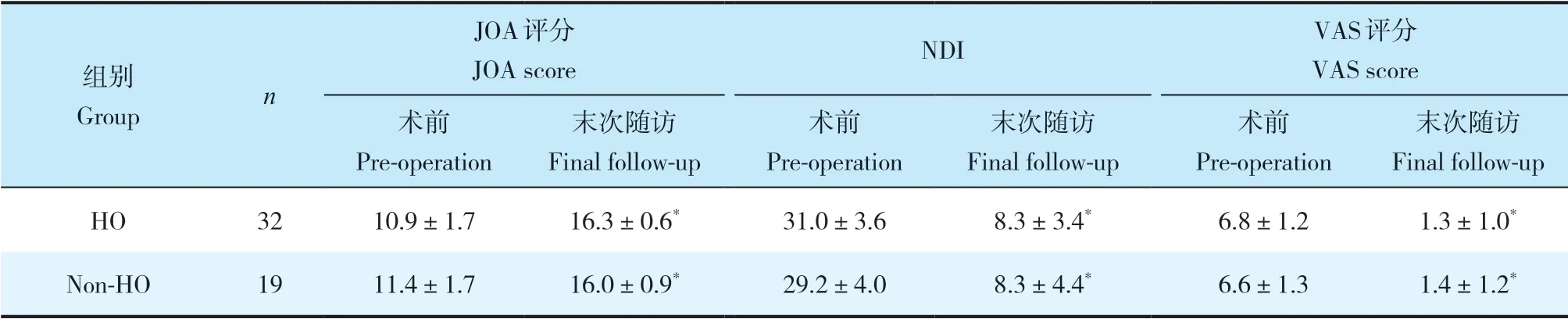
表2 2组疗效指标Tab. 2 Clinical outcomes of 2 groups
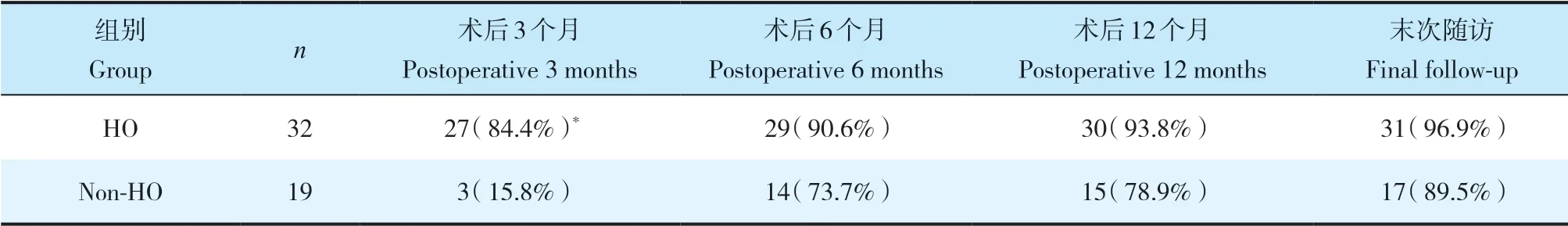
表3 2组融合率Tab. 3 Fusion rates of 2 groups
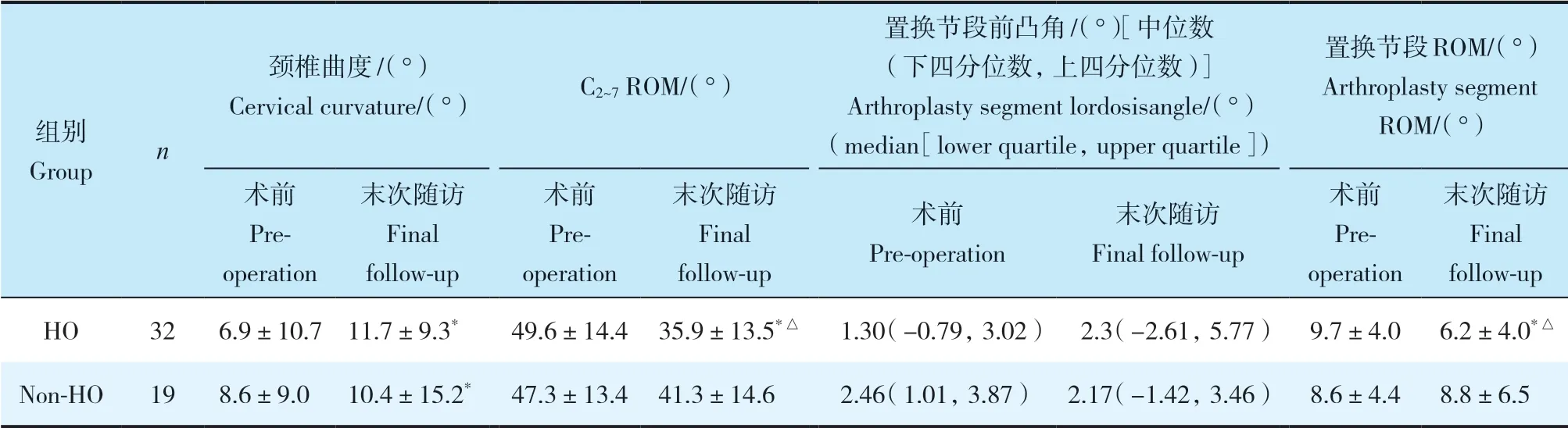
表4 2组患者影像学指标Tab. 4 Radiographical outcomes of 2 groups
3 讨论
骨性融合是评价ACDF疗效最重要的影像学指标之一,但并不是所有患者ACDF术后均能实现骨性融合。一篇纳入了10 208例ACDF患者的荟萃分析[17]显示,经过平均20.5个月的随访,90.1%的患者获得骨性融合,术后3、6、12个月的融合率分别为51.1%、78.3%和87.6%。本研究中,融合节段术后3、6、12个月及末次随访的融合率分别为58.8%(30/51)、84.3%(43/51)、88.2%(45/51)和94.1%(48/51),与上述文献相当,提示Hybrid手术中融合节段的融合率不受邻近节段CTDR影响。
骨性融合情况与患者预后密切相关。Pertzen等[7]的研究表明,骨性融合的形成时间与术后并发症相关,延期融合患者伴有更高的假体相关并发症发生率。而ACDF术后不融合或假关节形成会影响临床疗效,甚至需要二次手术。美国食品与药品监督管理局批准的器械豁免实验结果显示,融合率与患者的疼痛症状改善及颈部功能恢复有关[18]。Newman等[19]的研究表明,23例融合术后假关节形成患者中16例有持续性症状并接受了二次手术。本研究结果显示,Hybrid术后融合节段融合率达94.1%,患者术后临床指标较术前明显改善,证明Hybrid手术是治疗连续双节段颈椎退行性疾病的有效术式。
HO是指在关节周围软组织内出现成骨细胞并形成骨组织,高等级(McAfeeⅢ~Ⅳ级)HO将降低节段ROM甚至导致自发融合[8-9,12]。本研究结果也显示,HO组置换节段ROM较术前明显下降,非HO组置换节段ROM则基本维持术前水平。Hui等[8]的荟萃分析纳入了5 861个CTDR手术节段,结果显示,HO发生率为32.5%,限制节段活动(McAfeeⅢ~Ⅳ级)HO发生率为11.0%。Wang等[5]报道的Hybrid术后HO发生率为33.3%(10/30),CTDR术后HO发生率为35.7%(5/14)。本中心的前期研究[20]也发现Hybrid术后HO发生率高于CTDR,但差异无统计学意义。本研究的Hybrid术后HO发生率为62.7%(32/51),其中Ⅰ级37.5%(12/32)、Ⅱ级40.6%(13/32)、Ⅲ级15.6%(5/32)、Ⅳ级6.3%(2/32)。这可能是因为本研究随访时间较Wang等[5]和胡凌云等[20]的研究更长,而根据Yi等[21]的研究显示,HO具有时间进展性,随访时间越长,HO发生率越高。同时,本研究采用颈椎CT评估HO,其灵敏度较X线片更高[8],这可能也是本研究Hybrid术后HO发生率较文献报道更高的一个因素。
骨性融合和HO是骨形成的不同表现形式,其发生机制和影响因素尚未明确,但有研究[22-27]发现两者存在着相似的影响因素。对于ACDF术后延迟融合与假关节形成,既往研究[22-23]发现,其相关危险因素包括患者个体因素、手术节段数、植骨类型、骨生长刺激剂和内置物类型。Phillips等[22]的研究纳入了48例采用ACDF治疗的患者,其中伴有临床症状的假关节患者的平均年龄为43.8岁,明显低于无症状的假关节患者(52.1岁)。Liang等[24]对2 000名国人脊柱韧带骨化情况进行研究,结果表明,韧带骨化患者的平均年龄显著高于无骨化患者,并且出现颈椎韧带骨化的人群发生脊柱其他部位韧带骨化的风险更高。张颉鸿等[25]的研究结果提示,遗传因素在韧带骨化中发挥作用。另一方面,HO的影响因素除机械刺激、男性和手术节段(C3/C4)外,同样包括高龄和遗传[8,21,26]。同时,有研究[9,27]发现,HO与术前骨赘和/或后纵韧带骨化有关。而刘美辰等[10]和Risbud等[11]的研究提示,不同供者及不同部位组织所培养的间充质干细胞成骨表达可能存在差异。上述研究提示,患者个体之间可能存在成骨能力的差异,同时影响患者术后骨性融合和HO等骨形成的发生。
本研究结果显示,术后3个月HO组融合率高于非HO组,该结果表明,融合节段骨性融合越早,置换节段越容易发生HO。因此,术式选择是改善患者融合情况及预防HO的关键举措,对于有成骨倾向的患者应慎重考虑是否适合行融合手术,对高龄男性、术前骨赘形成、韧带骨化者应慎用置换手术[8-9,21,26-27]。术前对患者的成骨倾向进行检测有助于术式的选择,但本研究中2组手术前后血钙、血磷及碱性磷酸酶差异均无统计学意义,未发现相关生物标志物。因此,包括目前常用于检测成骨能力的骨钙蛋白、骨桥蛋白、骨基质形成蛋白[10-11]及与后纵韧带骨化及椎间盘退行性变均相关的骨形态发生蛋白-2、转化生长因子-β、Runx2等骨化相关基因[25,28-29]在内的成骨生物标志物均值得进一步探索,从而在临床工作中为术式选择提供重要依据。
本研究不足之处:①为回顾性研究,在处理数据过程中可能存在选择偏倚和观察偏倚;②采用的骨移植物是人工骨粒和自体骨粒混合物,虽为同种骨移植物,但其比例难以统一,可能会对融合效果造成影响[30];③采用的骨融合指标为融合时间与融合状态,不能完全反映患者术后融合节段的成骨进程和成骨量。
综上所述,颈椎前路Hybrid术后融合节段的骨性融合与置换节段HO存在一定的联系。融合节段骨性融合越早,置换节段越容易发生HO。2种不同表现形式的骨形成情况可能是个体成骨能力的反映,术式选择将是促进患者早期融合及预防HO的重要措施,在未来需要可靠的成骨能力检测来辅助医师进行术式选择。

