气调贮藏对兰茂牛肝菌采后生理生化及品质的影响*
张沙沙,周 锫,罗晓莉,胡小松,张微思,孙达锋**
(1.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650221;2.中国农业大学食品科学与营养工程学院,北京 100083)
兰茂牛肝菌(Lanmaoa asiatica),属牛肝菌科(Boletaceae) 兰茂牛肝菌属(Lanmaoa),俗称“见手青”“红葱”,盛产于贵州、云南等地[1-2],受当地人喜爱,但至今不能人工栽培。兰茂牛肝菌不仅味道奇鲜,营养也非常丰富,其蛋白质含量为56.0 g·100-1g-1(干质量),氨基酸总量为33.40 g·100-1g-1(干质量),是优质蛋白源[3]。另外还含有维生素、矿物质、多糖、萜类等成分,具有抗氧化、抗癌、抗炎等功效[4]。新鲜的兰茂牛肝菌质地脆嫩、含水量高,表面无保护结构,采后呼吸作用等代谢活动,会造成其水分和营养物质流失,引起子实体褐变、软化、腐烂,失去食用价值和商品价值。
目前,生产上常用的兰茂牛肝菌保鲜技术主要是低温保鲜。虽然成本较低,但是效果不理想,因此需要研究开发一种新的保鲜技术延长兰茂牛肝菌保鲜期。气调保鲜技术是通过在低温条件下控制贮藏环境内的气体比例以达到保鲜的目的。根据气调条件的产生方式,分为自发气调和人工机械气调2种;自发气调在食用菌保鲜中应用较多,但气体比例不好控制[5-6]。通过人工气调可确定贮藏环境内的气体参数,提高保鲜效果。人工机械气调成本较高,目前国内仅应用于梨、猕猴桃等果蔬的保鲜[7-8],能够延缓果实的衰败,达到较好的保鲜效果。
因此,以兰茂牛肝菌为原料,对比研究低温贮藏和气调贮藏保鲜技术对兰茂牛肝菌生理生化和品质的影响,以期为气调贮藏保鲜技术应用于兰茂牛肝菌的贮藏提供理论指导。
1 材料与方法
1.1 试验材料与设备
新鲜兰茂牛肝菌采集于云南省玉溪市哀牢山,用泡沫箱加冰袋24 h内运回中华全国供销合作总社昆明食用菌研究所实验室进行试验。乙醇、磷酸氢二钠、磷酸二氢钠、儿茶酚、过氧化氢、愈创木酚等试剂为分析纯,购自国药集团化学试剂有限公司。
T-214电子天平,北京赛多利斯仪器系统有限公司;YGVA(定制型)气调试验箱,北京阳光亿事达科技有限公司;BSC-250恒温恒湿箱,上海博迅实业有限公司医疗设备厂;LX-C型硬度计,温州市海宝仪器有限公司;YX-306B型呼吸强度测定仪,北京宇翔电子应用技术有限公司;2010型酶标仪,安图实验仪器(郑州)有限公司;D2KW-S-8恒温水浴锅,北京市永光明医疗有限公司;HR/T20MM低温冷冻离心机,湖南赫西仪器装备有限公司。
1.2 样品处理
挑选12 kg五成熟、无机械损伤、虫害较轻的兰茂牛肝菌,去除杂质后,在真空预冷机中预冷10 min,最终压力为500 Pa,子实体中心温度为4℃,去除田间热。参考张燕等[9-10]的气调保鲜参数,在前期预试验基础上进行修改。试验分成2组,每组5 kg,分别装入PE保鲜袋中。贮藏温度为(5±0.5) ℃、湿度为90%。对照组(CK):恒温恒湿箱;试验组(EG):气体成分为体积分数分别为6%的O2和10%的CO2的气调箱,每6天随机取样检测。
1.3 指标测定
1.3.1 感官质量评价
参照参考文献[11]的方法,感官质量评价由7位经过训练的评价员对新鲜兰茂牛肝菌的色泽、形态、质地、气味等指标进行评价。评价标准见表1。

表1 兰茂牛肝菌感官质量评价标准Tab.1 Sensory quality evaluation standard of Lanmaoa asiatica
1.3.2 失重率
测定兰茂牛肝菌贮藏前后的质量,每份样品约600 g,重复3次,失重率(G,%) 的计算公式为:
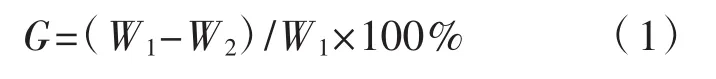
式中:W1为贮前鲜质量(g);W2为贮后鲜质量(g)。
1.3.3 硬度
将硬度计垂直于子实体表面,分别测定菌盖和菌柄的硬度值,每个处理挑选3朵兰茂牛肝菌,每朵兰茂牛肝菌各测7个不同位置的硬度值,取平均值。
1.3.4 呼吸强度
采用呼吸强度测定仪测定兰茂牛肝菌的呼吸强度(R,mg·kg-1h-1),计算公式为:

式中:△PPM为测定前后CO2的体积浓度差值(mg·m-3);V为呼吸室内气体体积(m3);W为样品质量(kg);t为呼吸时间 (h)。
1.3.5 抗坏血酸、丙二醛含量和过氧化氢酶、过氧化物酶、超氧化物歧化酶、多酚氧化酶活性测定
抗坏血酸(ascorbic acid,ASA)、丙二醛(malondialdehyde,MDA) 含量的测定参照参考文献[12]。取4 g鲜样,加入少量石英砂和50 mL质量浓度为0.05 mol·L-1、pH 7.0的磷酸缓冲溶液,冰浴研磨,4℃、8 000 r·min-1离心20 min,上清液即为粗酶提取液。4℃保存备用,用于酶活性的测定。过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、超氧化物歧化酶 (superoxide dismutase,SOD)、多酚氧化酶(polyphenol oxidase,PPO) 的活性测定参照参考文献[13]。
1.4 数据处理
所有试验均重复3次以上,试验结果以均值±标准差表示。采用Excel 2010进行方差统计分析和绘图,P<0.05表示差异显著。
2 结果与分析
2.1 气调贮藏对兰茂牛肝菌感官评分的影响
新鲜的兰茂牛肝菌菌盖和菌褶均比较亮丽,形态饱满,质地硬,有浓郁的香气,随着贮藏时间的延长,兰茂牛肝菌逐渐出现异味、褐变、失水、软烂等现象,从而失去商品价值和食用价值。气调贮藏对兰茂牛肝菌感官评分的影响结果见图1。

图1 气调贮藏对兰茂牛肝菌感官评分的影响Fig.1 Effect of modified atmosphere storage on sensory score of Lanmaoa asiatica
由图1可知,对照组和试验组的兰茂牛肝菌随着贮藏时间的延长,感官评分逐渐下降;对照组下降较快,不到13 d已失去食用价值,即不再检测相关数据;试验组感官评分极显著高于对照组(P<0.01)。气调保鲜贮藏延长了兰茂牛肝菌保鲜期10天以上。
2.2 气调贮藏对兰茂牛肝菌失重率的影响
水分是食用菌维持生理活动和新鲜品质的必要条件,食用菌失水会导致食用菌萎蔫,失去商品价值。蒸腾作用和呼吸作用是造成兰茂牛肝菌在贮藏过程中严重失重的原因,其中蒸腾作用导致其失水,呼吸作用导致其损失干物质[14]。气调贮藏对兰茂牛肝菌失重率的影响结果见图2。
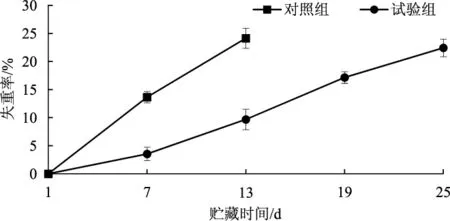
图2 气调贮藏对兰茂牛肝菌失重率的影响Fig.2 Effect of modified atmosphere storage on weight loss of Lanmaoa asiatica
由图2可知,对照组兰茂牛肝菌在贮藏期间失水比较严重,失重率极显著高于试验组(P<0.01)。贮藏第7天时试验组的失重率为对照组的25.86%,说明气调贮藏可以降低兰茂牛肝菌失重率;试验组贮藏7天后失重严重。
2.3 气调贮藏对兰茂牛肝菌呼吸强度的影响
食用菌采收后仍然进行着一系列生命活动,如呼吸作用等。呼吸强度可代表营养物质消耗的快慢,是食用菌采后生理研究中最要的指标之一。兰茂牛肝菌属于呼吸跃变型食用菌,呼吸过程分为3个阶段:前期、高峰期及后期。前期是品质提高阶段,后期品质劣变,开始衰老,抗性降低。因此食用菌贮藏保鲜过程中延迟呼吸峰的出现非常重要。气调贮藏对兰茂牛肝菌呼吸强度的影响见图3。
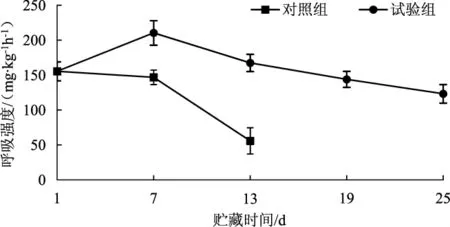
图3 气调贮藏对兰茂牛肝菌呼吸强度的影响Fig.3 Effect of modified atmosphere storage on respiratory intensity of Lanmaoa asiatica
由图3可知,对照组呼吸峰出现在贮藏的第1天至第7天之间,由于测定时间间隔较长,错过了对照组呼吸峰值;试验组呼吸峰在贮藏第7天左右出现;对照组与试验组呼吸强度差异性显著(P<0.05)。气调贮藏能够延迟兰茂牛肝菌呼吸峰的出现。
2.4 气调贮藏对兰茂牛肝菌硬度的影响
食用菌采后贮藏期间的生理活动会造成子实体营养成分的降解及水分丧失,导致表面皱缩,硬度下降。硬度可真实反映兰茂牛肝菌的脆度及衰败程度[15]。气调贮藏对兰茂牛肝菌硬度的影响结果见图4。
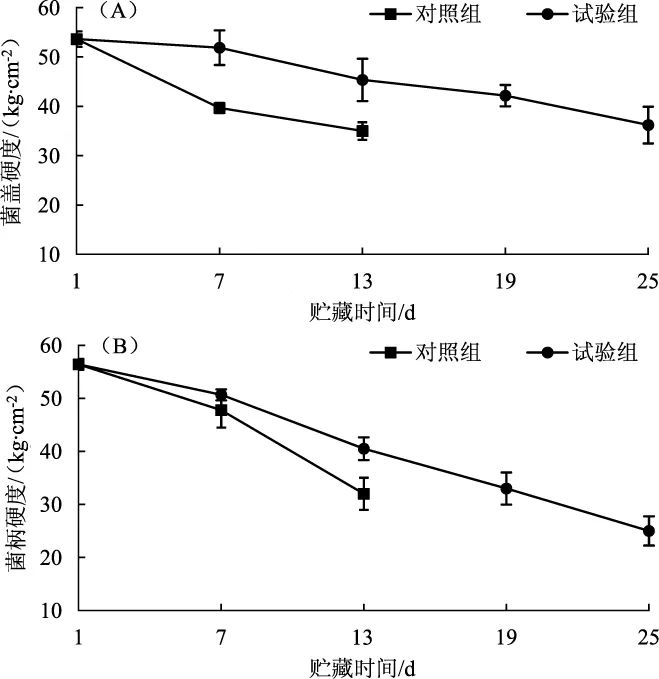
图4 气调贮藏对兰茂牛肝菌菌盖(A)和菌柄(B) 硬度的影响Fig.4 Effect of modified atmosphere storage on the hardness of pileus(A)and stipe(B)of Lanmaoa asiatica
由图4可知,对照组前7天硬度下降较快,而试验组从第7天开始硬度下降较快,且比对照组的硬度下降更缓慢。试验组和对照组菌盖硬度差异显著(P<0.05),对照组菌盖硬度为试验组的76.43%;贮藏第7天时对照组与试验组的菌柄硬度差异不显著(P>0.05),直至第13天时硬度差异显著(P<0.05),说明气调贮藏有利于兰茂牛肝菌硬度的保持。
2.5 气调贮藏对兰茂牛肝菌抗坏血酸含量的影响
抗坏血酸(ASA) 是兰茂牛肝菌子实体内源物质,具有抗氧化、抗衰老、抗褐变能力,在运输贮藏过程中容易被氧化分解[16]。气调贮藏对兰茂牛肝菌抗坏血酸含量的影响结果见图5。
由图5可知,对照组兰茂牛肝菌的ASA含量逐渐增加;试验组兰茂牛肝菌的ASA含量在贮藏第1天~第19天均逐渐增加,19 d后开始下降;2组ASA含量差异性显著(P<0.05)。这可能是因为兰茂牛肝菌在贮藏过程中存在后熟现象,兰茂牛肝菌在贮藏过程中因进一步成熟使ASA继续合成而上升,后期由于衰老导致其含量逐渐下降。因此,气调贮藏延缓了兰茂牛肝菌子实体ASA含量峰值的出现时间,可有效保持兰茂牛肝菌子实体的抗氧化能力。
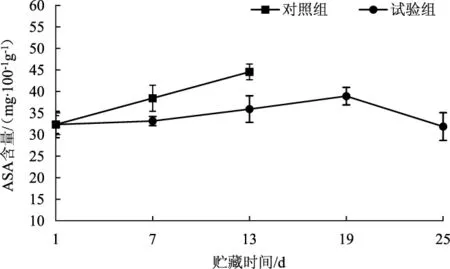
图5 气调贮藏对兰茂牛肝菌ASA含量的影响Fig.5 Effect of modified atmosphere storage on ASA content of Lanmaoa asiatica
2.6 气调贮藏对兰茂牛肝菌超氧化物歧化酶活性的影响
超氧化物歧化酶(SOD) 是一种金属辅基酶,催化超氧阴离子自由基(O2·-)转化为H2O2和O2,减少O2·-对机体造成的伤害,是食用菌子实体中重要的自由基清除酶和保护性酶[17]。因此,气调贮藏对兰茂牛肝菌超氧化物歧化酶活性的影响结果见图6。
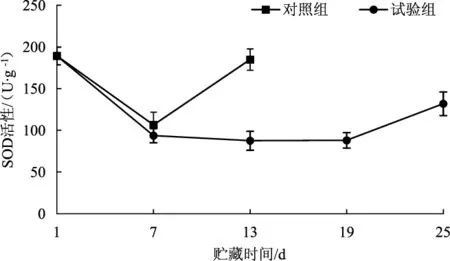
图6 气调贮藏对兰茂牛肝菌SOD活性的影响Fig.6 Effect of modified atmosphere storage on SOD activity of Lanmaoa asiatica
由图6可知,第1天~第13天贮藏过程中对照组和试验组的SOD活性均显著下降,说明温度和气体比例的变化对SOD活性影响较大,温度降低SOD活性减弱[18]。同时,SOD活性受到O2·-产生速率诱导[19],O2·-产生越快SOD活性越高。随着贮藏时间的延长,SOD活性逐渐增强,且试验组SOD活性低于对照组,说明对照组O2·-产生速率高于试验组。对照组和试验组贮藏第7天时SOD活性差异不显著(P>0.05),直至第 13天时差异显著(P<0.05)。
2.7 气调贮藏对兰茂牛肝菌过氧化物酶活性的影响
过氧化物酶(POD) 不仅可以作为自由基清除酶,在H2O2存在的情况下,还可氧化酚类和胺类化合物,是兰茂牛肝菌褐变中发挥重要作用的酶类之一,可作为一种子实体老化的生理指标[20-21]。气调贮藏对兰茂牛肝菌过氧化物酶活性的影响见图7。
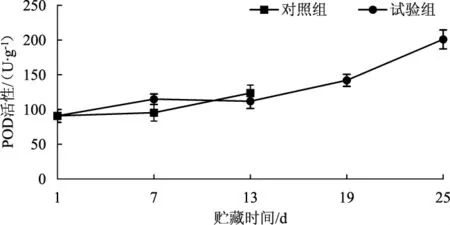
图7 气调贮藏对兰茂牛肝菌POD活性的影响Fig.7 Effect of modified atmosphere storage on POD activity of Lanmaoa asiatica
由图7可知,随着贮藏时间的延长,POD活性逐渐升高,说明随着贮藏时间延长,兰茂牛肝菌子实体开始老化,对照组和试验组的兰茂牛肝菌的POD活性差异性不显著(P>0.05)。
2.8 气调贮藏对兰茂牛肝菌多酚氧化酶活性的影响
多酚氧化酶(PPO)是一类多酚类氧化酶的统称,主要有漆酶和酪氨酸酶,能将酚类氧化成醌类[21-22]。气调贮藏对兰茂牛肝菌多酚氧化酶活性的影响结果见图8。

图8 气调贮藏对兰茂牛肝菌PPO活性的影响Fig.8 Effect of modified atmosphere storage on PPO activity of Lanmaoa asiatica
由图8可知,贮藏第1天至第7天对照组和试验组PPO活性均急剧降低,低温会使PPO活性下降;贮藏第7天时对照组和试验组PPO活性差异不显著(P>0.05);对照组贮藏第7天至第13天时PPO活性急剧升高,导致兰茂牛肝菌褐变程度升高,而试验组一直保持在较低水平;贮藏第13天对照组与试验组PPO活性差异显著(P<0.05)。气调贮藏使兰茂牛肝菌的PPO活性保持较低水平,可延缓兰茂牛肝菌褐变,减慢衰老进程。
2.9 气调贮藏对兰茂牛肝菌过氧化氢酶活性的影响
过氧化氢酶 (CAT) 可以催化H2O2分解为H2O和O2,是最主要的H2O2清除酶,防止H2O2直接或间接毒害或加速兰茂牛肝菌细胞的衰老[23-24]。气调贮藏对兰茂牛肝菌过氧化氢酶活性的影响结果见图9。
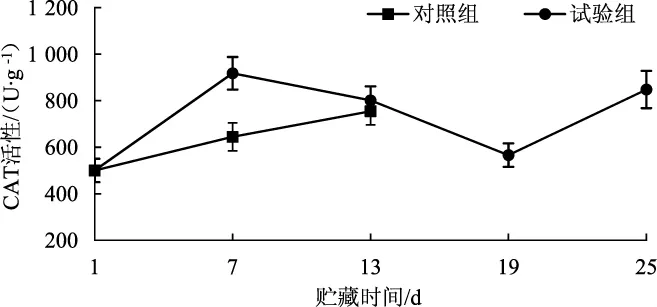
图9 气调贮藏对兰茂牛肝菌CAT活性的影响Fig.9 Effect of modified atmosphere storage on CAT activity of Lanmaoa asiatica
由图9可知,对照组的CAT活性在贮藏期间是一直升高;而试验组CAT活性呈先升高后降低,后期再升高的趋势;且试验组的CAT活性一直高于对照组。
2.1 0 气调贮藏对兰茂牛肝菌丙二醛含量的影响
丙二醛(MDA)是细胞膜脂肪氧化作用的主要产物之一,能够反映兰茂牛肝菌细胞膜衰老程度,MDA含量增加,说明细胞结构被破坏加剧,加速细胞的衰老[25]。气调贮藏对兰茂牛肝菌丙二醛含量的影响结果见图10。

图10 气调贮藏对兰茂牛肝菌MDA含量的影响Fig.10 Effect of modified atmosphere storage on MDA content of Lanmaoa asiatica
由图10可知,贮藏第1天至第13天对照组的MDA含量显著高于试验组(P<0.05),二者的MDA含量均呈上升趋势,气调贮藏能够明显延缓MDA含量的上升,减轻兰茂牛肝菌子实体膜脂的过氧化,延缓其衰老。
3 结论与讨论
从上述试验结果发现,气调贮藏保鲜条件下的兰茂牛肝菌在子实体硬度、失重率、酶活性、感官评分、MDA含量等方面均优于冷藏保鲜。气调贮藏条件下子实体具有更高的抗氧化损伤能力,可以延迟呼吸峰的出现时间并提升其品尝价值,延缓子实体褐变,减慢衰变进程。相对于冷藏处理,气调贮藏可延长兰茂牛肝菌保鲜期10 d以上。
兰茂牛肝菌属于呼吸跃变型食用菌[26],采后呼吸强度会继续提高,即后熟过程,至峰值时达到完全成熟,品质最佳,其后呼吸强度下降,品质衰变。研究中试验组兰茂牛肝菌呼吸峰推迟至第7天出现,而对照组则在采后快速出现。此外,前序研究[1,27]证明,试验组后熟过程中,兰茂牛肝菌风味物质的构成和水平会发生一系列变化,使其品尝滋味得到提升。因此,气调处理不仅可以延长兰茂牛肝菌保鲜期,而且在一定时间内可以提升其品尝价值。
食用菌在采后衰变过程中会发生硬度变化。杏鲍菇在采后冷藏条件下会发生子实体硬化衰变,而双孢菇(Agaricus bisporus)、秀珍菇(Pleurotus geesteranus)等食用菌在衰变中会发生软化[28-29]。本研究中试验组兰茂牛肝菌的软化程度和速率均低于冷藏组,且其硬度变化曲线较为平缓,未观察到快速软化过程。然而,几丁质酶(chitinase) 和β-葡聚糖酶(β-glucanase)等导致食用菌软化的主要酶类在兰茂牛肝菌软化衰变中的作用仍需进一步探索[30]。
好氧真菌在呼吸过程中会产生活性氧(reactive oxygen species,ROS),主要包括超氧阴离子(O2·-)、羟基自由基(·OH)和过氧化氢(H2O2)等[31]。食用菌在采后由于机械损伤、微生物侵染等胁迫因素,导致细胞内活性氧积累,过量的活性氧会导致脂类过氧化反应,造成蛋白质和核酸的氧化损伤等[32]。SOD、CAT、POD、ASA、谷胱甘肽等构成了细胞内的主要抗氧化系统。研究中对照组的ASA水平持续上升,且高于试验组水平,由此推测对照组子实体因快速进入了衰变期,细胞内活性氧积累后氧化还原平衡被打破,诱导细胞内ASA合成上调,以此应对氧化损伤。而试验组有效抑制了呼吸作用,保持了其细胞内氧化还原平衡,因而ASA只是缓慢上升后下降,总体水平低于对照组。值得注意的是,对照组的CAT活性持续上升,趋势与ASA一致,但活性总体低于对照组。由于ASA和CAT在细胞内都行使分解H2O2的功能,因此推测冷藏与气调处理下细胞分解H2O2的机制有所差异。SOD是分解自由基的关键酶,研究中对照组和试验组SOD活性先下降,之后对照组SOD活性再次回升至新鲜子实体的基线水平,而气调组SOD活性一直较低,仅贮藏末期有所回升,但仍低于基线水平。可见不同保鲜处理在初始阶段均能降低细胞内自由基水平,但随着子实体衰变进程,自由基水平可能再次回升,造成氧化损伤。
结合SOD和CAT活性变化情况,推测冷藏处理在起始阶段可以抑制自由基水平,但无法处理大量生成的H2O2,因此细胞增加ASA合成和CAT活性。而气调处理可以持续抑制自由基水平,生成的H2O2主要通过上调CAT活性进行抑制。因此在不同保鲜条件下,兰茂牛肝菌应对氧化损伤的机制可能有所差异,但该假设需要对更多的抗氧化指标进行研究证明。

