废旧三元锂电池正极材料浸出液中和除铝的研究
张贺杰

摘 要:废旧三元锂电池正极材料经过600℃焙烧3h后,采用硫酸法浸出,NaOH固体和50g/LNa2CO3溶液作为中和剂调节浸出液pH生成铝沉淀进行脱除,将沉淀冲洗、干燥后取部分用硫酸进行溶解,采用ICP-6300进行元素含量的测定。结果表明,浸出液在pH=6为最优的除铝条件,此时溶液中铝的沉淀效率达到99%以上, Cu和Fe基本脱除,这种情况下Mn,Co,Ni也产生了不同程度的沉淀,沉淀中的Al/Mn,Al/Co,Al/Ni分别为90,8,2,共沉淀过程中沉淀效果Ni>Mn>Co。
关键词:废旧三元锂电池回收;硫酸法浸出;杂质;中和除铝
1前言
自20世纪90年代锂离子电池进入商业化以来,由于其具有电压高、体积小、质量轻、比能量高、无记忆效应、自放电小、寿命长等优点已广泛应用到移动电话、笔记本电脑、摄像机、数码相机等众多领域[1]。如今,随着新能源汽车的蓬勃发展,生产的锂离子电池的数量快速增长,废旧电池的数量也在急剧增加,预计2020年用过的锂电池的数量和重量分别超过250亿和50万吨[2]。其中废旧锂离子电池中有价金属元素(Li、Co、Mn、Ni等)具有极高的回收价值[3]。回收废旧锂离子电池中的有价金属既能保护生态环境,又能缓解有限自然资源与不断增长的消费需求之间的矛盾。
LIB的回收过程包括物理过程和化学过程。物理过程包括预处理等拆解,破碎,筛分,磁选,洗涤,热预处理等。化学过程可归类为湿法冶金工艺中浸出,分离,萃取等。其中浸出过程包括无机酸(H2SO4[4],HCl[5],HNO3[6])浸出和有机酸(,乳酸,柠檬酸, L -酒石酸等)浸出。
目前除铝大致分为2种方法,一是直接将废旧锂电池粉末原材料用碱浸出。A.A.Nayl 等[7]采用氨水对电池粉末中的铝进行浸出,其中在4M NH3H2O、液固比15/1、温度60℃、时间1h反应条件下,Al的浸出效率为97.8%。但是这类方法存在步骤繁琐、浸出效果不彻底、成本较高等问题。二是对废旧电池浸出液加碱进行中和反应除铝,S.P.Barik等[8]通过采用氢氧化钠和碳酸钠调整电池浸出液的pH至6.5,浸出液中Al,Fe,Cu的沉淀率达到99%以上,但是浸出液中的Co, Mn, Ni损失率分别为6.7%, 15%, and 19.4%。这类方法操作简单,沉淀率高,但是由于铝和Co, Mn, Ni的Ksp值相似,在除铝过程中会发生共淀现象。
本文主要针对废旧电池浸出液中除铝过程进行研究,分别模拟了在不同条件下Al和NI,Co,Mn产生沉淀的变化,并对真实溶液中除铝进行了研究。
2实验
2.1原料与试剂
所有溶液均在去离子水中制备,所有试剂均为分析纯未进一步提纯。废旧锂电池粉末是各种废旧锂电池正极材料的混合物。实验中所用的硫酸铝、硫酸镍、硫酸锰、硫酸钴、硫酸钠、碳酸钠试剂全部由中国国药化工股份有限公司提供。
2.2实验方法
2.2.1模拟实验
为了优化除铝条件,在不同pH、温度、SO42-浓度和Ni2+,Co2+,Mn2+浓度条件下进行研究。实验步骤如下:首先,向烧杯中倒入200ml反应液,通过水浴锅控制温度25℃,控制搅拌速度为250rpm,蠕动泵速度4ml/min滴加50g/L的Na2CO3溶液,pH剂控制溶液的pH值。反应结束后将溶液进行过滤并用80℃的去离子水进行冲洗。
通过下面公式计算浸出液中的沉淀效率QAl:
QAl =(1-C1V1/C0V0)x100%
其中QAl是浸出液中Al的沉淀效率;
C0和C1分别是沉淀前后溶液中铝离子的浓度(mol / L);
V0和V1分别是沉淀前后的液体体积(L)
将干燥后的沉淀用硫酸进行溶解后,分析溶液中各元素的含量,并且按下面公式计算沉淀中Al与各元素的比例:
Al/X=mAl/mX
其中Al/X表示沉淀中Al与其他元素百分含量的比值,X表示Mn,Ni,Co;
mAl表示沉淀中Al所占其质量的百分比;
mX 表示沉淀中Mn,Ni,Co所占其质量的百分比
2.2.2废旧三元锂电池浸出液实验
将废旧锂电池粉末在马弗炉600℃焙燒3h后,用20%H2SO4溶液和6%H2O2溶液进行浸出,其中反应温度60℃,反应时间2h,固液比100g/L,转速300rpm。在用氢氧化钠固体将浸出液的pH值调至2-3,浸出液中各元素含量用ICP检测后结果见表1。真实溶液实验反应步骤和上述模拟实验一致。
2.3分析检测
采用ICP-6300进行溶液浸出溶液中Li、Ni、Co、Mn、Al、Fe、Cu及沉淀固体(渣)中元素含量的测定;采用Empyrean型X射线衍射仪(XRD,工作电压40KV,工作电流为40mA,扫描范围5°-90°)测定沉淀固体物相,FEI MLA 250 型矿物解离分析仪及能谱仪(EDX,捷克 FEI 电子光学公司)对沉淀行形貌和能谱分析。
3结果与讨论
3.1模拟实验除铝的研究
本文探究Al在沉淀过程可能受到的影响因素,进行了不同温度,pH值,硫酸根浓度,Mn离子浓度,Co离子浓度,Ni离子浓度条件实验。为了保证溶液体系与浸出液相似,通过添加硫酸钠固体维持溶液中硫酸根浓度在100g/L左右。
3.1.1不同pH值下除铝
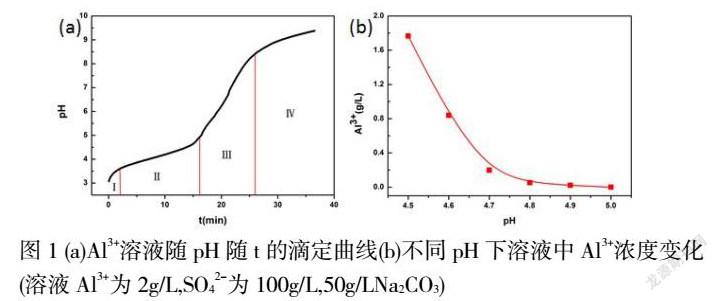
在Al为2g/L, SO42-为100g/L 溶液中通过4ml/min滴加50g/LNa2CO3溶液进行中和反应,绘制出了一条纵坐标为pH与横坐标为t的滴定曲线见图1(a)。由图可知,滴定曲线主要分为四个阶段。其中第Ⅰ和Ⅲ阶段,此时pH=3-3.8和pH=5-8.5滴定曲线随时间的增加幅度变化较大,主要是H+和OH-发生的中和反应;第Ⅱ和Ⅳ阶段,此时pH=3.8-5和pH>8.5滴定曲线随时间的增加变化比较缓慢,分别发生Al3+的沉淀反应和Al(OH)3沉淀溶解反应。因此,在第Ⅱ阶段pH下观察溶液中Al3+脱除情况结果见图1,由图可知,在pH=4.5-4.7的过程中,溶液中的Al3+含量急剧下降,从1.8g/L到0.2g/L,在pH=4.8-5时,溶液中的Al3+含量逐渐减少直至为0。结果表明溶液中Al3+大部分沉淀发生在pH=4.5-4.7。
3.1.2 不同浓度下除铝
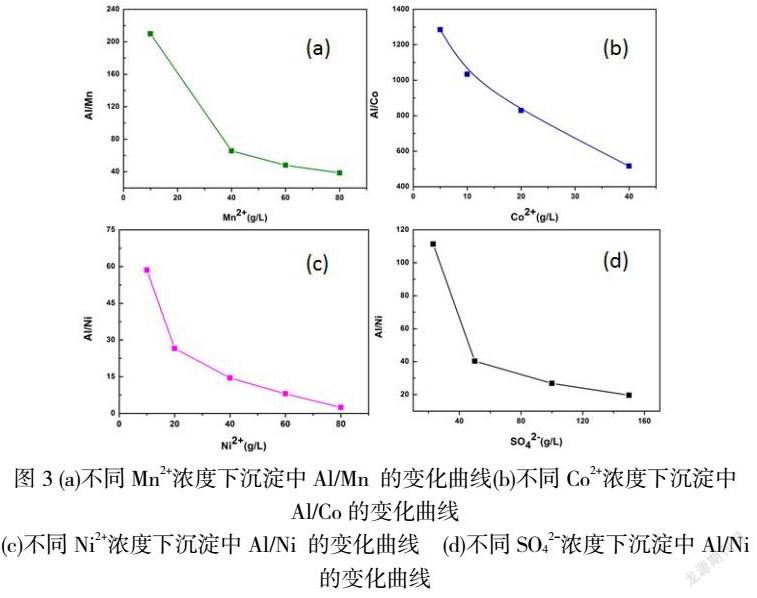
在不同浓度下对脱铝进行研究时,控制终点pH=5,这时溶液中Al3+已经沉淀完全,来分析沉淀中各元素含量的变化。图3(a)展示了溶液中不同Mn2+浓度对沉淀中Al/Mn的影响。随着Mn2+的浓度从10g/L增加到80g/L,沉淀中Al/Mn从209.9降低到38.5。图3(b) 展示了溶液中不同Co2+浓度对沉淀中Al/Co的影响。随着Co2+浓度的从5g/L增加到40g/L,产生的沉淀中Al/Co从1285降低到516,。图3(c)展示了随着溶液中镍浓度的从10g/L增加到80g/L,产生的沉淀中Al/Ni从58.5降低到2.46。从图5(a)(b)(c)数据结果可知,随着Ni2+,Mn2+,Co2+的浓度升高沉淀中Ni,Mn,Co含量也随之升高,不利于铝的单方面脱除。在相同的Ni2+,Mn2+,Co2+浓度条件下生成的沉淀中Al/Ni>Al/Mn>Al/Co,由此可知,在除Al过程中,Mn,Co,Ni产生共沉淀效果Ni>Mn>Co。
图3(d)通过保持溶液中Al含量为2g/L和镍含量为20g/L不变,改变溶液中的硫酸根含量观察沉淀中Al/Ni,可以看出随着溶液中硫酸根浓度23g/L到150g/L,沉淀中的Al/Ni从111.3降低到19.63.溶液中硫酸根浓度越高导致了沉淀中镍含量的增加,表明硫酸根升高不利于Al的单方面脱除。
3.1.3不同温度下除铝
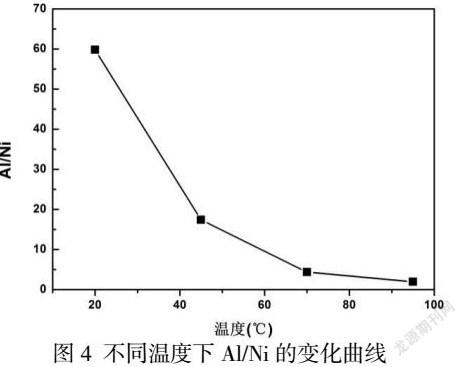
溶液中Al含量为2g/L,Ni含量为20g/L和SO42-含量为100g/L,改变反应溶液的温度观察沉淀中Al/Ni的值,由图4可知,随着温度的升高Al/Ni值从60急剧减小到1, 可以看出溶液中Ni2+的沉淀量受温度的影响很大,温度升高加剧了Ni的沉淀,不利于Al的单方面脱除
3.2真实溶液除铝
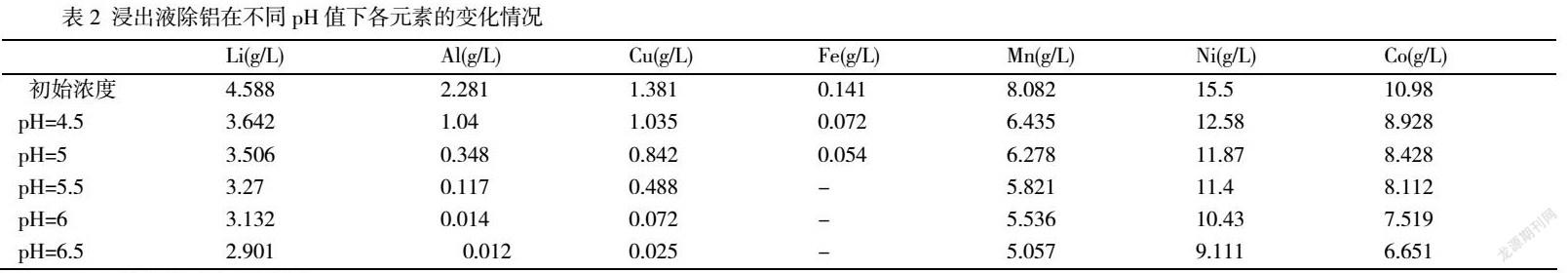
将浸出液在温度25℃,转速250rpm,蠕动泵4ml/min,50g/LNa2CO3,不同pH下进行中和除铝,通过ICP检测溶液中各元素变化结果见表2。从表中可以看出随着pH值的增高溶液中Al,Cu,Fe变化较为显著,Fe在pH=5.5以后就基本为0,Al和Cu从初始的2.281g/L和1.381g/L较少到12ppm和25ppm基本上已经全部沉淀。其中pH=6和pH=6.5除铝效率变化很小,从而选择pH=6为最佳沉淀pH值。
为了更好地了解有价金属的沉淀情况,将沉淀酸溶后进行了ICP检测。在不同pH下的Al/Mn,Al/Co,Al/Ni,可以看出沉淀中Al/Mn在811到90,表明在反应过程中Mn的沉淀量不高。而Al/Co,Al/Ni分别从64到8和30到2 ,可以看出Co和Ni产生了不同程度上的沉淀。实验结果与模拟实验结果一致,Mn,Co,Ni和Al产生共沉淀效果Ni>Co>Mn。
3.小结
通过采用硫酸法浸出废旧三元锂电池,对其在不同条件下的脱铝效果和浸出液中和除铝进行了研究,得出如下结论:
1)在高硫酸根体系下,除铝产生的沉淀是产生的沉淀是类似铝钒土的一种物质,物相为Al2SO4(OH)4!7H2O;
2)不同条件除铝过程中,温度、硫酸根和Ni2+,Co2+,Mn2+浓度过高不利于铝的单方面去除;
3)在废旧电池浸出液除铝过程中,pH=6为最优终点pH值,其中溶液中Al的沉淀率达到了99%以上, Cu和Fe基本去除,Mn,Co,Ni产生了不同程度的沉淀沉淀中Al/Mn,Al/Co,Al/Ni分别为90,8,2,共沉淀过程中Ni>Mn>Co.
参考文献:
[1]Barik, S.P., Prabaharan, G., Kumar, L., Leaching and separation of Co and Mnfrom electrode materials of spent lithium-ion batteries using hydrochloric acid:laboratory and pilot scale study. J. Clean. Prod. 147(2017), 37–43.
[2]Hongming Zhou, Xiuxiu Zhao , Chengjie Yin , Jian Li . Regeneration of LiNi 0.5 Co 0.2 Mn 0.3 O 2 cathode material from spent lithium-ion batteries.Electrochimica Acta 291 (2018) 142-150
[3]Shin, S.M., Kim, N.H., Sohn, J.S., Yang, D.H., Kim, Y.H.,.Development of a metal recovery process from Li-ion battery wastes. Hydrometallurgy 79 (2005), 172–181.
[4]鄧朝,勇张谊,杨茂麟,徐本军,硫酸-双氧水浸出废旧锂离子电池中的钴[J],电池,2011,41(3),170-171
[5]M. Joulié, R. Laucournet,E. Billy, Hydrometallurgical process for the recovery of high value metals from spent lithium nickel cobalt aluminum oxide based lithium-ion batteries,Journal of Power Sources 247 (2014) 551-555
[6]C.K. Lee, K.I. Rhee, Reductive leaching of cathodic active materials from lithiumion battery wastes, Hydrometallurgy 68 (2003) 5–10.
[7] Daniel Alvarenga Ferreira, Luisa Martins Zimmer Prados, Daniel Majuste, Marcelo Borges Mansur, Hydrometallurgical separation of aluminium, cobalt, copper and lithium from spent Li-ion batteries, Journal of Power Sources 187 (2009) 238–246
[8]Jingu Kang, Gamini Senanayake,Jeongsoo Sohn, Shun Myung Shin, Recovery of cobalt sulfate from spent lithium ion batteries by reductive leaching and solvent extraction with Cyanex 272, Hydrometallurgy 100 (2010) 168–171

