层状双氢氧化物基纳米材料制备及应用研究进展*
罗媛媛,郑智阳,廖 磊,颜嘉庆,邓善桥
(核工业二九〇研究所,广东 韶关 52029)
水是人类社会生存和发展的基础。随着人类现代化程度的提升,来自造纸、纺织、印刷、塑料生产以及电镀等行业含有重氮染料和重金属离子的工业废水被排放到了水环境中,对人类健康、生态环境以及生态系统的稳定造成了严重的威胁[1]。因此,研究新型材料用于工业废水的净化愈加重要。
层状双氢氧化物(LDHs),一种类2D水滑石类材料,由带正电荷的主体层和可交换的层间阴离子构成,通常可以表示为 [MII1-xMxIII(OH)2]x+[(An-)x/n]x-·mH2O(MII和MIII分别为二价和三价金属离子,An-是层间阴离子,x为MIII/(MII+MIII)的摩尔比)[2]。当前,各种类型的LDHs基材料被广泛的应用于气体吸附[3]、重金属离子和有机污染物的吸附[4-5]、污染物催化降解[6]以及能源贮存[7]等方面。然而,更为重要的是LDHs由于其低成本,无毒和适度的化学稳定性,也引起了人们对真正的环境污染清除的日益关注[8]。本文从层状双氢氧化物基纳米材料的制备、对于污染物的去除机理以及该材料的再生性等方面进行了综述。
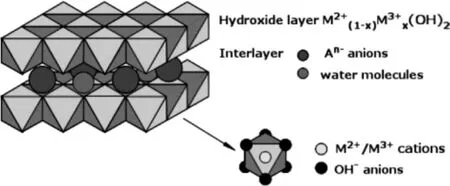
图1 层状双氢氧化物结构示意图Fig.1 Schematic diagram of layered double hydroxides
1 制备方法
对于层状双氢氧化物的制备,目前主要应用的制备方法包括了化学沉淀法、水热法、溶剂热法等。
1.1 化学沉淀法
化学沉淀法属于比较普遍且简易的方法。该方法使用均相化学前驱物作为基质材料,其中两种或更多种金属离子错综复杂地混合在一起,并且产生协同作用形成所需材料。其主要制备过程是将二价和三价金属硝酸盐化学物以一定的摩尔比溶于去离子水中,并在合适的温度下(一般60℃)搅拌一段时间,然后逐滴加入NaOH溶液并保持溶液pH在10~11左右,搅拌一段时间后,放置于合适温度下老化后制备而成。Brian[9]等采用共沉淀的方法制备了Mg-Al-CO3LDHs,其制备过程是首先将 n(Mg)∶n(Al)=2 的硝酸盐混合溶液逐滴的滴加到0.25 M的Na2CO3溶液中,通过加入NaOH保持pH=11,并搅拌2 h后放置于80℃油浴中回流24 h制备而成。
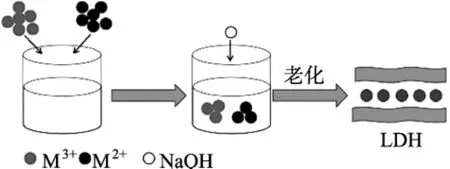
图2 沉淀法制备LDHs示意图Fig.2 LDHs schematic diagram of precipitation preparation method
1.2 水热法
水热法通常被用于增强层状双氢氧化物的结晶度。与其他方法相比,水热法可以得到结晶良好的分层均匀的双层氢氧化物。该方法的主要制备过程(如图3所示)是将二价、三价金属硝酸盐化学物以及尿素以一定的比列于水溶液中混合形成均质溶液,然后加入到反应釜中反应相应的时间制备而成。Li等[10]采用不同的nMg∶Fe值、不同的制备pH、不同的水热温度以及不同的水热时间等方式通过一步水热法制备了Mg-Fe LDHs来用于去除废水中的铀。结果表明,对铀去除的最大吸附容量(710.0 mg/g) 的制备条件为:nMg∶Fe=4∶1,pH=12.0,水热温度180℃,反应时间4 h。
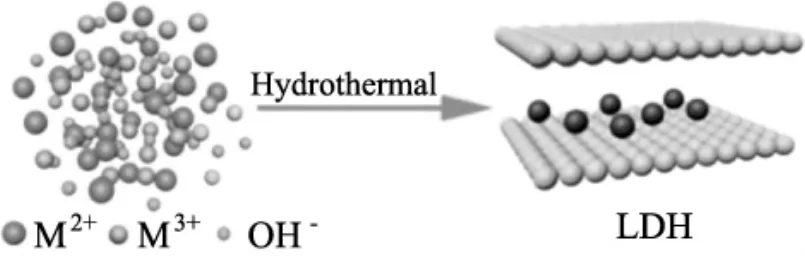
图3 水热法制备LDHs示意图Fig.3 LDHs schematic diagram of hydrothermal preparation method
1.3 溶剂热法
在对于纳米材料的制备方法中,溶剂热法是一种简易且环保的方法。与水热方法相似,不同在于水热是将两种金属混合在水溶液中形成均质溶液,而溶剂热则是将两种金属混合在有机溶液中形成均质溶液,然后将其放入反应釜在更高温度下反应制备而成。Zhang等[11]采用溶剂热法制备了一种新型的菱形Ca-Al-LDHs。其制备示意图见图4,制备过程为:2 mmol的硝酸钙、1 mmol的硝酸铝和7 mmol的油酸钠加入到含有20 mL的无水乙醇和30 mL的正己烷溶液中,然后加入10 mL 0.7 mol的NaOH并在600 r/min的速度下搅拌1 h,冷却至室温后放入100 mL的反应釜中置于180℃下反应24 h制备而成。
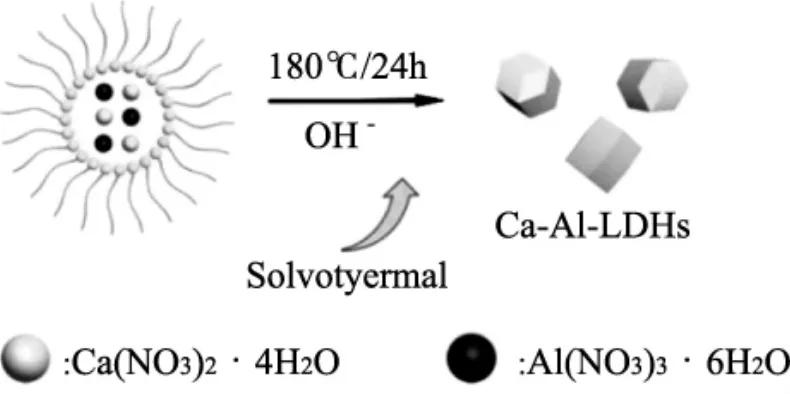
图4 Ca-Al-LDHs制备示意图Fig.4 Ca-Al-LDHs preparation schematic diagram
2 层状双氢氧化物对污染物的去除研究
2.1 层状双氢氧化物
当前采用LDHs作为吸附剂用于对水溶液中污染物的去除的研究很多。Guan等[12]采用不同的Ni/Co摩尔比制备了花状NiCo-LDH用于吸附水溶液中的甲基橙(MO)。结果表明,当Ni/Co=1∶1时,制备的材料对MO的去除平衡时间较短(50 min),且最大吸附容量可达到497 mg/g。He等[13]采用水热法制备了 nFe∶nAl=3∶1和 nFe∶nAl=2∶1 的Fe-Al LDH以用于去除Cr(VI)。结果发现,Cr(VI)在材料中的去除是因为材料中的Fe2+将Cr(VI)还原成Cr(III),从而达到去除效果。同时制备的该材料在共存阴离子SO42-、NO3-、CO32-等离子存在的情况下,材料对Cr(VI)的去除仅有轻微的影响。Sellaoui等[14]制备了Zn-Al LDH和Mg-Fe LDH以去除水溶液中的2-硝基苯酚。通过实验研究发现,两种材料对2-硝基苯酚均具有较好的去除效果,在298 K时,去除容量分别可达到 556 mg/g和 362 mg/g。
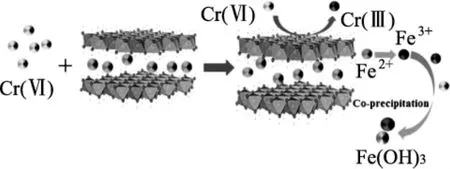
图5 Fe-Al LDH去除Cr(VI)示意图Fig.5 Schematic diagram of Cr(VI)removal by Fe-Al LDH
2.2 煅烧层状双氢氧化物
为了在LDHs内释放更多的吸附活性位点,研究者采用了一系列的方法,煅烧为其中一种。Fang等[15]首先采用共沉淀的方法制备前驱体,然后采用水热的方法获得LDHs,最后在不同的温度下(200℃、500℃、800℃) 煅烧形成所需的材料来用于对水溶液中的腐殖酸和富里酸进行去除。结果发现,500℃下煅烧形成的材料在pH=9.5时对腐殖酸和富里酸的去除效果最佳,最大吸附容量可分别达到98.8 mg/g和97.6 mg/g。Lee等[16]制备了煅烧的Mg/Al LDH以用于吸附水溶液中的As(V) 和Sb(V)。在煅烧温度400℃时,对两者的最大吸附容量可达到102.9 mg/g和303.3 mg/g。同时采用0.5 M NaOH和5 M NaCl混合溶液对该材料进行5次吸附-解吸后,该材料对As(V)的去除能力仍可保持70%;而对于Sb(V),其去除能力降低了32%。Lei等[17]采用水热法控制nNi2+/nFe3+=3,制备了Ni-Fe LDH,并在400℃下煅烧形成Ni-Fe LDO用于去除水溶液中的刚果红染料。相比于Ni-Fe LDH,Ni-Fe LDO具有更强的吸附能力,吸附容量从205 mg/g增加至330 mg/g。
2.3 功能化层状双氢氧化物
在对于LDHs材料的研究中发现,该材料在对于污染物的去除中,材料的选择性较大。因此为了增强LDHs材料的选择性能,研究者制备了一系列对污染物具有很好选择性的特定官能团来修饰LDHs。Wang等[18]采用一步水热法制备了3D花状磷酸功能化的层状双氢化合物(phos-LDH),并将之用于去除水溶液中的U(VI)。结果发现,制备的材料对U(VI) 的吸附容量在15 min即可达到平衡,最大吸附容量为923.1 mg/g。此外,制备的材料对U(VI) 具有很好的选择性,在共存阳离子(Na+、K+、Ca2+、Mg2+) 和共存阴离子 (Cl-、SO42-、CO32-)存在的情况下,该材料对U(VI)的去除率仍可达到90%以上。Shi等[19]制备了甘氨酸功能化的Fe-Mg LDH用于对水溶液中的As(V)、P(V)和Cr(VI)进行去除。结果发现,制备的材料对As(V)的选择性能最好,最大吸附容量可达到830 mg/g。当As(V) 的初始浓度为200 mg/L时,在30 min内,该材料对As(V) 的吸附能力即可达到82.5%。Lyu等[20]通过硫醇烯反应制备了1-丙烯-3-甲基咪唑鎓氯化物离子液体功能化Mg/Al LDH用于吸附水溶液中的刚果红染料。在最佳条件下,制备的材料最大单层吸附容量为288.63 mg/g,远高于十二烷基硫酸钠修饰的Mg/Al LDH (90.86 mg/g)。
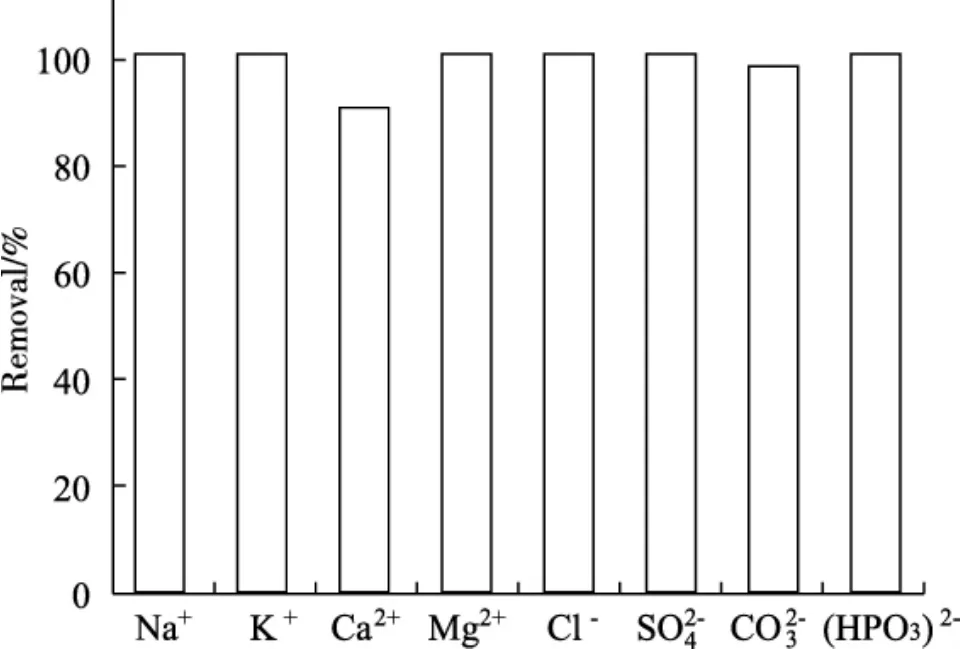
图6 共存离子存在下,phos-LDH对U(VI)的去除效果Fig.6 The removal effect of phos-LDH on U(VI)with co-existing ions
2.4 层状双氢氧化物复合材料
为了进一步增强层状双氢氧化物的性能,研究者采用了各种材料与其进行复合来增强对污染物的去除能力。Chen等[21]通过共沉淀法和水热处理制备了Ca/Al-LDH@CNTs复合材料以用于去除水溶液中的U(VI)。相比于CNTs,制备的材料对U(VI) 的吸附容量增强了4倍,在289.15 K时,最大吸附容量可达到382.9 mg/g。此外,在pH=8.0时,该材料对241Am(III)的去除率可达到91%左右。Xiong等[22]制备了Mg/Al层状氢氧化物-聚间苯二胺复合材料(LDH-PmPD)用于去除双氯芬酸钠(DCF)。结果表明,LDH的存在减弱了PmPD的积累密度,增加了比表面积,有利于DCF在LDH-PmPD表面的吸附。LDH-PmPD的最大吸附容量为588 mg/g,优于常规吸附剂。Zhang等[23]首先采用共沉淀方法制备了Zn-LDHs,并在碱性条件下原位制备了沸石/Zn-LDHs和沙/Zn-LDHs复合材料以用于对水溶液中的Cd(II)进行吸附。通过研究发现,制备的复合材料对Cd(II)的吸附能力均高于单独的沸石和沙,吸附容量提高了近(2~3) 倍。
3 去除机理
为了进一步明确LDHs对于污染物的去除机理,研究者采用了一系列的表征手段来探讨LDHs吸附污染物的相关机理,主要包括了FT-IR、EDX、XRD、XPS等。
3.1 FT-IR
FT-IR:主要通过吸附污染物后特征峰位置的变化,确定污染物的去除机理。Zaghloul等[24]通过对MgAl-LDH吸附甲基橙(MO) 染料后的FT-IR(见图7) 分析发现,在1127 cm-1出现新的振动峰归因于苯环中1,4取代基的拉伸振动;在1176 cm-1处的新峰对应于C-N拉伸振动。通过分析结果表明,MO吸附在MgAl-LDH表面。Wang等[25]通过研究CS@LDH吸附U(VI)后的FT-IR,发现U(VI)吸附后CS@LDH 1385 cm-1处的-OH特征峰轻微移至1391 cm-1,表明U(VI)和CS@LDH之间形成了强络合物 [-O···UO2]+或 [-OH-O···UO2]+。同时,进一步研究发现CS@LDH的-COO-(1701 cm-1)典型峰消失了,表明在U(VI)和CS@LDH之间形成了强大的内球表面复合物。此外,U(VI) 结合后,在(586~654) cm-1处的Ni-O和Al-O振动也轻微移至高波数,表明金属-氧官能团可能参与了吸附过程。更为重要的是,金属-氧官能团 (586~654) cm-1和非金属基团(1385~3474) cm-1在U(VI) 吸附后均消失,表明金属-氧官能团(Ni-O、Al-O) 和非金属基团(C-O、C-O-C、O-C=O)之间存在协同作用。
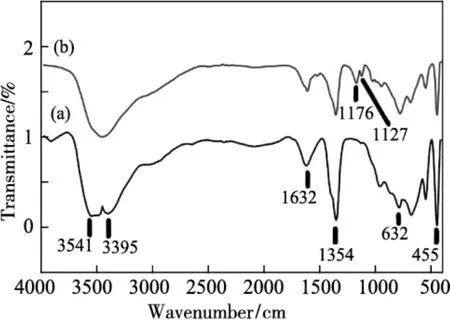
图7 MgAl-LDH吸附MO前后FT-IRFig.7 FT-IR before and after MO adsorption by MgAl-LDH
3.2 EDX
EDX:主要通过对污染物吸附前后的含量进行分析,以明确污染物在吸附剂上的吸附机理。Xie等[26]采用超声辅助共沉淀的方法制备了Fe-Al LDHs用于去除水溶液中的U(VI),并通过EDX对材料吸附U(VI)前后进行了研究。吸附前,制备的材料O,C,Fe,Na,Al,S的质量百分含量分别为1.03%,16.24%,10.01%,6.56%,3.39%,2.78%;吸附后,在EDX中出现了U(VI)的特征峰且质量百分含量为3.89%,表明U(VI)固定在Fe-Al颗粒结构中。Zhang等[27]通过研究MgAl-LDO吸附磷酸盐后的EDX图谱发现,材料吸附磷酸盐后,在EDX中出现了P的特征峰,且P的质量百分含量为6.67%,表明H2PO4-成功的嵌入到MgAl-LDO。
3.3 XRD
XRD:主要通过对吸附前后的结晶度的变化来判断污染物在材料上的吸附机理。Pan等[28]采用3D Mg-Al LDH用于吸附酸性橙7(AO7) 和甲基蓝(MB),通过XRD研究发现,AO7吸附后,(003) 峰的位置移至更高的角度,并且d值减小至2.65 nm。转变后的晶体结构与插入层间空间中的AO7阴离子的新型有机-无机相非常匹配,表明AO7通过阴离子交换取代了DS-阴离子并插入了LDH的层间。对于3DMA-MB,(003) 峰移至下角而d值不变。因此,可以推断出插层发生在MB与3D-MA-LDH之间,其中DS-MB单层作为主要的插层化合物。Zhang等[29]通过共沉淀法将半胱氨酸插入Mg/Al LDH制备了MgAl-Cys-LDH,用于对重金属(Pb2+、Cu2+、Cd2+) 去除。通过吸附后的XRD,发现吸附后材料的XRD图谱未发现明显移动,表明吸附过程并未明显的改变MgAl-Cys-LDH结构。同时,吸附 Pb2+后,在2θ=19.89°、30.26°、40.48°、53.45°和 54.14°出现新的特征峰,可归因于Pb3(CO3)2(OH)2;在2θ=25.96°、43.05°、51.17°和70.97°,则归因于PbS。这些结果表明,Pb2+与-OH和-SH存在反应。此外,进一步研究吸附Cu2+、Cd2+的XRD发现,XRD谱图并未出现新的特征峰。
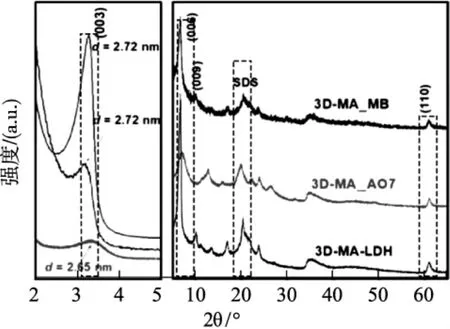
图8 3D Mg-Al LDH与其吸附AO7和MB的XRD图Fig.8 XRD diagram of Mg-Al LDH and the absorbed AO7 and MB
3.4 XPS
XPS:主要通过研究材料吸附污染物后的特征峰以及结合能的变化,来表征污染物在材料上的吸附机理。Jia等[30]制备了磁性生物炭/MgFe-层状双氢氧化物(LMBC)用于去除水溶液中的Pb2+。通过XPS研究发现,Pb2+吸附后,在结合能=138.3 eV出现Pb 4f特征峰,表明LMBC成功的吸附了Pb2+。同时进一步研究吸附Pb2+后的C 1s图谱发现,在284.6 eV、286.2 eV和(288~290) eV出现的振动峰,归因于C-C/C=C、C-O和金属碳酸盐。此外,吸附Pb2+后,金属碳酸盐的含量从14.15%增加至19.98%,表明形成了Pb3(CO3)2(OH)2。上述结果表明,材料对Pb2+的吸附机理主要是通过共沉淀。Jiang等[31]在低温(-4℃) 下制备了Ni2Fe-LDH用于去除水溶液中的MO。通过XPS研究发现,材料吸附MO之后,总谱图上S、N,表明MO吸附在Ni2Fe-LDH的表面。进一步研究Fe和Ni的结合能发现,吸附MO后结合能移至更高的结合能,表面阴离子染料和金属通过共价键结合。
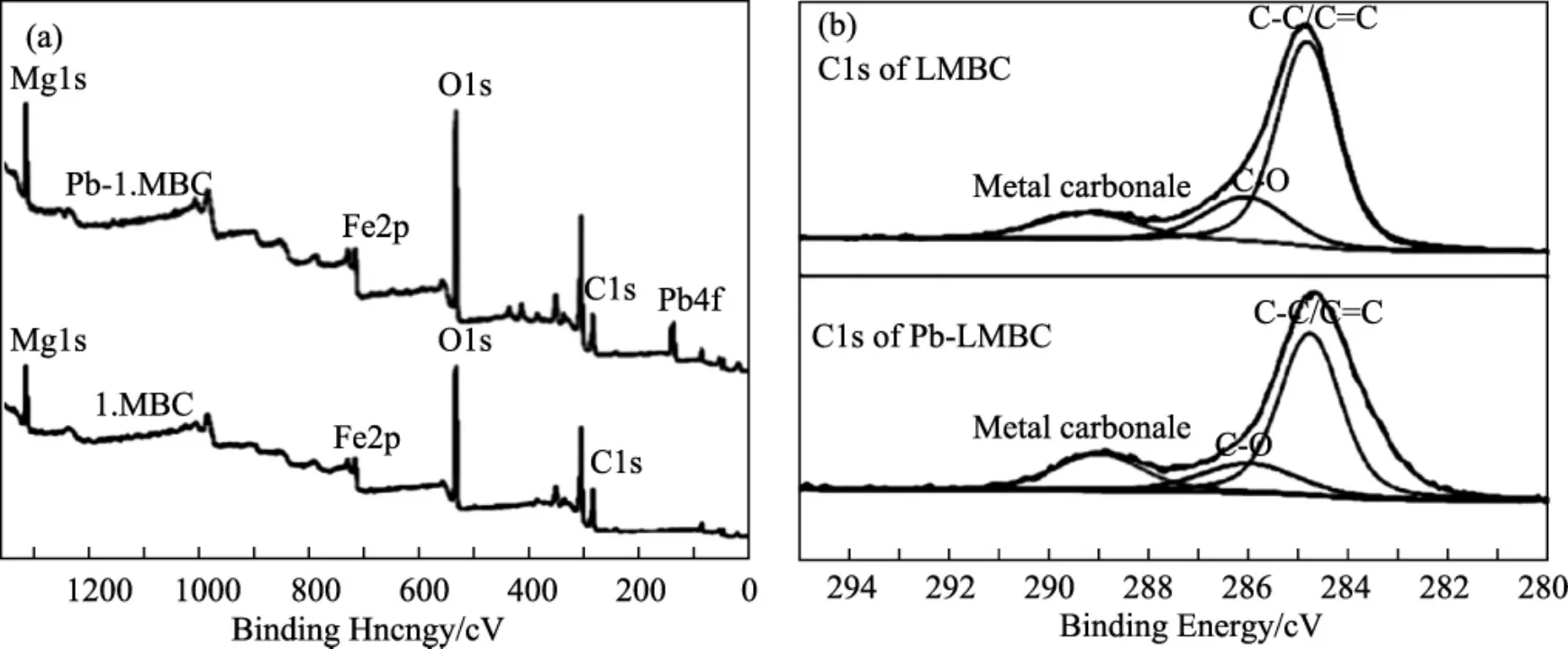
图9 LMBC和LMBC-P的XPS图谱Fig.9 XPS spectrogram of LMBC and LMBC-P
4 再生性研究
材料的再生性,不仅可以降低材料制备的成本,也利于材料的实际应用。因此,对于材料的再生性研究是必要的。Song等[32]采用水热法制备了两种新型三元 LDHs(MgAlFe LDHs和 NiAlFe LDHs)来用于对水溶液中的铀(VI)进行去除。通过5次吸附-解吸循环之后,两种材料对铀的吸附能力仅有轻微的降低。其中5次循环后,MgAlFe LDHs吸附能力降低6.2%,吸附容量从93.0 mg/g降低到88.1 mg/g;NiAlFe LDHs吸附能力降低7.4%,吸附容量从21.75 mg/g降低到20.13 mg/g。Ahmed等[33]采用CTAB作为引导剂以溶胶-凝胶法制备了一种新型介孔LDH来用于对靛蓝染料进行吸附。将该吸附后的材料采用温水清洗后2 h,再次用于对靛蓝染料进行吸附。结果表明,经过5次循环使用后,材料对靛蓝染料的吸附能力仍可保持90%的吸附能力。Kumar等[34]采用化学法制备了六角形Cl-ZnAl LDHs纳米片来用于去除水溶液中的Cr(VI) 和甲基橙(MO)。该材料的再生性结果研究见图10,从图中可以看出,在对于Cr(VI)和MO的共吸附中,该材料具有很好的再生性能,对两种污染物的去除能力随着材料的重复使用并没有明显的降低。
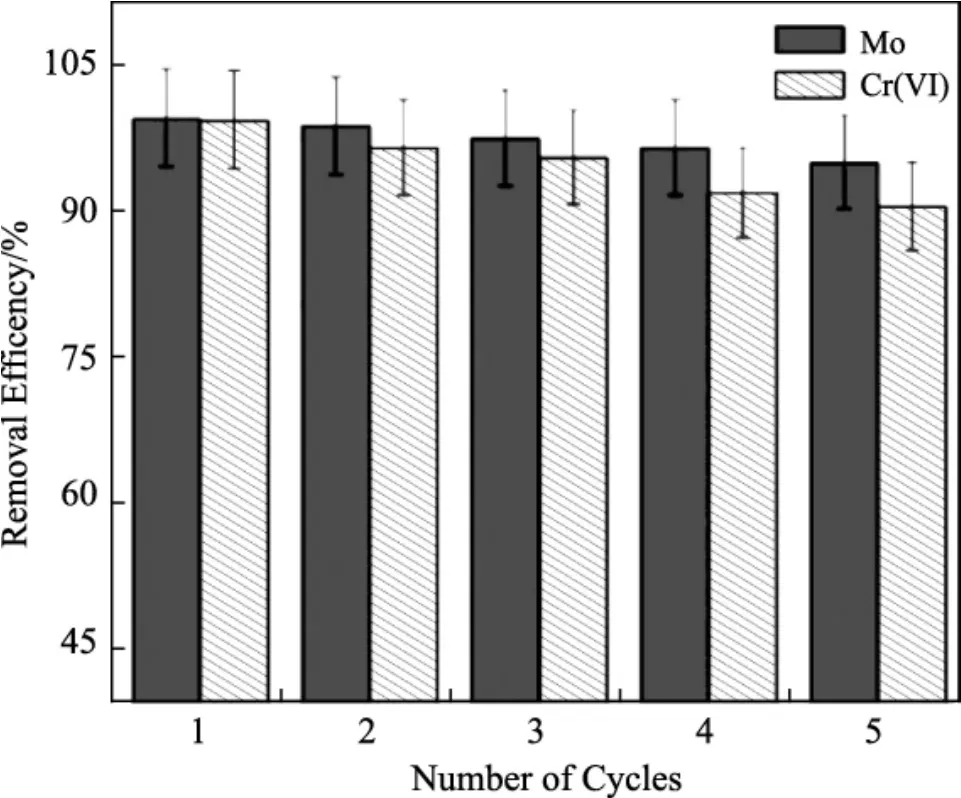
图10 Cl-ZnAl LDHs吸附Cr(VI)和MO的吸附-解吸图Fig.10 Adsorption-desorption diagram of Cr(VI)and MO adsorbed by Cl-ZnAl LDHs
5 结语
1)层状双氢氧化物,一种2D类水滑石结构,其可通过共沉淀法、水热法和溶剂热法制备而成。为了进一步增强其性能,研究者制备了一系列(煅烧、功能化、复合材料)的层状双氢氧化物基纳米材料来用于对水中污染物进行去除。结果表明,该系列材料对污染物的去除具有优异的性能。同时,研究者采取了FT-IR、EDX、XRD、XPS等表征手段来明确其对于污染物的去除机理。然而,目前层状双氢氧化物大多数只用于单一污染物进行去除,对于混合污染物的研究却很少;
2)目前对于多金属氧化物的形态的研究也很少,对于吸附剂的实际应用来说,易可回收的吸附剂在实际应用中更为方便。此外,目前大多数层状双氢氧化物在对于实际应用中对于污染物的选择性去除研究也较少,进一步增强其选择性,降低其制备成本以及便于实际应用是接下来的研究方向。

