温、湿度日变化对软枣猕猴桃枝条部分生理指标的影响
孙洪玲,雷 培,刘 硕,刘佳琪,董 坤,董 畅,张亚茹,孟凡娟*
(1 东北林业大学生命学院,哈尔滨 150040;2 黑龙江省农业科学院园艺分院,哈尔滨 150030;3 西昌学院,四川西昌 615000)
软枣猕猴桃(Actinidia arguta[Sieb.et Zucc.]Planch.ex Miq.)属于猕猴桃科猕猴桃属植物,为大型落叶藤本植物,分布广阔,从我国北方的黑龙江至南方的广西,广大山区均有分布,生态类型多样。其果实鲜美,表皮无毛,富含多种营养物质。不同的环境条件对其生长的影响较大。尤其黑龙江地区,温度变化较大,直接导致栽培型软枣猕猴桃的植株受害。因此,了解软枣猕猴桃对温度变化的应答机制较为重要,但此类研究却较少。当前对软枣猕猴桃的低温胁迫研究主要集中在种质资源及新品种选育、果实、抗寒基因的筛选与鉴定,以及抗寒机制的研究等方面。国内对主要分布在辽宁、吉林、北京及黑龙江等地的软枣猕猴桃进行低温胁迫研究。同时,目前有关研究也主要集中于某一时间点或者某一固定温度对软枣猕猴桃生长的影响。但是室内外的条件不一致,通常室外的条件变化较大,然而在室内外不同时间、 不同温度条件下研究软枣猕猴桃对环境的响应机制更接近生产实际。鉴于此,本研究选择我国东北地区哈尔滨软枣猕猴桃的主要起源地,针对该地区11月温度变化较为剧烈的现象展开研究。这个季节主要表现为气候多变,降温急剧,且温度日变化剧烈;另外,此时还存在0 ℃左右波动的日变化特点,有利于我们对频繁的温度变化与软枣猕猴桃植株生长之间关系的研究提供一些理论依据。
1 材料与方法
试验于2020年11月在黑龙江省农业科学院软枣猕猴桃试验站进行,软枣猕猴桃栽培品种为‘魁绿’‘龙城二号’‘丰绿’,均为人工培育的品种。栽培方式为温室和露地,温室选取‘魁绿’和‘龙城二号’,露地选取‘魁绿’和‘丰绿’,均选一年生枝条进行试验。
1.1 测定项目与方法
1.1.1 温度及湿度
将温度计、 湿度计固定在温室和露地可有效测定的地点,选取一天中的7:00、12:00、16:00 记录温度和湿度。
1.1.2 组织化学染色
染色方法参照雷培的方法并做部分修改。使用四唑氮蓝(NBT)和二氨基联苯胺(DAB)对超氧阴离子(O)和过氧化氢(HO)进行组织化学染色。采集不同时期的软枣猕猴桃茎段,分别浸在0.5 mg·mLNBT 溶液和0.5 mg·mLDAB 溶液中,并用锡箔纸包裹避光放置6 h,将染色好的茎段用95%乙醇80 ℃漂洗直至完全去除叶绿素,其间更换乙醇,最后用乳酸∶苯酚∶水(1∶1∶1,v/v)固定,观察和拍照。
1.1.3 丙二醛(MDA)、可溶性糖、脯氨酸(Pro)含量和水势的测定
丙二醛(MDA)测定方法采用硫代巴比妥酸法;可溶性糖含量测定采用硫酸蒽酮法;游离脯氨酸(Pro)含量的测定采用茚三酮比色法;水势利用TPPW-Ⅱ植物水势仪对软枣猕猴桃枝条进行测定。
1.2 数据处理
采用Excel 2010 进行数据的整理,利用Graphpad Prism 6 制图,采用SPSS 16.0 进行相关显著性分析。
2 结果与分析
2.1 温、湿度的变化
从表1可以看出,在11月这几个时间段,7:00露地和温室的最低温度均出现在11月10日,分别为-10°C 和1.6°C; 露地和温室的最高湿度均出现在11月13日,分别为82%和81%。12:00,露地和温室的最低温度均出现在11月10日,分别为1°C 和11°C;露地的最高湿度出现在11月15日,为46%,温室的最高湿度出现在11月10日,为72%。16:00,露地的最低温度出现在11月2日,为-3°C,温室的最低温度出现在11月2日和11月10日,均为9°C;露地最高湿度出现在11月2日,为58%,温室最高湿度出现在11月10日,为82%。综上所述,11月10日,露地和温室的温度最低。除11月13日7:00 外,露地湿度均低于温室湿度,且显著差异。11月,温室的最低温度均在0°C 以上,最高温度可达33.1°C,且温室的湿度和露地湿度差异明显。因此,本试验设置两个不同种植地点对软枣猕猴桃枝条的影响特点进行测定分析。
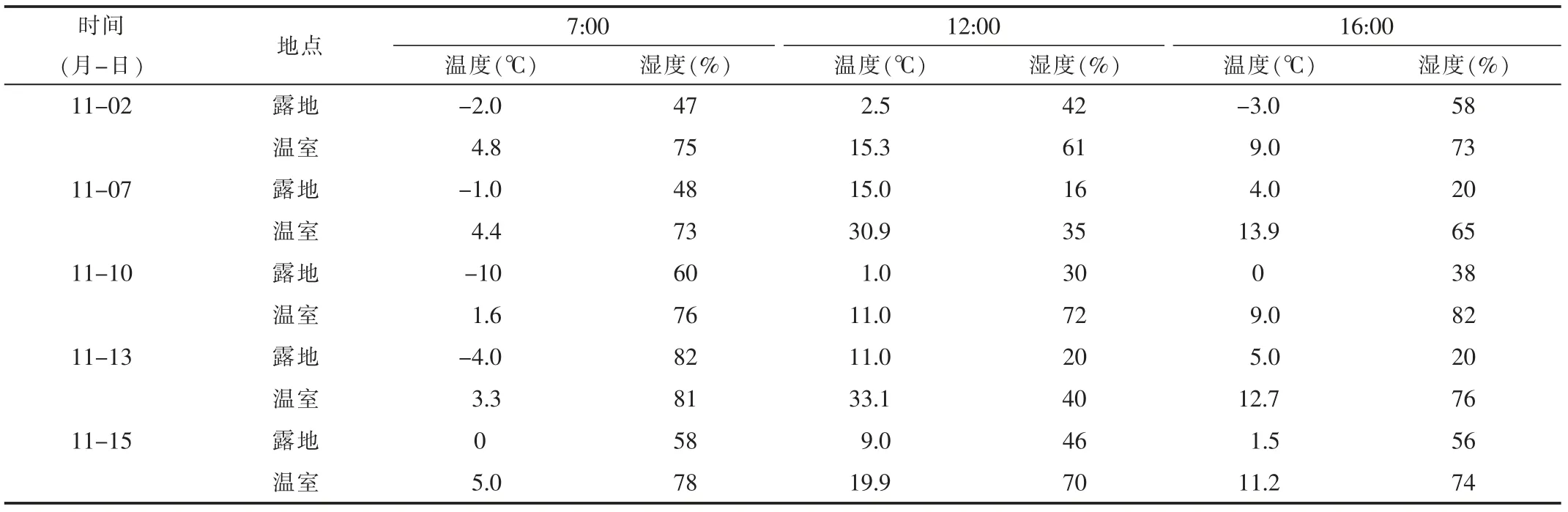
表1 11月的温、湿度变化
2.2 氧化程度
图1中DAB染色结果显示,11月7日各品种的染色程度明显比后面3个时间浅;11月10日和11月13日的12:00,每个品种较7:00和16:00的染色效果明显,且11月10日的染色程度更深;11月15日的7:00和16:00,每个品种的DAB染色程度明显比前3个时间深;11月15日露地‘魁绿’的染色程度低于温室‘魁绿’。
图1中NBT 染色结果显示,11月15日,各品种的NBT 染色程度高于前3 个时间,与DAB 染色结果一致。而露地‘魁绿’的NBT 染色程度均高于温室‘魁绿’,说明露地温湿度导致植株产生更多的活性氧(ROS)。从NBT 染色可以看出,枝条已经出现褐变现象,露地‘魁绿’的褐变现象比温室严重,且11月15日最为严重。
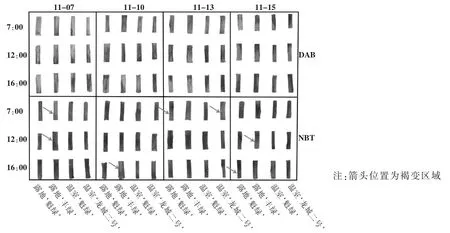
图1 枝条DAB 和NBT 的染色
2.3 MDA 的变化
由图2可知,11月2日,MDA 含量达到最高值,此时的最低温度为-2°C。露地‘丰绿’MDA 含量最高,为4.54 μmol·gFW,且露地‘魁绿’MDA 含量高于温室,温室中MDA 含量变化不明显。11月7日,各品种MDA含量均呈现先下降后上升趋势。7:00,温室温、湿度分别为4.4°C 和73%,其中‘龙城二号’MDA 含量具有最大值,为2.26 μmol·gFW,且温室‘魁绿’MDA 含量高于露地‘魁绿’。12:00 和16:00,露地‘丰绿’MDA 含量具有最大值,分别为2.197 μmol·gFW 和2.18 μmol·gFW,且露地‘魁绿’MDA 含量高于温室‘魁绿’。
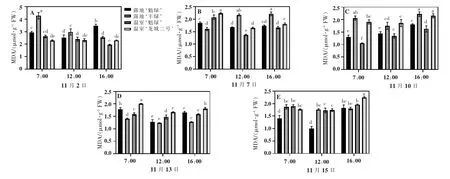
图2 枝条MDA 含量变化
11月10日,温、湿度差异显著,露地‘魁绿’、温室‘魁绿’‘龙城二号’均呈现上升趋势,露地‘丰绿’呈现先下降后上升趋势。16:00,露地‘丰绿’MDA 含量较高,为2.26 μmol·gFW;温室出现最低温度9°C,其中‘龙城二号’MDA 含量较高,为2.13 μmol·gFW。11月13日7:00,露地‘魁绿’和温室‘龙城二号’均出现最大值,分别为1.8、2.0 μmol·gFW,此时湿度差异不显著。11月15日,露地‘魁绿’、温室‘魁绿’‘龙城二号’MDA 含量最大值均出现在16:00,分别为1.83、1.93、2.25 μmol·gFW。7:00 露地‘丰绿’出现最大值,为1.83 μmol·gFW。综上所述,11月7—15日,露地‘魁绿’MDA 含量低于‘丰绿’,温室‘魁绿’MDA 含量低于‘龙城二号’。
2.4 水势的变化
由图3可以看出,随着胁迫时间增加,各品种的水势7:00 呈现先降低后升高趋势,说明水势与温、湿度具有较大相关性。11月7日7:00,各品种出现水势最低值,但差异不显著。露地‘魁绿’‘丰绿’、温室‘魁绿’‘龙城二号’的水势值分别为-3.30、-3.57、-3.64、-3.81 MPa。从11月2—13日,各品种的水势值差异不显著。仅11月15日,各品种的水势值差异显著,此时的水势值分别为-2.70、-2.93、-2.21、-3.44 MPa。16:00,各品种的水势值逐渐降低,与温度密切相关。从11月10日开始,水势下降明显,水势值均在-3.5 MPa 左右波动,此时露地和温室温度分别为0°C 和9°C,湿度分别为38%和82%。11月2—7日,露地‘魁绿’的水势值高于温室‘魁绿’;而11月10—15日,露地‘魁绿’的水势值低于温室‘魁绿’。由此看出,11月10日之后的温湿度变化对植株水势影响明显。
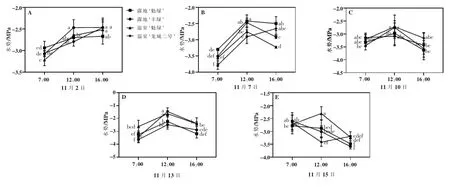
图3 枝条水势变化趋势
2.5 可溶性糖和脯氨酸的变化
由图4可知,随着胁迫时间增加,可溶性糖含量呈现先降低后上升再下降趋势,这与温度密切相关。除11月2日外,露地‘魁绿’的可溶性糖含量均高于温室‘魁绿’。11月10日,各品种呈现先下降后上升趋势,露地‘魁绿’和温室‘龙城二号’16:00 出现最大值,分别为19.29、13.68 mg·g;露地‘丰绿’和温室‘魁绿’7:00 出现最大值,分别为18.16 、14.41 mg·g。经过11月10日的最低温度和最高湿度胁迫后,各品种的可溶性糖含量在11月13日7:00 出现最大值,分别为30.06、26.71、20.76、25.36 mg·g。与11月13日数据相比,11月15日露地软枣猕猴桃的可溶性糖含量降低,此时的温度相对较低、湿度相对较高。
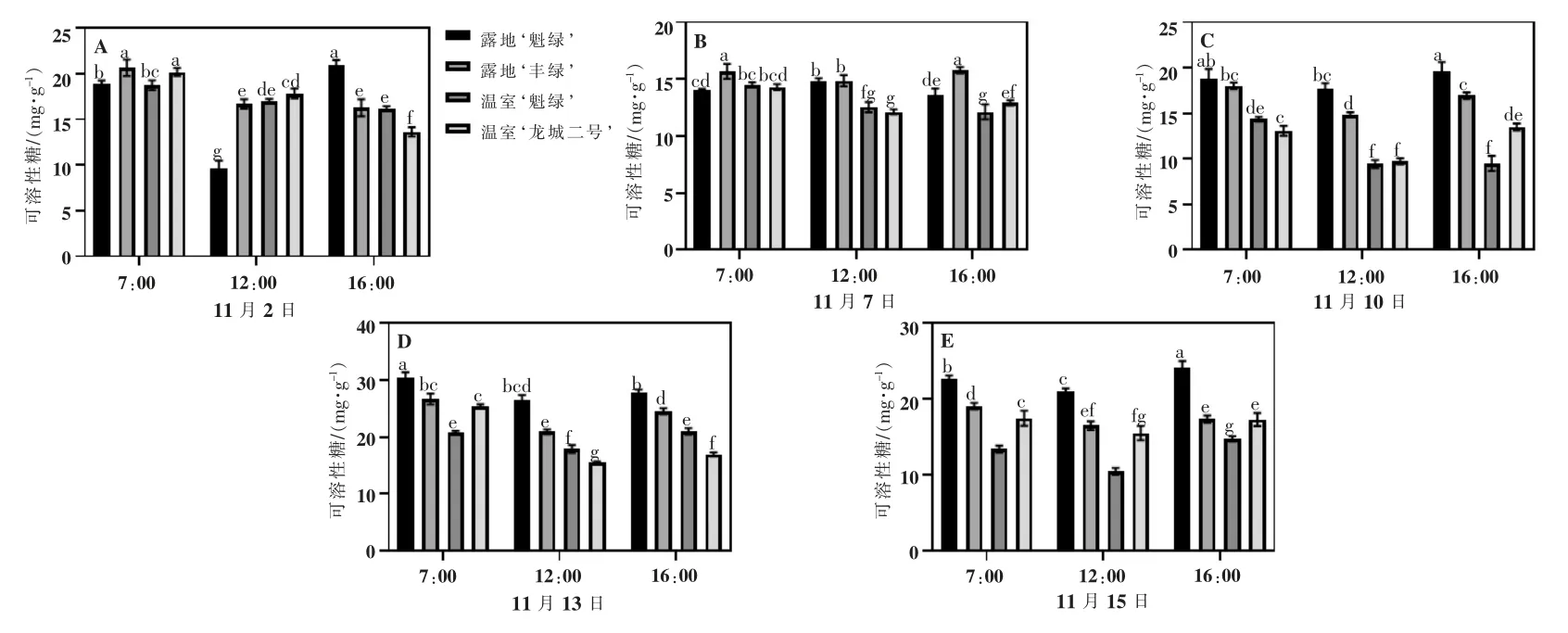
图4 枝条可溶性糖含量变化
由图5可以看出,随着胁迫时间增加,温室‘魁绿’脯氨酸含量呈现先升高后降低趋势,露地‘魁绿’脯氨酸含量变化不明显。11月7日,露地‘魁绿’‘丰绿’脯氨酸含量无明显差异;温室‘魁绿’‘龙城二号’脯氨酸含量达到最大值,分别为0.90、0.80 μg·gFW。11月10日,各品种的脯氨酸含量差异不显著,露地‘魁绿’脯氨酸含量均高于温室‘魁绿’。其中12:00,露地‘丰绿’含量最低,为0.06 μg·gFW,此时露地和温室最低温度分别为-10°C 和1.6°C,最高湿度均为82%。11月7日后,各品种的脯氨酸含量差异不显著。
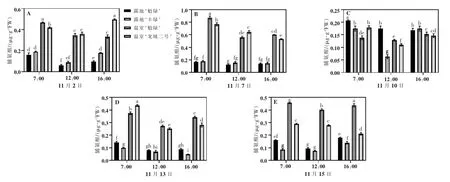
图5 枝条脯氨酸含量变化
3 讨论
本文选取温度在0 ℃上下波动的日期,通过不同环境对不同软枣猕猴桃品种的影响,记录其DAB 和NBT 染色情况,以及MDA、水势、可溶性糖及脯氨酸含量的变化,为探究温、湿度变化对不同软枣猕猴桃品种的影响,以及是否主要受温度影响提供理论依据。
植物在受到低温胁迫后,最直观的表现就是形态变化,生理生化方面的改变。在本试验中温湿度对植物的生理指标影响较大,且温度较低时更加明显。当植株遭受最初的低温胁迫时,植物体内开始生成大量的有害物质MDA,利用可溶性糖和脯氨酸等起保护作用的物质来抵御低温胁迫;之后其生成的MDA、可溶性糖和脯氨酸含量均有所下降。说明温湿度对植株进行冷驯化,使其具有耐受性。林苗苗指出,软枣猕猴桃在低温胁迫过程中,MDA 出现累积现象,但是可溶性糖和脯氨酸等渗透调节物质会起到不同程度的保护作用。软枣猕猴桃在越冬过程中渗透调节物质 (其中包括可溶性糖、可溶性蛋白及脯氨酸)含量升高,但抗寒性不同的软枣猕猴桃,其渗透调节物质含量也存在明显差异。
本研究发现,随着胁迫时间的增加,16:00 软枣猕猴桃各品种的染色程度普遍浓于7:00 和12:00,说明16:00 较7:00 和12:00 对软枣猕猴桃枝条伤害大。露地‘魁绿’NBT 染色程度都要高于温室,说明露地温、湿度对植物的胁迫伤害高于温室,主要受温度影响较大。低温胁迫条件下,植物枝条的皮层、韧皮部、木质部和形成层会失水,导致枝条内部发生褐变现象。因此,可以根据枝条的褐变程度判断植物的抗寒性强弱。钟海霞指出,多年生枝条的抗寒性强于一年生枝条,但在低温胁迫严重时多年生枝条也会出现褐变现象。从NBT 染色中可以看出,枝条已经出现褐变现象,说明枝条遭受低温胁迫,但露地‘魁绿’的褐变现象比温室‘魁绿’的严重,说明露地的低温胁迫更严重,且在11月15日尤为严重。
MDA 为过氧化反应产物,可用来表现植物的损伤程度。11月2日的MDA 含量达到最高值,温室‘魁绿’和‘龙城二号’的MDA 含量变化不明显,说明温室温、湿度对品种的影响不显著。11月7—15日,露地‘魁绿’的MDA 含量低于‘丰绿’,温室‘魁绿’的MDA 含量低于‘龙城二号’,表明‘魁绿’具有较强的耐寒性。7:00和16:00,每个品种的MDA 含量升高,此时对软枣猕猴桃的伤害最大,说明MDA 含量与温度呈负相关。
经过11月10日的最低温和最高湿度胁迫后,水势具有明显的下降趋势,脯氨酸含量变化不明显,MDA和可溶性糖含量从11月13日开始呈上升趋势。严岳华指出,当温度降低时,会直接或者间接地对植物造成水分胁迫,使细胞脱水,膜系统受害,透性加大,渗透势降低,水势也降低。该结论与本试验结果相近。当植株受到逆境胁迫时,通过可溶性糖的渗透调节作用来抵抗逆境胁迫。在本研究中,随着胁迫时间增加,可溶性糖含量呈现上升趋势,说明温、湿度对软枣猕猴桃影响较大。脯氨酸在植物抗逆境胁迫中起着多重作用,可作为渗透调节剂、蛋白质和细胞膜的稳定剂。植物受胁迫后合成亲水的脯氨酸,以维持细胞膨胀状态。脯氨酸含量逐渐增加。在本研究中,11月7日,温室 ‘魁绿’和‘龙城二号’脯氨酸含量达到最大值,说明在一定的温、湿度范围内,温、湿度有利于温室品种的脯氨酸积累。
4 结论
露地条件下,适当的低温在一定程度上可以提高软枣猕猴桃的耐寒性。随着低温胁迫的增加,DAB 和NBT 染色程度加深,MDA(丙二醛)、可溶性糖和脯氨酸呈现上升趋势,水势呈下降趋势。在本研究中,露地的温、湿度对软枣猕猴桃生长影响较大,可溶性糖和脯氨酸在不同程度上起到保护作用,导致露地软枣猕猴桃在一定程度上对低温的抵御性更强。

