6:2氟调羧酸在蚯蚓体内的毒理效应及代谢转化
宗玉璐,杨丽萍,赵淑艳*
6:2氟调羧酸在蚯蚓体内的毒理效应及代谢转化
宗玉璐1,杨丽萍2,赵淑艳1*
(1.大连理工大学海洋科学与技术学院,工业生态与环境工程教育部重点实验室,辽宁 盘锦 124221;2.南开大学环境科学与工程学院,天津 300071)
以赤子爱胜蚓()为受试生物,通过活体与离体实验,研究6:2氟调羧酸(6:2FTCA) 在蚯蚓体内的毒理效应和代谢转化机制.结果表明,6:2FTCA对蚯蚓体内丙二醛(MDA)含量和过氧化物酶(POD)活性无显著影响,但能够使过氧化氢酶(CAT)活性提高,使超氧化物歧化酶(SOD)和谷胱甘肽转移酶(GST)活性显著升高,说明6:2FTCA对蚯蚓产生了氧化胁迫效应.6:2FTCA在蚯蚓细胞色素P450(CYP450)和GST酶提取液中的降解动力学均符合一级动力学模型,在CYP450(0.014/h)酶液中的降解速率明显高于GST(0.006/h),其终端全氟羧酸(PFCAs)代谢产物为全氟己酸(PFHxA)、全氟戊酸(PFPeA)和全氟丁酸(PFBA),说明CYP450和GST参与了6:2FTCA在蚯蚓体内的代谢转化,且CYP450贡献大于GST.蚯蚓肠道好氧微生物对6:2FTCA具有显著的降解效果,终端PFCAs降解产物为PFHxA和PFPeA,而肠道厌氧微生物对6:2FTCA无降解作用.
6:2氟调羧酸;蚯蚓;毒理效应;酶代谢;肠道微生物
多氟和全氟化合物(PFAS)被广泛应用于工业和生活产品生产中,具有环境持久性、生物累积性和生物毒性等特点,是一类新型持久性有机污染物(POPs)[1-2].全氟辛酸(PFOA)是全氟羧酸(PFCAs)的一种典型代表产品,被美国环保署(EPA)列为疑似致癌物,于2015年停止相关产品生产[2].目前,国际上普遍采用短链同系物,如全氟己酸(PFHxA)和全氟丁酸(PFBA),或者一些含有非氟化结构部分的新型PFASs作为PFOA替代品[3].
6:2 氟调羧酸(6:2FTCA,C6F13CH2COOH)作为一种新型的PFOA替代品,被广泛应用于表面活性剂和含氟乳化剂等氟化工原料生产中,在生产和使用过程中释放到各种环境介质中[2,4].另外,一些PFCAs前体物质也能够在环境中通过生物和非生物途径转化为6:2FTCA,导致环境介质和生物体中6:2FTCA的污染[5-8].据报道,德国废水样品中6:2FTCA最高浓度为8.62μg/L[9],北美地表水中浓度达到10μg/L[9],山东德州土壤和植物中检出6:2FTCA最高浓度分别为0.12ng/g和0.57ng/g[10],黄河中游水相和颗粒相中检测到的6:2FTCA最高浓度分别为0.254ng/L和2.88ng/g[11].6:2FTCA对小鼠肝脏的毒性要较PFOA低[3],对斑马鱼胚胎具有发育毒性且能够抑制胚胎发育过程中红细胞的形成[9],对大型水蚤、摇蚊、浮萍和端足虫等表现出比PFOA更强的毒性[12-13].但是,6:2FTCA对陆生无脊椎动物的毒性尚不明确.虽然全氟化的PFCAs表现出较强的稳定性,但是一些含有非氟化结构的PFASs能够发生降解转化.目前,尚无以6:2FTCA作为母体化合物进行降解转化研究的报道,而6:2FTCA作为一些多氟物质中间代谢产物的相关研究报导较多.6:2 氟调醇(6:2FTOH)[4-8,14-15]、6:2氟调聚物磺酰胺烷基甜菜碱(6:2FTAB)[16]和6:2氟调磺酸(6:2FTSA)[17-18]等PFCA前体物质,都能够在环境介质或者动植物体内被降解生成中间产物6:2FTCA,随后6:2FTCA再进一步转化生成终端产物PFCAs.因此,推测6:2FTCA在环境中会被转化为持久性更强的PFCAs,是环境中PFCAs的潜在来源,其生态环境风险不可忽视.
蚯蚓是典型的陆生无脊椎动物,常被用作评价土壤外源化学污染物生态风险的指示生物[19].污染物在蚯蚓体内发生摄食、吸收、代谢转化和排泄等复杂的生物过程,而污染物在蚯蚓体内的代谢转化可能同时包括蚯蚓组织中的酶代谢和肠道中的微生物降解.细胞色素P450酶(CYP450)属于I相代谢酶,是广泛存在于生物体内的血红素酶系,催化的反应机制包括环氧化、脱烷基、羟基化和脱硫等[20].谷胱甘肽-S-转移酶(GST)属于II相代谢酶,催化结合反应使结合物更易于排出体外达到解毒的目的[21-22].研究显示,CYP450和GST是一些PFCAs前体物质在动植物体内发生代谢转化的关键酶[15,23-24]. CYP450和GST能够参与6:2FTSA在蚯蚓体内的代谢转化[22],CYP450是6:2FTSA在南瓜体内降解转化的关键酶[24],GST参与了6:2FTOH在大豆组织中的代谢[15].蚯蚓肠道特有的微生境中存在大量的厌氧和好氧细菌,这些细菌对一些有机污染物在蚯蚓体内的降解具有一定的贡献,如六氯环己烷(HCH)[25]和硫丹[26]能被蚯蚓肠道内分离出来的细菌所降解.然而,蚯蚓肠道微生物对全氟辛烷磺酰胺(FOSA)并未表现出降解能力[27].6:2FTCA能否在蚯蚓代谢酶及肠道微生物作用下发生降解,还有待进一步研究.
本研究以赤子爱胜蚓()作为模式动物,通过活体()和离体()实验相结合的方式,研究6:2FTCA在蚯蚓体内的生态毒理效应和代谢转化机制.通过分析氧化应激标志物的变化,如丙二醛(MDA)含量变化,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和GST活性变化,阐明6:2FTCA对蚯蚓的毒理效应;通过分析代谢酶(CYP450和GST)对6:2FTCA的代谢转化规律和蚯蚓肠道微生物对6:2FTCA的降解特性,揭示6:2FTCA在陆生动物体内代谢发生的内在机制和主要控制因素.为准确评估环境中6:2FTCA的生态风险和PFCAs的来源提供理论依据.
1 材料与方法
1.1 试剂与材料
6:2FTCA(98%)、全氟庚酸(PFHpA,98%)、全氟戊酸(PFPeA,97%)购自北京百灵威科技有限公司,全氟己酸(PFHxA,98%)购自Matrix Science公司,三氟乙酸(TFA,99%)、五氟丙酸(PFPrA,97%)和全氟丁酸(PFBA,98%)购自上海麦克林生化科技有限公司.烟酰胺腺嘌呤二核苷酸(NADH)和-烟酰胺腺嘌呤二核苷酸磷酸(NADP+)购自Biosharp.葡萄糖-6-磷酸脱氢酶(G6PDH)和葡萄糖-6-磷酸钠(GLC-6-PO4)购自Sigma-Aldrich(中国).高效液相色谱(HPLC)级甲醇(99.9%)和甲基叔丁基醚(MTBE)等购自大连博诺生化试剂有限公司.
1.2 活体暴露实验
供试土壤采自辽宁盘锦农田(种植蔬菜,周边无污染源)0~10cm的表层土壤,自然风干14d后过2mm筛,将配好的6:2FTCA甲醇储备液加入土壤中,混匀后放入通风橱中于室温下平衡4d[23]. 测得实验土壤中6:2FTCA的初始暴露浓度为62.0ng/g干重(dw).赤子爱胜蚓()购自辽宁华电环保科技有限公司蚯蚓养殖场(沈阳).室温(22~27℃)下驯化培养14d,挑取带有生殖环带的成熟蚯蚓(10条),清肠24h后放入装有100g染毒土壤(含水率为30%)的烧杯中,同时设置空白对照组(暴露于未染毒土壤中),室温下分别培养1,2,4,6,8,12,16和20d,每个处理设3个重复(=3)[19].取样后,将蚯蚓清肠、清洗后,立即放入冷水浴中处理.
1.3 蚯蚓粗酶提取液的制备
将蚯蚓样品(约0.3g)放入手动匀浆器中,再以1:9的比例加入磷酸盐缓冲液(0.05mol/L,pH 7.5),在冰水浴中研磨成匀浆[22].将蚯蚓匀浆在4℃、12000r/min下离心10min,收集上清液,于-80℃保存.用硫代巴比妥酸(TBA)法测定MDA含量,以牛血清蛋白为标准用考马斯亮蓝染色法测定蛋白质含量,氮蓝四唑(NBT)光化还原法测定SOD活性,愈创木酚法测定POD活性,紫外吸收法测定CAT活性,GST活性采用1-氯-2,4-二硝基苯(CDNB)比色法测定[22,28-29].MDA含量用nmol/g蛋白质表示,GST用nmol/min/mg蛋白质表示,其他酶活性(SOD、POD和CAT)用U/mg蛋白质表示.
1.4 体外暴露实验
将已清肠24h的蚯蚓放入甘油溶液中(15min, 0℃,20%)实施安乐死,然后用0.15mmol/L KCl溶液冲洗蚯蚓表面黄色液体后放入玻璃匀浆器中,以蚯蚓:缓冲液(0.1mol/L,pH=7.4,1mol/L EDTA, 0.15mmol/L KCl)=4:1的比例研磨成蚯蚓组织匀浆液.根据Kunze等[30]的方法稍作改动进行GST酶液提取(操作温度为0~4℃).取一部分匀浆于10000离心20min,上清液再于100000离心50min后过0.22µm滤膜,然后过GST琼脂糖纯化树脂进行净化后得到GST酶提取液.GST酶液保存在0.05mol/L磷酸盐和0.5μmol GSH(内含有10mmol/L KNO3+ 0.05mmol/L EDTA+ 2mmol/L NADH+3mM Na2MoO4)中,放入-80℃冰箱保存.根据Yang等[31]的实验方法提取CYP450粗酶液(0~4℃).另取一部分匀浆,于15000离心20min,上清液再于150000离心90min得到CYP450酶液粗提物.使用蚯蚓CYP450和GST ELISA试剂盒在酶标仪(美国Molecular Device)上测定蚯蚓匀浆和粗酶提取液中CYP450总量和GST含量.
在上述蚯蚓GST酶提取液(1mL)、CYP450酶提取液(0.5g)中分别加入50μL 6:2FTCA及经预培养的500μL NADPH再生系统(1.6mmol/L NADP+, 3.3mmol/LGlc-6-PO4,0.4U/mL,G6PDH,3.3mmol/L MgCl2+3.95mL磷酸盐缓冲液)在水浴摇床中(室温25℃、120rpm)进行体外培养实验,培养容器聚丙烯(PP)管用锡箔纸包裹.分别于0,2,6,8,12,24和32h进行取样.实验同时设置空白对照组Ⅰ(酶液),对照组Ⅱ(6:2FTCA+沸水于100℃中煮5min灭活后的酶液)和对照组Ⅲ(6:2FTCA),分别培养2h和32h后进行取样.所有实验均设置3组平行(=3).取样时,PP管中加入1/2体积甲醇并漩涡混匀1min以停止孵育反应,置于-20℃保存,留待PFASs提取与分析.
1.5 蚯蚓肠道微生物对6:2FTCA的降解实验
采用以往实验方法并稍加改进[32].将在6:2FTCA染毒土壤中驯化20d后的蚯蚓清肠并清洗干净,用75%的酒精麻醉蚯蚓后,取下蚯蚓胃以下的肠道.将0.1g(鲜重, ww)肠道放入灭菌手动匀浆器中,加入1mL经灭菌的预冷PBS(0.1mol/L,pH=7.0)均匀研磨至无明显颗粒.
好氧降解实验:在无菌操作情况下,取1mL的蚯蚓肠道匀浆液加入到100mL LB液体培养基进行混菌富集培养(水浴摇床,100r/min),取已培养至对数期的一代菌群于LB液体培养基中再驯化,二代菌群培养至对数期.取50mL培养到二代对数期的悬浮液加到离心管中进行离心(300r/min,10min)去掉其中的液体LB,取0.2mL肠道微生物悬浮液加入到装有6:2FTCA染毒处理的MSM培养基的PP瓶中,混合均匀后在水浴摇床中(25℃,100r/min)于好氧条件下进行培养.
开幕式由中国煤炭工业协会副会长兼秘书长姜志敏主持,中国煤炭工业协会副会长梁嘉琨致辞。全国政协常委、中国煤炭工业协会会长王显政,国家安监总局副局长、国家煤矿安全监察局局长付建华,国家能源局煤炭司副司长李豪峰,中国工业经济联合会常务副会长、中国煤炭工业协会副会长路耀华,中国煤炭加工利用协会理事长吕英,印度和乌克兰的选煤协会主席以及山东、陕西一些地方政府领导和神华、中煤能源、鞍山重机等企业的领导出席了开幕式。
厌氧降解实验:在厌氧手套箱内,另取1mL的蚯蚓肠道匀浆液加入到脱氧的LB液体培养基中,移出厌氧手套箱后置于水浴摇床(25℃,100r/min)中培养至二代对数期,离心后取0.2mL悬浮液加入到脱氧的MSM培养基(6:2FTCA)中于厌氧手套箱中进行降解实验.
实验全程避光,分别设置6:2FTCA为唯一碳源组(6:2FTCA+肠道微生物,F+M)、排除非生物干扰组(6:2FTCA+煮沸肠道,C)、6:2FTCA和外加碳源组(6:2FTCA+0.5%葡萄糖+肠道微生物,F+M+G),同时设置空白对照组.实验进行48h后,将与降解培养实验相同体积的甲醇加入到PP瓶中,旋涡震荡至混合均匀,-20℃保存,留待PFASs提取与分析.
1.6 样品前处理和仪器分析方法
土壤、蚯蚓和肠道微生物样品提取与纯化参照以往方法[27].使用Waters 超高效液相色谱(ACQUITY-UPLC)-质谱(MS, XEVO-TQS)联用仪,在负电喷雾电离模式下(ESI)对样品中PFASs含量进行定量分析.色谱柱为Waters UPLC C18 (1.7μm, 2.1mm×50mm),柱温为38℃.流动相为甲酸铵水溶液(A,2mmol/L)和甲醇(B),流速为0.45mL/min,进样体积为10μL,梯度洗脱条件:0~ 0.5min,25%B;0.5~5.0min,25%~85%B;5.0~5.1min, 85%~100%B;5.1~8.0min,100%B;8.0~10.0min,100%~ 25%B.质谱条件:毛细管电压-2.2kV,雾化气流速7.00bar,脱溶剂气流800L/h,锥孔气流150L/h,离子源温度150℃,去溶剂温度400℃.各PFASs的定量参数列于表1.
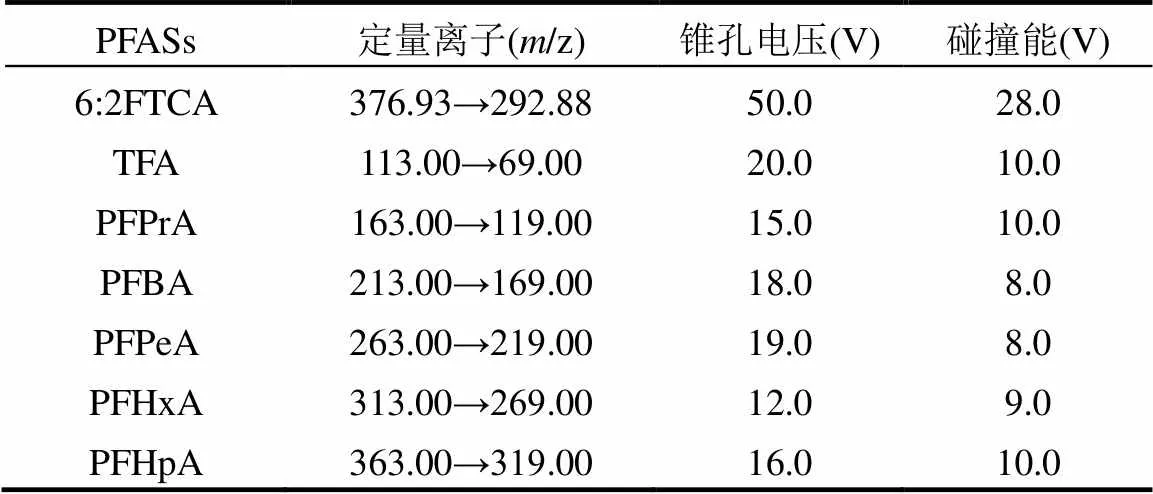
表1 PFASs的定量离子、锥孔电压和碰撞能
1.7 质量保证与质量控制
回收率采用空白基质加标,降解实验采用相同的步骤制备方法空白样,采用添加基质的外标法定量,方法检出限(MDL)信噪比为3:1.各基质中PFASs的回收率范围为81.4%~117.5%,所测目标物不进行回收率校正.PFASs在酶液和肠道微生物培养基中的MDLs分别为0.0017~0.0187pmol/g ww和0.0015~ 0.0029pmol/mL.
1.8 数据处理与分析
6:2FTCA在蚯蚓酶液中的降解速率常数(,1/h)由如下公式计算:
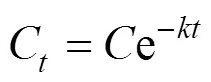
式中:C和分别为(h)时刻和孵育开始时蚯蚓酶液中6:2FTCA的浓度(nmol/g ww).
6:2FTCA暴露组与空白对照组毒理指标的差异显著性用单因素方差分析(ANOVA)和配对样本T检验进行统计学分析,肠道微生物对6:2FTCA降解影响的组间差异用Tukey’s检验其显著性(IBM SPSS Software, 22.0).<0.05认为有显著差异.
2 结果与讨论
2.1 6:2FTCA对蚯蚓的毒理效应

图1 6:2FTCA对蚯蚓体内MDA含量(A),POD(B)、SOD(C)、CAT(D)和GST(E)酶活性的影响
*<0.05
污染物进入机体后会激活机体的抗氧化防御系统以防止氧化损伤,包括酶(SOD、CAT、和POD等)和非酶抗氧化系统(脂质过氧化指标MDA等).在受到外源物质胁迫时,生物体内抗氧化系统为清除氧自由基或活性氧簇(ROS)会被诱导[28,33].如图1A所示,在暴露期间,6:2FTCA染毒组蚯蚓体内MDA含量与对照组相比无显著变化(>0.05).本课题组前期研究显示,相同及更短全氟碳链长度的PFCAs(TFA、PFPrA、PFBA、PFPeA、PFHxA、PFHpA)也未对蚯蚓体内MDA含量产生显著影响[34],这说明在6:2FTCA染毒土壤(62.0ng/g dw)中暴露20d后,6:2FTCA及其终端代谢产物对蚯蚓细胞均无明显的脂质过氧化作用.在暴露实验中(4~20d),处理组与对照组相比,SOD(图1B)活性显著提高41.4%~ 74.3%(<0.05),CAT(图1C)活性增加37.2%~44.4% (>0.05),而POD(图1D)活性基本无变化(>0.05).研究报道,6:2FTCA同系物8:2FTCA能够引起水生生物部分抗氧化应激标志物呈现出不同程度的氧化应激响应,如MDA含量增加、SOD活性增强,而CAT活性变化不显著[33].SOD活性变化用来表示遭受外源化学物污染后引起生物机体氧化胁迫的大小,是生物机体抗氧化系统的第一道防线,通过歧化反应将O2-催化为H2O2和O2,再被CAT和POD等H2O2清除酶捕获[28,35].SOD被显著诱导,说明蚯蚓已经受到氧化胁迫.6:2FTCA处理组中CAT活性与空白对照组相比,虽然数理统计分析显示不显著(>0.05),但其活性增加了37.2%~44.4%(4~20d),整体呈现一定的诱导效应,而POD活性基本无变化,说明在清除蚯蚓因暴露于6:2FTCA染毒土壤中而引起的H2O2的过程中,CAT比POD发挥了更为重要的作用.
2.2 CYP450和GST酶提取液对6:2FTCA的代谢转化

图2 CYP450(A, nmol/g ww)和GST(B, nmol/g ww)酶液中PFASs含量随时间的变化
粗酶提取液中CYP450总量和GST含量约是蚯蚓整体匀浆中含量的160倍.为了证实代谢酶在6:2FTCA生物转化中的作用,将蚯蚓的粗酶提取物(CYP450和GST)体外暴露于含有6:2FTCA的辅酶再生系统中.在空白对照组Ⅰ中未检测到PFASs,对照组Ⅱ中6:2FTCA没有明显的消耗,对照组Ⅲ中除6:2FTCA外未检测到其他PFASs,说明6:2FTCA在体外试验过程中无背景干扰,且微生物和光降解可忽略不计.在培养实验结束后,CYP450和GST粗酶液中PFASs总物质的量回收率为初始加入6:2FTCA物质的量的73.2%和89.7%,可能是由于部分物质挥发、容器吸附或其他未进行检测的中间代谢物(6:2FTUCA、5:3FTUCA、5:2sFTOH、5:3FTCA等)所致.
如图2所示,体外培养2h后, CYP450和GST酶液中母体化合物6:2FTCA的浓度开始下降,并且随着培养时间延长而逐渐降低.体外培养32h后,6: 2FTCA在CYP450和GST酶液中转化率分别为47.4%和20.7%.体外降解动力学符合一级衰减动力学模型,在CYP450和GST酶液中降解速率常数分别为0.014/h (2=0.890,<0.01)和0.006/h (2=0.941,<0.01).以上结果说明蚯蚓体内CYP450和GST在6:2FTCA生物转化中起关键作用,且6:2FTCA在CYP450酶溶液中的生物转化率和转化速率都比在GST酶溶液中要高,表明CYP450对6:2FTCA在蚯蚓体内生物转化的贡献要大于GST.此现象与其前体物质6:2FTSA在蚯蚓体内的酶代谢转化规律相似[27].

图3 不同实验组终端PFCA代谢产物物质的量比例
体外培养过程中,在粗酶液(CYP450和GST)中检测到了3个PFCA代谢终产物,包括PFBA、PFPeA和PFHxA(图2).随着培养时间延长,PFBA、PFPeA和PFHxA的含量逐渐升高,说明6:2FTCA能够在蚯蚓体内I相和II相代谢酶的作用下代谢转化生成3种不同碳链长度的PFCAs终产物.6:2FTCA在CYP450和GST粗酶液中代谢产物的物质的量百分比分别如下: PFHxA(40.2%)>PFBA(31.3%)>PFPeA (28.5%),PFBA(49.3%)>PFPeA(27.0%)>PFHxA(23.7mol%)(图3).PFBA和PFHxA分别是CYP450和GST粗酶液中主要的PFCA终端代谢产物.根据6:2FTCA终端降解产物的组成,推测6:2FTCA在蚯蚓粗酶液中的代谢转化路径如下: 6:2FTCA脱-HF后生成6:2FTUCA,再通过-氧化途径发生CH2-CH2, CH2-CF2和CF2-CF2键断裂,最终生成稳定的PFCA终端产物.然而,在蚯蚓体内未检测到PFHpA,说明6:2FTCA在蚯蚓体内并未发生-氧化.此代谢转化路径与6:2FTOH在植物体内的降解有些类似,即6:2FTOH通过连续脱氢和氧化作用生成6:2FTCA,然后再通过氧化和脱除一或者两个碳生成PFPeA和PFHxA[15].
2.3 蚯蚓肠道微生物对6:2FTCA的降解
暴露于有机污染物的蚯蚓肠道中含有大量的好氧和厌氧降解微生物.为了进一步研究蚯蚓肠道微生物对6:2FTCA的降解能力,模拟蚯蚓肠道环境分别进行好氧和厌氧降解实验.在好氧实验过程中,与初始加入培养基中的6:2FTCA浓度(F)相比,非生物干扰组(C)无显著变化,说明本实验过程中非生物干扰可忽略(图4).在以6:2FTCA为唯一碳源组(F+M)和外加碳源组(F+M+G)中,6:2FTCA浓度显著降低(<0.05),检测到PFHxA和PFPeA两种PFCAs终端降解产物.PFCA在F+M和F+M+G微生物实验组中的物质的量百分比分别如下:PFHxA(91.4%) >PFPeA (8.6%)和PFHxA(90.2%)>PFPeA (9.8%)(图3).另外,外加碳源组(F+M+G)降解效果明显强于以6:2FTCA为唯一碳源组(F+M),说明添加葡萄糖作为共代谢底物后,可能对好氧微生物共生网络产生了影响,从而促进了6:2FTCA的降解.而在厌氧环境中,各实验组之间无显著差别,且未检测到任何PFCAs产物.以上结果说明,蚯蚓肠道微生物在好氧环境下对6:2FTCA有明显的降解作用,而在厌氧环境下几乎无降解作用.
蚯蚓肠道微生物能够降解一些有机污染物,如六氯环己烷(HCH)[25]和硫丹[26].但是对杀虫剂克线磷[34]和FOSA等的降解较差[27].6:2FTCA前体物质在好氧情况下能够被微生物降解生成包括6:2FTCA在内的一系列中间产物,然后再进一步降解转化生成终端产物PFCAs.6:2FTOH能被污泥好氧堆肥微生物[14]、土壤好氧微生物[37]、烷烃降解菌和氟乙酸降解菌[38]等降解转化,6:2FTSA能被土壤[39]和沉积物[18]中的有氧微生物降解,生成6:2FTCA及其它中间产物,再经过脱除HF和-CF2-生成PFBA、PFPeA和PFHxA.另外,也有一些研究表明,6:2FTCA前体物质在厌氧环境下降解较为困难,如6:2FTSA[17]在土壤厌氧微生物作用下不发生降解,6:2FTOH在厌氧污泥中能降解为包括6:2FTCA在内的一些中间产物,但是不能再将6:2FTCA进一步降解生成PFCAs[38].因此,普遍认为,在厌氧产甲烷的环境下,缺少能将6:2FTCA等PFCA前体物质进一步氧化脱羧生成PFCAs的生化机制.

图4 蚯蚓肠道好氧微生物(A)和厌氧微生物(B)对6:2FTCA的降解作用.不同字母表示各值之间差异显著性
<0.05
虽然蚯蚓肠道好氧微生物对6:2FTCA降解产生的主要PFCA终端产物(PFPeA和PFHxA)与上述文献中报道的微生物降解(PFBA、PFPeA和PFHxA)有所区别,但是均证明了6:2FTCA在厌氧微生物作用下不能发生降解转化,而能够在好氧微生物作用下发生降解,且降解过程中只发生-氧化而没有发生-氧化.综上,6:2FTCA能够在蚯蚓肠道好氧微生物作用下通过-氧化、脱除-HF和碳键断裂等作用生成不同碳链长度的PFPeA和PFHxA,而在蚯蚓肠道厌氧菌作用下不发生降解.
3 结论
3.1 在6:2FTCA(62.0ng/g dw)染毒土壤中暴露20d后,蚯蚓体内虽未显示明显的脂质过氧化,但是部分关键抗氧化酶出现了一定的氧化应激效应.
3.2 CYP450和GST能够参与6:2FTCA在蚯蚓体内的代谢转化,最终降解产物为PFBA、PFPeA和PFHxA,且CYP450对6:2FTCA在蚯蚓体内生物转化的贡献要明显高于GST.
3.3 蚯蚓肠道好氧微生物对6:2FTCA具有明显的降解作用,终端PFCAs降解产物为PFPeA和PFHxA,而肠道厌氧微生物对6:2FTCA基本无降解作用.
[1] 吴思寒,吴雨濛,王双杰,等.全氟辛烷磺酰胺在小麦和蚯蚓中的富集与转化 [J]. 中国环境科学, 2021,41(5):2434-2440.
Wu S H, Wu Y M, Wang S J, et al. Bioaccumulation and biotransformation of perfluorooctane sulfonamide in wheat and earthworms[J]. China Environmental Science, 2021,41(5):2434-2440.
[2] Wang Z, Cousins I T, Scheringer M, et al. Hazard assessment of fluorinated alternatives to long-chain perfluoroalkyl acids (PFAAs) and their precursors: Status quo, ongoing challenges and possible solutions[J]. Environment International, 2015,75:172-179.
[3] Sheng N, Zhou X, Zheng F, et al. Comparative hepatotoxicity of 6: 2fluorotelomer carboxylic acid and 6: 2fluorotelomer sulfonic acid, two fluorinated alternatives to long-chain perfluoroalkyl acids, on adult male mice[J]. Archives of Toxicology, 2017,91(8):2909-2919.
[4] 张宏娜,温 蓓,张淑贞.全氟烷基羧酸前体物氟调醇的污染水平与生物转化研究进展[J]. 环境化学, 2021,40(1):65-82.
Zhang H N, Wen B, Zhang S ZEnvironmental occurrence and biotransformation ofperfluoroalkyl carboxylic acid precursors: Fluorotelomer alcohols[J]. Environmental Chemistry, 2021,40(1):65-82.
[5] Ellis, David A, Martin, et al. Degradation of fluorotelomer alcohols: A likely atmospheric source of perfluorinated carboxylic acids[J]. Environmental Science & Technology, 2004,38(12):3316-3321.
[6] Loewen M, Halldorson T, Wang F Yet al. Fluorotelomer carboxylic acids and PFOS in rainwater from an urban center in Canada[J]. Environmental Science & Technology, 2005,39(9):2944-2951.
[7] Scott B, Spencer C, Mabury S, et al. Poly and Perfluorinated carboxylates in North American precipitation[J]. Environmental Science & Technology, 2006,40(23):7167-7174.
[8] Zhao L, Folsom P W, Wolstenholme B W, et al. 6:2Fluorotelomer alcohol biotransformation in an aerobic river sediment system[J]. Chemosphere, 2013,90(2):203-209.
[9] Shi G, Cui Q, Pan Y, et al. 6:2fluorotelomer carboxylic acid (6:2FTCA) exposure induces developmental toxicity and inhibits the formation of erythrocytes during zebrafish embryogenesis[J]. Aquatic Toxicology, 2017,190:53-61.
[10] Zhang, H N, Wenet al. Determination of fluorotelomer alcohols and their degradation products in biosolids-amended soils and plants using ultra-high performance liquid chromatography tandem mass spectrometry[J]. J CHROMATOGR A, 2015,1404:72-80.
[11] 李琦路,程相会,赵 祯,等.黄河中游(渭南—郑州段)全/多氟烷基化合物的分布及通量[J]. 环境科学, 2019,40(1):228-238.
Li Q L, Cheng X H, Zhao Z, et al. Distribution and fluxes of perfluoroalkyl and polyfluoroalkyl substances in the middle reaches of the Yellow River (Weinan-Zhengzhou Section)[J]. Environmental Chemistry, 2019,40(1):228-238.
[12] Phillips M M M, Dinglasan-Panlilio M J A, Mabury S A, et al. Fluorotelomer acids are more toxic than perfluorinated acids[J]. Environmental Science & Technology, 2007,41(20):7159-7163.
[13] Mitchell R J, Myers A L, Mabury S A, et al. Toxicity of fluorotelomer carboxylic acids to the algae Pseudokirchneriella subcapitata and Chlorella vulgaris, and the amphipod Hyalella azteca[J]. Ecotoxicology and Environmental Safety, 2011,74(8):2260-2267.
[14] Qiao W, Miao J, Jiang Het al. Degradation and effect of 6:2fluorotelomer alcohol in aerobic composting of sludge[J]. Biodegradation, 2021,32(1):99-112.
[15] Zhang H, Wen B, Huang H, et al. Biotransformation of 6:2fluorotelomer alcohol by the whole soybean (L. Merrill) seedlings[J]. Environmental Pollution, 2020,257.
[16] D'Agostino L A, Mabury S A. Aerobic biodegradation of 2fluorotelomer sulfonamide–based aqueous film–forming foam components produces perfluoroalkyl carboxylates[J]. Environmental Toxicology and Chemistry, 2017,36(8):2012-2021.
[17] Wang N, Liu J, Buck R C, et al. 6:2Fluorotelomer sulfonate aerobic biotransformation in activated sludge of waste water treatment plants[J]. Chemosphere, 2011,82(6):853-858.
[18] Zhang S, Lu X, Wang N, et al. Biotransformation potential of 6:2fluorotelomer sulfonate (6:2FTSA) in aerobic and anaerobic sediment[J]. Chemosphere, 2016,154:224-230.
[19] General C. Test No. 207: Earthworm, Acute Toxicity Tests[J]. Oecd Guidelines for the Testing of Chemicals, 1984,1:1-9.
[20] Mizukawa H, Nomiyama K, Nakatsu S, et al. Organohalogen compounds in pet dog and cat: Do pets biotransform natural brominated products in food to harmful hydroxlated substances?[J]. Environmental Science & Technology, 2015,50(1):444-452.
[21] Huang H, Zhang S, Wang S, et al. In vitro biotransformation of PBDEs by root crude enzyme extracts: Potential role of nitrate reductase (NaR) and glutathione S-transferase (GST) in their debromination[J]. Chemosphere, 2013,90(6):1885-1892.
[22] Zhao S, Liu T, Wang B, et al. Accumulation, biodegradation and toxicological effects of N-ethyl perfluorooctane sulfonamidoethanol on the earthworms Eisenia fetida exposed to quartz sands[J]. Ecotoxicology and Environmental Safety, 2019,181:138-145.
[23] Zhao S, Liu T, Zhu L, et al. Formation of perfluorocarboxylic acids (PFCAs) during the exposure of earthworms to 6:2fluorotelomer sulfonic acid (6:2FTSA)[J]. Science of the Total Environment, 2021,760.
[24] Zhao S, Liang T, Zhu L, et al. Fate of 6:2fluorotelomer sulfonic acid in pumpkin (L.) based on hydroponic culture: Uptake, translocation andbiotransformation[J]. Environmental Pollution, 2019,252:804-812.
[25] Ramteke, P., W., et al. Isolation of hexachlorocyclohexane (HCH) degrading microorganisms from earthworm gut[J]. Journal of Environmental Science & Health, Part A: Environmental Science & Engineering, 1992,A27(8):2113-2122.
[26] Verma K, Agrawal N, Farooq M, et al. Endosulfan degradation by a Rhodococcus strain isolated from earthworm gut[J]. Ecotoxicol Environ Saf, 2006,64(3):377-381.
[27] Zhao S, Wang B, Zhong Z, et al. Contributions of enzymes and gut microbes to biotransformation of perfluorooctane sulfonamide in earthworms (Eisenia fetida)[J]. Chemosphere, 2020,238.
[28] Guo Y, Liu T, Zhang J, et al. Biochemical and genetic toxicity of the ionic liquid 1-octyl-3-methylimidazolium chloride on earthworms (Eisenia fetida)[J]. Environmental Toxicology and Chemistry, 2016,35(2):411-418.
[29] Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein–dye binding. Anal[J]. 1976,72(1/2):248-254.
[30] Kunze T. Purification and characterization of class alpha and Mu glutathione S-transferases from Porcine Liver[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 1997,116(4):397-406.
[31] Yang X, Song Y, Ackland M L, et al. Biochemical responses of earthworm Eisenia fetida exposed to cadmium-contaminated soil with long duration[J]. Bulletin of Environmental Contamination & Toxicology, 2012,89(6):1148-1153.
[32] Jennifer B, Christine B, Barnes C M, et al. Leaching and bioavailability of selected perfluoroalkyl acids (PFAAs) from soil contaminated by firefighting activities[J]. Science of The Total Environment, 2018,646:471-479.
[33] 刘晓玉,国 佼,王 智,等.栉孔扇贝对8:2FTCA的代谢转化与氧化应激响应[J]. 中国环境科学, 2021,41(10):4904-4915.
Liu X Y, Guo J,Wang Z, et al. Metabolic transformation and physiological response of Chlamys farreri to 8:2fluorotelomer carboxylic acid (8:2FTCA) [J]. China Environmental Science, 2021,41(10):4904-4915.
[34] 刘天琪.6:2氟调磺酸在蚯蚓体内的富集与代谢转化 [D]. 大连:大连理工大学, 2021.
Liu T Q. Bioaccumulation and Biotransformation of 6:2Fluorotelomer Sulfonic Acid in Earthworms (Eisenia fetida) [D]. Dalian: Dalian University of Technology, 2021.
[35] Yu, Byung, Pal. Cellular defenses against damage from reactive oxygen species[J]. Physiological Reviews, 1994,74(1):139-162.
[36] Cáceres T, Megharaj M, Naidu R. Toxicity and transformation of insecticide fenamiphos to the earthworm[J]. Ecotoxicology, 2011,20(1):20-28.
[37] Liu J, Wang N, Szostek B, et al. 6-2Fluorotelomer alcohol aerobic biodegradation in soil and mixed bacterial culture[J]. Chemosphere, 2010,78(4):437-444.
[38] Kim M H, Wang N, Chu K H. 6:2Fluorotelomer alcohol (6:2FTOH) biodegradation by multiple microbial species under different physiological conditions[J]. Applied Microbiology & Biotechnology, 2014,98(4):1831-1840.
[39] 陈 浩,赵立杰,王 宁,等.6:2氟调磺酸在土壤中的有氧微生物转化[J]. 科学通报, 2019,64(33):3441-3448.
Chen H, Zhao L J, Wang N, et al. Aerobic biotransformation of 6:2fluorotelomer sulfonic acid in soil (in Chinese)[J]. Chinese Science Bulletin, 2019,64(33):3441–3448.
[40] Zhang S, Szostek B, Mccausland P K, et al. 6:2and 8:2 fluorotelomer alcohol anaerobic biotransformation in digester sludge from a WWTP under methanogenic conditions[J]. Environmental Science & Technology, 2013,47(9):4227-4235.
Toxicological effects and biotransformation mechanism of 6:2fluorotelomer carboxylic acid (6:2FTCA) in earthworms ().
ZONGYu-lu1, YANG Li-ping2, ZHAO Shu-yan1*
(1.Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education, School of Ocean Science and Technology, Dalian University of Technology, Panjin 124221, China;2.School of Environmental Science and Engineering, Nankai University, Tianjin 300071, China)., 2022,42(6):2886~2893
Earthworms () were exposed to the soil spiked with 6:2 fluorotelomeric carboxylic acid (6:2 FTCA) to investigate the toxicological effects and biotransformation mechanisms of 6:2 FTCA in earthworms afterandexposure. Compared to the controls, no significant effects were observed in malondialdehyde (MDA) contents and peroxidase (POD) activities, while catalase (CAT) activities were increased, and superoxide dismutase (SOD) and glutathione-s-transferase (GST) activities were significantly induced in 6:2 FTCA treatments. This suggested that 6:2 FTCA induced oxidative stress in the earthworm cells. Biodegradation of 6:2 FTCA in the earthworm cytolchrome P450 (CYP450) enzyme extracts and GST enzyme extracts fitted well with the first order kinetics. The biodegradation rate in CYP450 extracts (0.014/h) was much higher than that in GST extracts (0.006/h), indicating CYP450 and GST were involved in the enzymatic transformation and CYP450 contributed more than GST to 6:2 FTCA biotrans formation in earthworms. Three terminal perfluorocarboxylic acid (PFCA) metabolites, including perfluorohexanoic acid (PFHxA), perfluoropentanoic acid (PFPeA) and perfluorobutanoic acid (PFBA) were observed in the enzyme extracts. The results of gut microbial degradation test showed that aerobic microorganisms contributed to 6:2 FTCA biodegradation in earthworms significantly, and the terminal PFCA metabolites were PFHxA and PFPeA, but anaerobic microorganisms didn’t contribute to 6:2 FTCA biotransformation in earthworms.
6:2 FTCA;earthworm;toxicological effects;enzyme metabolism;gut microorganisms
X171.5
A
1000-6923(2022)06-2886-08
宗玉璐(1995-),女,河南洛阳人,大连理工大学硕士研究生,主要从事研究方向为有机污染物环境行为.
2021-11-22
国家自然科学基金项目(41603106,42177374);中央高校基本科研业务费专项(DUT21JC42)
* 责任作者, 副教授, zhaoshuyan@dlut.edu.cn

