血清幽门螺杆菌抗体分型检测与胃黏膜病变的相关性
苏珈仪 刘春涛 王铁山 李文坤 杨 奕 武珊珊 李 鹏 吴 静*
(1.首都医科大学附属北京友谊医院消化内科 国家消化系统疾病临床医学研究中心 北京市消化疾病中心 消化疾病癌前病变北京市重点实验室,北京 100050; 2.首都医科大学附属北京友谊医院检验科,北京 100050)
目前幽门螺杆菌(Helicobacterpylori,H.pylori)仍是人类感染的最常见的细菌之一,全球大约有一半的人口感染H.pylori[1]。H.pylori感染与慢性胃炎、萎缩、肠化生、胃淋巴瘤以及胃癌等黏膜病变有密切的联系[2]。目前已有一些研究[3-4]探究了H.pylori致病性的毒素,如细胞毒素A(cytotoxin associated protein A,CagA)、空泡毒素A(vacuolar toxin A,VacA)、血型抗原结合黏附因子(blood group antigen binding adhesion factor,BabA)等,如临床研究[5]显示,CagA和VacA与早期胃癌以及癌前病变(如肠化生)密切相关。由于H.pylori的遗传多样性[6],不同菌株可携带和分泌不同的毒素和独立蛋白因子,通常表达和分泌CagA和VacA的菌株被视为高毒力致病菌。
H.pylori感染后需经一定时间(1~3个月)才能产生抗体,而H.pylori根除后 3~6个月抗体滴度明显下降。由于H.pylori感染一般都不能自行消失,如未经H.pylori根治的患者H.pylori抗体阳性即提示有H.pylori现症感染。血清H.pylori抗体分型检测是根据上述抗体的变化规律出现的一种新的检测手段,通过免疫印迹法显示血清中不同的抗体如CagA抗体、VacA抗体、尿素酶A(urease A,UreA)抗体、尿素酶B(urease B,UreB)抗体等。根据抗体分型检测的结果,可初步评估患者感染的菌株类型。本研究旨在分析不同毒素分型的H.pylori感染与慢性胃炎、萎缩、肠化生、早期胃癌的关系,探索与说明抗体分型检测的临床意义。
1 对象与方法
1.1 研究对象及分组
将2020年1月至2020年12月就诊于首都医科大学附属北京友谊医院消化内科,并进行H.pylori抗体分型检测的568例患者作为研究对象。纳入标准:相关临床信息完整的非孕妇患者;患者同时完善H.pylori抗体分型检测和胃镜检查,并得出明确镜下诊断和/或病理诊断;患者无严重的免疫性疾病并近期未服用免疫抑制剂、激素、非甾体抗感染药、抗生素、胃黏膜保护剂等。排除标准:明确既往根除过H.pylori(无法明确既往是否根除,但H.pylori抗体呈阴性者纳入H.pylori阴性组);排除非H.pylori相关的胃黏膜病变的患者(神经内分泌肿瘤、食管癌、食管胃底静脉曲张)以及自身免疫性萎缩性胃炎者;既往已进行胃黏膜病变切除者。
将其中慢性非萎缩性胃炎患者277例(H.pylori抗体阳性者87例,阴性者190例)作为慢性非萎缩性胃炎组;慢性萎缩性胃炎和肠化生患者260例(H.pylori抗体阳性者134例,阴性者126例)为慢性萎缩性胃炎+肠化生组,早期胃癌患者31例(H.pylori抗体阳性者18例,阴性者13例)作为早期胃癌组。本研究所涉及的患者临床信息已通过首都医科大学附属北京友谊医院医学伦理委员会审查,伦理审批号:2017-P2-013-02。
1.2 检测方法
所有受检者均空腹抽取2~5 mL静脉血,放入生化管中,3 000 r/min离心分离10 min,取上清液进行H.pylori抗体检测,包括CagA、VacA95、VacA91、UreA、UreB抗体。所有操作步骤均严格按照试剂盒说明书进行。H.pylori阳性表示上述抗体检测出现阳性结果,H.pylori阴性表示上述抗体检测均为阴性结果,代表未感染或既往根除过但抗体已阴性。根据H.pylori抗体分型测定结果,CagA、VacA均阳性的H.pylori感染列为高毒力菌株感染;CagA、VacA均阴性的H.pylori感染列入低毒力菌株感染。
1.3 统计学方法
采用SPSS 23.0统计软件进行数据分析处理,计数资料组间构成比较采用χ2或Fisher确切概率法检验。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组患者基本特征比较
慢性萎缩性胃炎+肠化生组和早期胃癌组50岁及以上、男性及H.pylori阳性的比例,明显高于慢性非萎缩性胃炎组,组间差异有统计学意义(P<0.05),详见表1。
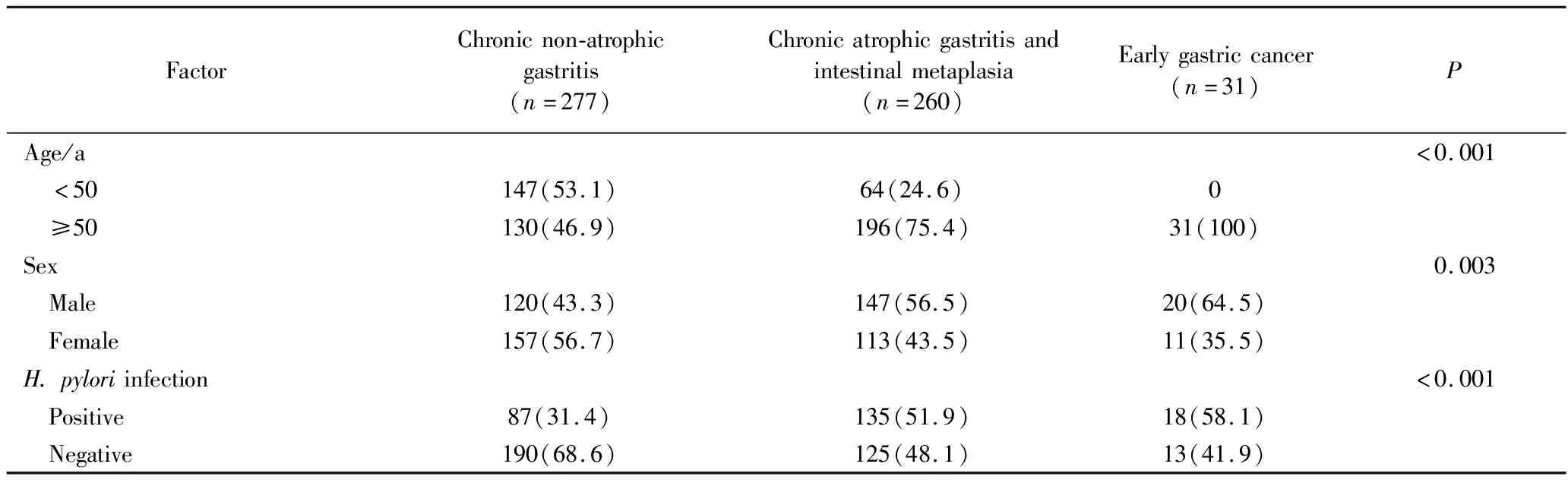
表1 3组基本特征比较
2.2 各组内H.pylori抗体分型在年龄间的分布情况
慢性非萎缩性胃炎组中,<50岁患者H.pyloriCagA和VacA抗体阳性率明显高于≥50岁患者,差异有统计学意义(P<0.05)。而慢性萎缩性胃炎+肠化生组<50岁和≥50岁两个年龄组间H.pylori抗体分型差异无统计学意义(P>0.05),详见表2。
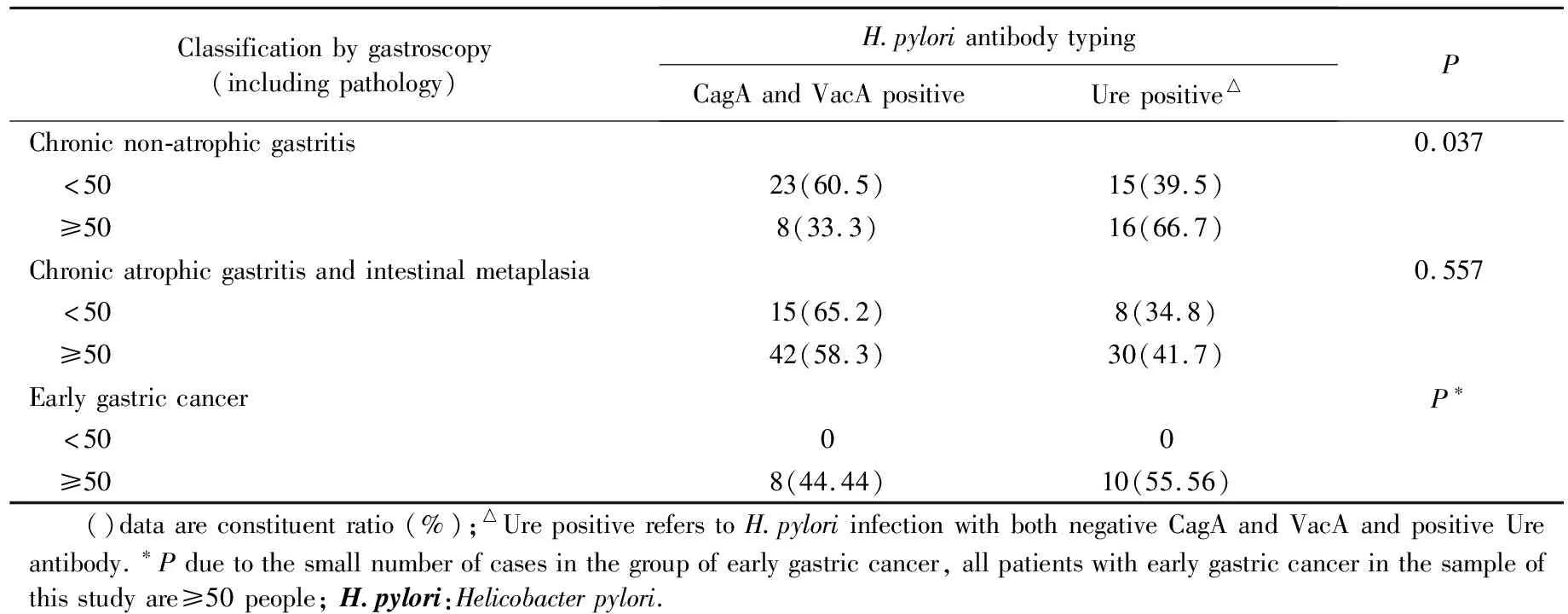
表2 H.pylori抗体分型在同一胃黏膜病变患者不同年龄组中的分布情况
2.3 各组间H.pylori菌株感染的分布情况
3组胃黏膜病变患者H.pylori菌株感染情况比较,差异有统计学意义(P<0.001),慢性萎缩性胃炎+肠化生组和早期胃癌组高毒力菌株感染比例及低毒力菌株感染比例均高于慢性非萎缩性胃炎组,详见表3。
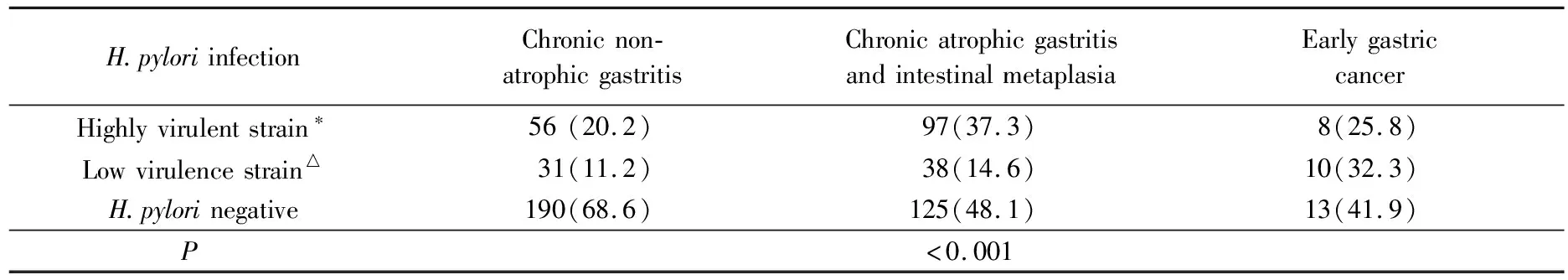
表3 不同H.pylori菌株感染以及H.pylori现未感染者胃黏膜病变的分布情况
3 讨论
本研究根据2020年1月至2020年12月就诊于首都医科大学附属北京友谊医院的患者的H.pylori抗体分型检测结果和胃镜及病理结果,分析了H.pylori感染后年龄和H.pylori抗体分型与不同胃黏膜病变的关系。
H.pylori感染与慢性胃炎、萎缩、肠化生、胃淋巴瘤以及胃癌等黏膜病变密切相关,中国慢性胃炎共识[7]指出,H.pylori感染几乎均会引起胃黏膜活动性炎症,长期感染后部分患者可发生胃黏膜萎缩、肠化生。世界卫生组织(World Health Organization,WHO)将幽门螺杆菌列为导致胃腺癌的第1类致癌物[8]。H.pylori感染与溃疡病变尤其是十二指肠溃疡有直接联系[9]。本研究显示,H.pylori感染组中慢性萎缩性胃炎和肠化生、早期胃癌比例明显升高,进一步提示H.pylori感染与上述病变有密切联系。同时随着年龄的增长,H.pylori感染者中慢性非萎缩性胃炎比例降低,慢性萎缩性胃炎和肠化生、早期胃癌比例增加。幽门螺杆菌胃定殖是在生命早期获得的(几乎在10岁之前),在没有抗生素治疗的情况下,一般会持续终生[9]。所以上述病变发病率很大可能会随着年龄增长而增加。
目前已发现H.pylori多种毒力因子,如CagA、VacA、OipA、BabA、BabB和IceA等[3]。CagA和VacA主要干扰上皮细胞的表型和结构,导致细胞屏障功能障碍,产生较强的炎症改变[4]。UreA、UreB是H.pylori存活的关键酶,可水解尿素产生氨中和胃酸,而非主要的毒力因子[10]。CagA和VacA是H.pylori的高毒力因子已明确,但全球不同地区的临床统计[11]发现上述2个毒力因子与胃黏膜病变的相关性并不一致。H.pylori抗体分型检测可测得CagA、VacA95、VacA91、UreA、UreB 5类抗体,国内有研究[12]显示该检测对H.pylori感染的检出率显著高于H.pylori尿素酶抗体,同时对于长期服用质子泵抑制剂的患者,H.pylori抗体分型不受影响,可辅助医生评估H.pylori菌株感染情况。本研究显示,慢性非萎缩性胃炎组<50岁者以H.pylori高毒力菌株感染(CagA和VacA阳性)居多,占比60.5%;慢性萎缩性胃炎和肠化生组的H.pylori高毒力菌株感染比例不随年龄改变,均稍高于低毒力菌株,同时H.pylori高毒力菌株感染者中慢性萎缩性胃炎和肠化生的占比高于低毒力菌株感染者,提示长期H.pylori高毒力菌株感染与萎缩性胃炎和肠化生的发生有相关性。本研究中早期胃癌比例在两种毒力菌株感染后差异无统计学意义,可能是由于早期胃癌样本量较少。
国内一些研究[13]提出CagA、VacA阴性菌株感染者,传染性小,致病能力弱,可根据抗体分型情况区分是否为产毒菌株,进而决定是否根除H.pylori,低毒力菌株感染者可暂不行根除治疗。本研究通过比较H.pylori的3种不同的感染情况(高毒力菌株感染、低毒力菌株感染、未感染或既往根除过但抗体已阴性)下胃黏膜病变发生比例,发现低毒力菌株感染者以及H.pylori现未感染者的慢性萎缩性胃炎和肠化生、早期胃癌的比例均很高,提示目前所定义的H.pylori低毒力菌株感染以及H.pylori根除后的状态与慢性萎缩性胃炎和肠化生及早期胃癌病变仍存在一定相关性,故不能依据CagA、VacA阴性而不进行根除H.pylori的治疗,同时提示,根除H.pylori后规律复查胃镜监测胃黏膜变化的重要性。近年来已发现一些新的致病因子,如IceA、OipA、BabA等,已明确表达IceA、BabA的H.pylori与十二指肠溃疡病变有显著相关性[9]。所以高毒力因子以及低毒力因子仍需进一步探索与实验验证,相应的抗体也需进一步探寻。
综上所述,慢性H.pylori感染与慢性萎缩性胃炎和肠化生及早期胃癌等胃黏膜病变的发生有一定相关性,H.pylori高毒力菌株感染与慢性萎缩性胃炎和肠化生、早期胃癌的发生有一定相关性。H.pylori低毒力菌株感染者中患慢性萎缩性胃炎和肠化生、早期胃癌等黏膜病变者仍占有一定比例,依据H.pylori毒力抗体分型来预测患者胃黏膜病变情况以及帮助决策是否根除H.pylori的可信度仍需探讨。

