左心室收缩功能对经皮冠状动脉介入治疗的急性下壁ST段抬高型心肌梗死患者预后的影响
孙 昊 郑美丽 郭宗生 张智勇 李晓涛
(1.首都医科大学附属北京朝阳医院心脏中心,北京 100020;2.中国中医科学院望京医院急诊科,北京 100102)
左心室收缩功能障碍与急性心肌梗死(acute myocardial infarction,AMI)后短期和长期病死率增加有关[1-2]。冠状动脉再灌注治疗通过减少心肌梗死(myocardial infarction,MI)面积和改善心肌重构明显降低了急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者的病死率和临床不良事件的发生率,改善了患者的临床预后[3]。左心室收缩功能障碍对急性下壁STEMI 患者的预后影响未得到广泛研究。本研究探讨左心室收缩功能对经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗后急性下壁STEMI患者1年临床预后的影响。
1 资料与方法
1.1 研究对象
回顾性选择2016年12月至2018年12月在首都医科大学附属北京朝阳医院成功接受了急诊PCI治疗的161例急性下壁STEMI 患者。入选标准:所有病例均符合2019年中华医学会制定的AMI诊断标准[4]。符合条件的患者均接受血管造影并成功行急诊PCI治疗。PCI成功定义为在罪犯梗死相关动脉(infarction related artery,IRA)成功置入支架并且IRA残余狭窄小于20%。应用心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)对梗死相关血管PCI术前和术后血流进行评估,即TIMI分级。排除标准:符合以下任何一项标准的患者被排除在研究之外:存在严重并发症的AMI的患者(包括乳头肌断裂、室间隔穿孔、心室破裂、心原性猝死等);不能长期应用抗血小板药物(阿司匹林、氯吡格雷)的患者;预期寿命<1年的患者;严重肝、肾功能不全患者;合并严重感染、恶性肿瘤、血液系统和免疫系统等疾病患者。所有手术操作均按照中华医学会心血管分会《经皮冠状动脉介入治疗指南》[5]定义规范操作。术后所有患者均在冠状动脉粥样硬化性心脏病(以下简称冠心病)重症监护室病房监护至病情稳定。
1.2 临床资料收集
所有符合入选标准的患者入院后收集的临床资料包括年龄、性别、高血压史、高脂血症史、糖尿病史、吸烟史、Killip分级、AMI标志物、血常规以及急诊生物化学检查。Killip分级标准如下:1级:无肺部啰音和第三心音;2级:肺部有啰音,啰音的范围小于 1/2 肺野,或有第三心音;3级:肺部啰音的范围大于1/2 肺野;4级:心原性休克。在患者出院前进行超声心动图检查,采用改良Simpson法进行左心室射血分数(left ventricular ejection fraction,LVEF)测量。按左心室收缩功能将患者分为2组:左心室收缩功能障碍组(LVEF<50%,31例)和左心室收缩功能正常组(LVEF≥50%,130例)。
1.3 随访与研究终点
通过门诊或电话随访术后1年时主要不良心脏事件(major adverse cardiac events,MACE)和支架内血栓的发生情况。MACE 包括所有全因死亡(包括心原性和非心原性死亡)、非致死性再发MI、缺血驱动的血管血运重建和卒中。当发生死亡事件无法分辨心原性或非心原性,则认为是心原性死亡所致。缺血驱动的血管血运重建定义为由缺血导致的血管任何节段,包括靶血管和非靶血管病变的主支以及该主支的所有分支,进行的PCI 或冠状动脉旁路移植术手术。支架内血栓参照美国学术联合研究会[6]定义,根据支架内血栓发生的不同时间以及获得的不同证据将支架内血栓定义为确定的、极可能的和推测可能的。
1.4 统计学方法
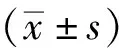
2 结果
2.1 患者一般情况及冠状动脉造影介入资料比较
与左心室收缩功能正常组患者相比,左心室收缩功能障碍组患者年龄较大,但差异无统计学意义(P>0.05)。在性别、病史、Killip分级以及症状发作时间等临床资料方面,两组间比较差异均无统计学意义(P>0.05)。与左心室收缩功能正常组相比,左心室收缩功能障碍组冠状动脉病变血管数量更多,差异有统计学意义(P=0.031)。左心室收缩功能障碍组血栓负荷分级明显高于左心室收缩功能正常组患者,差异有统计学意义(P=0.012);详见表1。
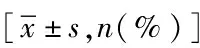
表1 两组患者间临床基线特征比较
两组患者冠状动脉造影和介入治疗资料比较,差异均无统计学意义(P>0.05),详见表2。
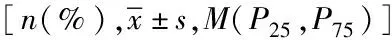
表2 两组患者间冠状动脉造影和介入治疗资料特征比较
2.2 偏相关分析
将年龄、性别、吸烟史、高血压病、2型糖尿病、Killip分级作为控制变量,LVEF与冠状动脉病变血管数量进行偏相关分析可知,LVEF与冠状动脉病变血管数量呈显著负相关(r=-0.205,P=0.009)。
2.3 随访结果
在1年随访期间,左心室收缩功能障碍组和左心室收缩功能正常组平均随访时间分别为(11.94±3.28)个月和(11.87±3.49)个月,组间比较差异无统计学意义(P=0.924)。
至全部随访期结束,两组患者1年预期MACE发生率差异无统计学意义(P=0.182);1年预期全因病死率(P=0.131)和心原性病死率(P=0.167)组间比较,差异无统计学意义;两组在再发MI(P=0.182)和缺血驱动的血管血运重建(P=0.475)方面,差异均无统计学意义;随访期间的两组间的支架血栓形成发生率差异亦无统计学意义(P=0.937),详见表3。
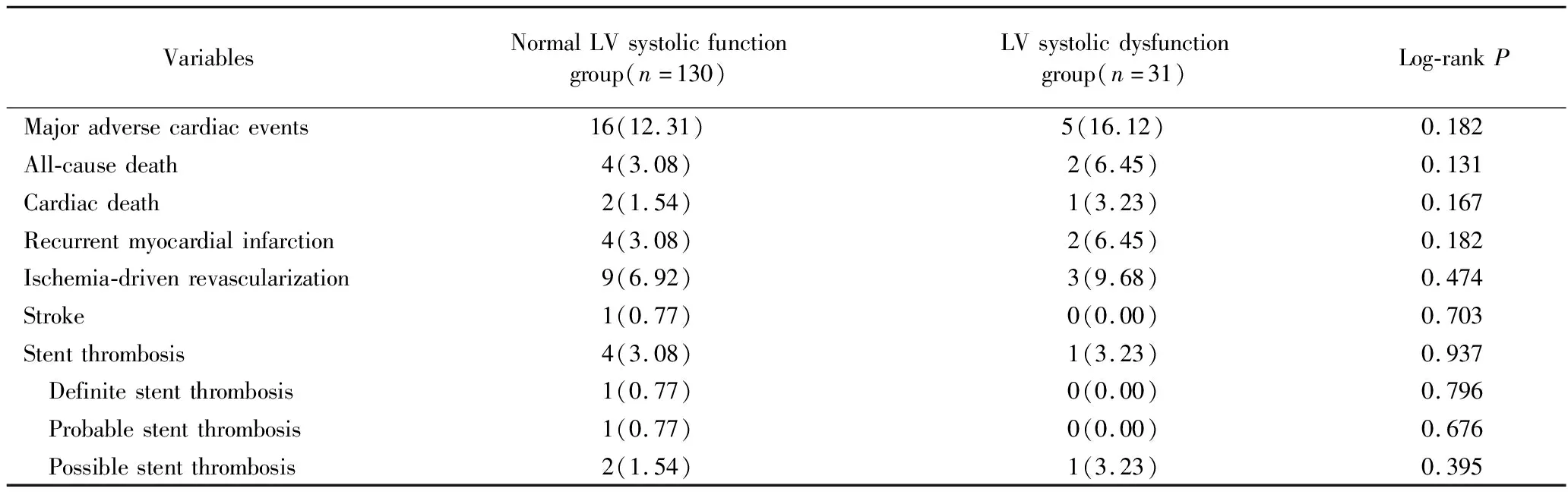
表3 两组1年随访期间的临床结果
2.4 Cox回归分析
单因素Cox回归分析显示,年龄(HR=1.039,95%CI:0.998~1.080,P=0.060)、糖尿病(HR=2.656,95%CI:1.127~6.259,P=0.025)、既往PCI史(HR=3.022,95%CI:0.873~10.462,P=0.081)、Killip 3~4级(HR=7.744,95%CI:2.548~23.541,P<0.001)、冠状动脉病变支数(HR=2.228,95%CI:1.338~3.712,P=0.002)、LVEF(HR=0.951,95%CI:0.920~0.983,P=0.003)为本研究定义的术后1年MACE发生的预测因子,将上述变量纳入到多因素Cox回归模型进行分析,结果显示,糖尿病史(HR=2.800,95%CI:1.036~7.541,P=0.042)、冠状动脉病变血管支数(HR=1.852,95%CI:1.064~3.222,P=0.029)和Killip 3~4级(OR=4.889,95%CI:1.394~17.144,P=0.013)为本研究定义的预测术后1年MACE发生的危险因子;高LVEF(HR=0.948,95%CI:0.910~0.988,P=0.011)为本研究定义的预测术后1年MACE发生的保护因子。
单因素COX回归分析显示,Killip 3~4级(HR=13.356,95%CI:2.392~74.572,P=0.003)、LVEF(HR=0.911,95%CI:0.849~0.978,P=0.010)为本研究定义的术后1年全因死亡发生的预测因子,将上述变量纳入到多因素Cox回归模型进行分析,结果显示,Killip 3~4级(HR=7.420,95%CI:1.300~42.400,P=0.024)为预测术后1年全因死亡发生的危险因子;高LVEF(HR=0.919,95%CI:0.853~0.990,P=0.027)为预测术后1年全因死亡发生的保护因子。
基于竞争风险模型的单因素生存分析显示,既往PCI史(SHR=3.756,95%CI:0.852~16.562,P=0.080)、冠状动脉病变支数(SHR=2.282,95%CI:1.179~4.416,P=0.014)为术后1年本研究定义的缺血驱动的血管血运重建发生的预测因子,将上述变量纳入到基于竞争风险模型的多因素生存分析,结果显示,冠状动脉病变血管支数(SHR=2.170,95%CI:1.063~4.428,P=0.033)为预测术后1年缺血驱动的血管血运重建发生的危险因子。
3 讨论
目前,缺乏左心室收缩功能对经PCI治疗后急性下壁STEMI患者预后影响的相关研究。在本研究中,在经PCI治疗的急性下壁STEMI患者中,左心室收缩功能障碍组和正常组患者具有相似的临床特征,但在血管造影和介入治疗特征方面,左心室收缩功能障碍组患者具有更高的冠状动脉病变血管支数和血栓负荷。1年临床随访期间,左心室收缩功能障碍组与正常组具有相似的临床不良事件发生率。
在左冠状动脉主干或左前降支闭塞导致的急性前壁MI患者中,LVEF降低很常见;但右冠状动脉或左回旋支闭塞引起的急性非前壁MI患者中,LVEF也可降低[7-8]。理论上,对于下壁MI患者,其他血管病变的支数,尤其是前降支受累,是引起患者左心室收缩功能障碍的重要因素,本研究显示,LVEF与病变血管数量呈显著负相关,提示病变血管数量增多导致的缺血面积增大可能与左心室收缩功能障碍有关。
不同的临床特征、心电图特征和治疗干预措施已被确定为AMI临床转归的独立预测因素。研究[9-10]显示,高龄、糖尿病、肾功能不全、LVEF降低和急性心力衰竭,如Killip≥2级,是AMI患者病死率的预测因素。研究[11]显示,与右冠状动脉梗死相比,左前降支和回旋支梗死的患者具有更高的病死率。与前壁MI相比,下壁MI的危险性较低,有研究[12]表明下壁MI的院内病死率约为急性前壁MI的一半。与急性前壁MI患者相比,急性下壁MI患者心原性休克的发生率较低,急性前壁MI合并心原性休克的患者具有更高的住院病死率。研究[13]显示,合并右心室梗死的急性下壁MI的患者住院期间临床事件发生率高于无合并右心室梗死的患者,而中期临床事件发生率在两组间差异无统计学意义。研究[14-15]表明,急性前壁MI患者比急性非前壁MI患者有更大的梗死面积和更高的病死率。研究[16]显示,急性前壁MI患者最重要的危险因素是临床变量,而不是血管造影变量。HORIZONS-AMI研究[17]显示,在急性非前壁STEMI患者中,高龄、糖尿病、肾功能不全、LVEF降低、Killip≥2级、PCI术后TIMI血流减少和ST段回落延迟是3年病死率的独立预测因素,且具有这些危险因素的患者死亡风险较高。此外,HORIZONS-AMI研究[17]表明,PCI后TIMI血流减少是唯一能独立预测非前壁STEMI直接PCI术后长期病死率的血管造影变量。术后TIMI血流分级≤2被称为慢/无复流,与微血管完整性受损有关,术后慢/无复流与MI患者发生长期不良事件的风险增加有关。本研究显示,LVEF升高是经PCI治疗急性下壁STEMI患者全因死亡的保护性预测因子,而未能显示术后慢/无复流为接受直接PCI治疗的急性下壁STEMI患者不良临床事件发生的独立危险性预测因素。
本研究结果显示,两组患者1年预期临床事件发生率比较差异无统计学意义。本研究中左心室收缩功能障碍组仅25.81%(8/31)的患者LVEF<40%,而74.19%(23/31)的患者LVEF≥40%,因此组间分析的结论更多反映的是对左心室收缩功能轻中度障碍患者的判断,而限制了对左心收缩功能重度障碍(LVEF<40%)患者的判断。
研究[18-19]表明,MI后左心室收缩功能障碍的患者卒中发生率较高,这可能与左心室运动不全或运动障碍区域左心室血栓形成倾向增加有关。一项对左心室收缩功能障碍患者的观察研究[19]显示,在5年的随访期内,LVEF降低是卒中事件的独立预测因素。而有研究[17,20]表明,LVEF降低与再梗死、血管重建或卒中的发生率增加无关。本研究在随访期间没有发现左心室收缩功能障碍组和左心室收缩功能正常组患者间卒中发生率差异有统计学意义。
本研究存在一定局限性。纳入的研究对象较少,而左心室收缩功能障碍的患者相对更少,未进一步将左心室收缩功能障碍的患者进行亚组分析,对于左心室收缩功能重度障碍的患者未能进行进一步分析,降低了本研究的敏感性,限制了结论的解读,因此本研究的结论需要进一步大样本临床试验证实。LVEF正常组存在9例(6.92%)射血分数保留的心力衰竭患者,本研究仅研究了合并左心室收缩功能障碍对本研究患者人群预后的影响,而未研究合并心力衰竭对预后的影响。本研究的结果只适应于符合本研究纳入和排除标准的患者,因此可能存在影响结果的未知偏倚。此外,两组样本量相差较大,可能会导致结果的偏倚。最后,临床随访中没有系统地评估左心室收缩功能的变化,关于左心室收缩功能恢复对预后的影响还没有结论。本研究随访时间较短,患者长期预后仍有待于进一步研究。
总之,本研究显示,在1年的临床随访期间,接受直接PCI治疗的急性下壁STEMI患者中,左心室收缩功能障碍的患者与左心室收缩功能正常的患者具有相似的临床不良事件发生率。由于本研究纳入研究样本量少,随访时间短,需进行进一步大样本长时间的随访研究进行验证。

