血液透析患者抗高血压药物临床应用进展
李 萍,李明春,王春燕
(中国人民解放军海军第九七一医院药剂科,山东 青岛 266071)
高血压是维持性血液透析患者的常见并发症,70%~90%的终末期肾病血液透析患者患有高血压[1]。长期高血压是血液透析患者发生心脑血管事件及死亡的最重要危险因素[2],故降血压在血液透析整体治疗中占有重要地位。血压常用药物来控制[3],但由于血液透析患者病理、生理的特殊性,降压药物的选择及注意事项或与普通患者不一致。为此,以“血液透析”“高血压”“降压药物”“hemodialysis”“hypertension”“antihyperten‑sive drugs”为关键词,在中国期刊全文数据库、万方数据库、PubMed 等数据库中组合检索2011 年1 月至2021 年12 月发表的相关文献,对血液透析患者抗高血压药物的临床应用进行归纳总结,以期为临床用药提供参考。
1 血液透析患者用药特殊性
抗高血压药物β受体阻滞剂、血管紧张素转换酶抑制剂(ACEI),血管紧张素Ⅱ受体阻滞剂(ARB),钙通道阻滞剂(CCB)和盐皮质激素受体拮抗剂(MRA)等在临床常用于血液透析患者高血压的治疗,能降低患者心血管发病率和死亡率[4]。用药还需考虑每种药物的特定药理特性,如利尿剂对终末期肾病患者的血压控制是无效的[5]。有研究显示,对无尿血液透析患者使用袢利尿剂,即使在高剂量下,血流动力学指数的变化也很小[6]。考虑到高风险的耳毒性,血液透析患者应避免使用袢利尿剂。另有研究表明,袢利尿剂可能有助于提高血液透析患者残余尿量和限制液体超载[7]。然而,袢利尿剂对尿量和血压控制的影响尚未在大型研究中得到证实。
2 常见药物
2.1 β 受体阻滞剂
血液透析患者对严重心律失常和猝死的易感性,以及其交感神经系统的过度激活,使β受体阻滞剂备受关注[8]。HDPAL 试验中对β 受体阻滞剂阿替洛尔和ACEI 类药物赖诺普利进行了头对头比较(两药皆为血液透析后立即给药,每周3 次)。结果显示,在12 个月的随访中,左心室质量指数(主要结果)有相似程度的改善,但阿替洛尔在降血压方面优于赖诺普利,虽然两组血压水平无显著差异,但经后者治疗后患者的血压水平一直较高,并需在透析期间进行更积极的容量管理,使用更多的降压药物作为附加疗法,以达到降压目的;同时,该试验由于阿替洛尔在预防严重心血管事件方面显著优于赖诺普利而提前终止[9]。
一项最新Meta 分析结果显示,虽然与安慰剂比较,各类降压药物均能降低血液透析患者的收缩压,但β受体阻滞剂和MRA 在降低收缩压方面强于ACEI,ARB 和CCB,这说明交感神经系统的过度激活可能是血液透析患者血压升高的重要机制。安全性方面,MRA,ACEI 和ARB 因导致高血钾和低血压等不良事件而存在停药风险,故该分析结论为β 受体阻滞剂优于其他降压药物[10]。
总体来说,β 受体阻滞剂在血液透析患者降压方面优势明显,故《欧洲血液透析病人高血压诊疗管理共识及治疗》[6]推荐β受体阻滞剂为血液透析患者降压治疗的首选药物。此外须注意β 受体阻滞剂的透析清除率(见表1,表中a 表示首选剂量为透析后每周3 次,每次25~100 mg,以最大限度发挥降压作用和给药方便;b 表示首选剂量为透析后每周3 次,每次10~40 mg,推荐血液透析患者的最大剂量为每日40 mg),可被高度清除的β 受体阻滞剂由于不能抑制透析过程出现的心律失常而失去优势[11]。
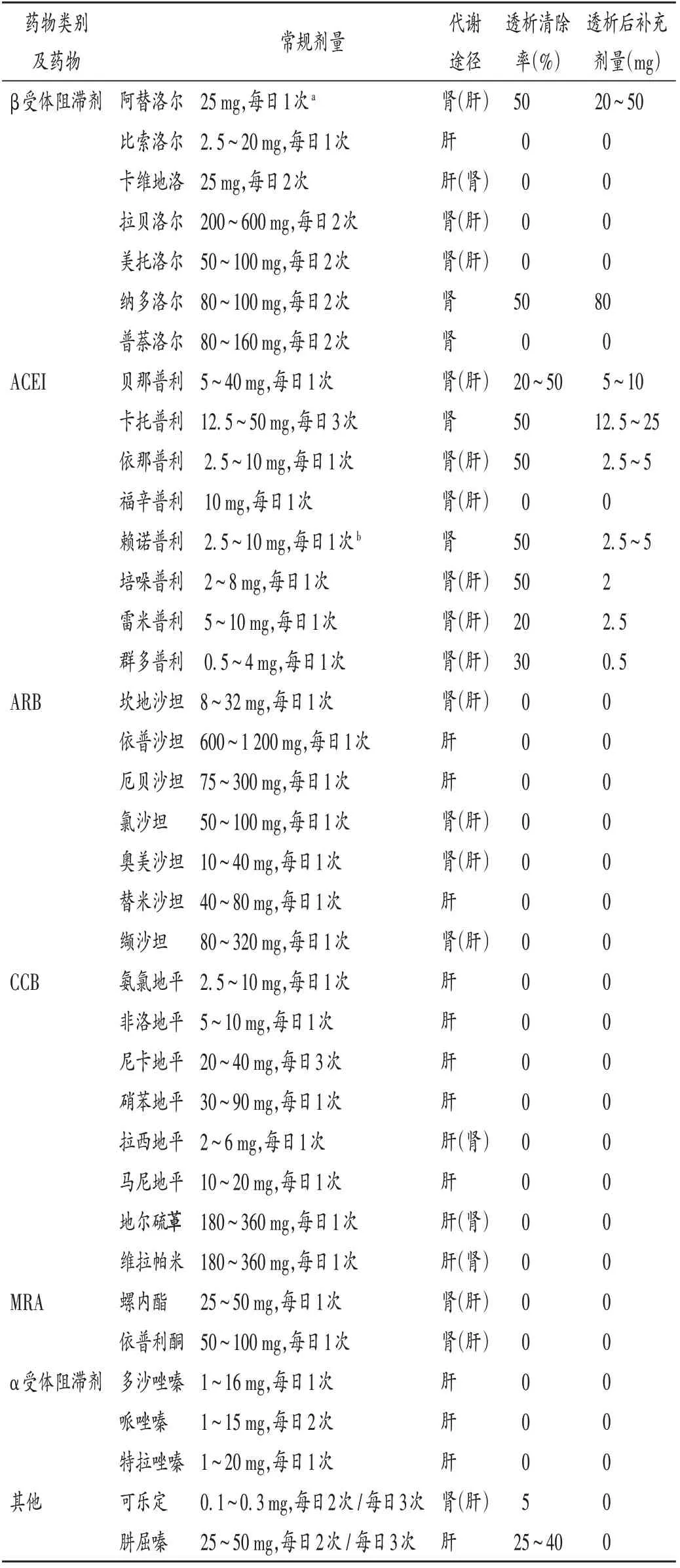
表1 抗高血压药物在血液透析患者中的代谢途径及清除率Tab.1 Metabolic pathway and clearance rate of antihypertensive drugs in hemodialysis patients
2.2 CCB
CCB 根据化学结构和药理作用可分为二氢吡啶类与非二氢吡啶类。二氢吡啶类CCB 属经典降压药物,国内外高血压防治指南均强烈推荐,在血液透析患者中其降压效果和心脏保护作用也得到相关试验的支持。
一项多中心前瞻性队列研究结果显示,在血液透析开始时使用二氢吡啶类CCB 可显著降低全因死亡率和心血管相关死亡率[HR= 0.62 / 0.57,95%CI(0.46,0.85)/(0.35,0.91)[12]。有研究表明,二氢吡啶类CCB 降低左心室肥厚和颈动脉内膜-中膜厚度的能力与ACEI 和ARB 相当,且还具备恢复内皮功能的作用[13]。且其不能通过血液透析去除(见表1);同时钠和容量过度负荷被认为是透析患者高血压最主要的致病机制,而上述药物在高容量状态下也能有效降压[14]。以上优点使《欧洲血液透析病人高血压诊疗管理共识及治疗》[6]将其推荐为除β受体阻滞剂外的第二选择。
2.3 ACEI 和ARB
肾素-血管紧张素系统(RAS)抑制剂是各国高血压防治指南推荐的优选降压药物之一。RAS 抑制剂虽能使普通患者群产生心血管获益[15],但相关随机试验并不支持其亦是血液透析患者的一线降压药物。
在一项FOSIDIAL 试验中,397 例血液透析患者随机分为福辛普利组和安慰剂组,平均随访48个月,结果显示,虽然福辛普利组患者血压显著降低,但在随访期间致命和非致命性心血管事件的发生率与安慰剂组无显著差异[RR=0.93,95%CI(0.68,1.26)][16]。
另一项研究将469 例日本冲绳血液透析高血压患者随机以奥美沙坦(10~40 mg/d)治疗或对照治疗,在3.5 年的平均随访时间中,奥美沙坦组和对照组的全因死亡率、非致命性中风和冠状动脉血管重建发生率均无显著差异,这表明心血管事件发生风险的降低是由于降压治疗本身而非RAS抑制剂[17]。
SURAPON 等[18]的Meta 分析结果显示,使用ARB的血液透析患者心血管事件风险无显著降低。RAS 抑制剂效果不明显,可能因为肾素由肾脏产生,而血液透析患者的肾素水平较低[10]。到目前为止,在血液透析患者中,ACEI 和ARB 优于其他抗高血压药物尚未得到证明。
2.4 MRA
MRA 对伴有左室射血分数降低的心衰患者有明确的心脏保护益处,对血液透析患者具有心脏保护作用。
MATSUMOTO 等[19]的研究将309 例血液透析患者随机分为螺内酯(25 mg/d)组和安慰剂组治疗3 年,结果显示螺内酯可降低心血管死亡率或心血管相关住院风险[HR=0.38,95%CI(0.17,0.83)]。
LIN等[20]的研究中,也显示增加螺内酯疗法再次减少了心脑血管死亡率的复合主要终点,降低了心脏骤停和猝死风险[HR= 0.42,95%CI(0.26,0.78)],在上述试验中,临床不良结果的风险降低超过50%。
然而,HAMMER 等[21]的一项随机双盲对照试验结果显示,螺内酯组在心脑血管结局改善方面与对照组无显著差异,而高血钾发生概率显著升高。另有一项试验也表明,MRA 更易发生血钾升高,且呈剂量依赖性[22]。
总之,MRA 的获益可能会被威胁生命的高血钾风险的增加所抵消,因此MRA 对血液透析患者的利弊需进一步研究。
2.5 其他降压药物
血液透析患者的高血压程度常比普通患者更严重[23],需联合使用几种类型的抗高血压药物[24]。肼屈嗪和米诺地尔均为直接血管扩张剂,可降低血液透析患者血压。然而,目前尚未有确凿证据表明它们能改善血液透析患者的临床结局。α 受体阻滞剂也可用于控制血压,但对于血液透析患者来说相关信息较缺乏,而且存在体位性低血压等严重药品不良反应。因此不推荐用于血液透析患者[12]。
3 合理用药与监护
高血压作为血液透析患者最常见的并发症,与该类患者的预后和病死率密切相关[25]。其发生机制亦很复杂,血液透析患者即使保留残余肾功能,钠和液体排泄能力也会受到实质性损害,因此钠和容量过度负荷被认为是最主要的致病机制。此外,由于钙-磷紊乱等综合作用[26],加速了血液透析患者动脉硬化,也是重要致病机制。其他一些因素,如激活肾素-血管紧张素-醛固酮和交感神经系统、内皮功能障碍、炎症、睡眠呼吸暂停和使用促红细胞生成素等特殊药物[2,27]也在其中起重要作用。研究表明,若患者长时间处于高血压状态,可诱发冠状动脉疾病、左心室肥厚及充血性心衰等相关心血管疾病,而心血管疾病是导致血液透析患者死亡的常见原因[28]。故合理选择并正确使用降压药至关重要。
临床常用的降压药物β 受体阻滞剂在普通患者群中的降压效果不及CCB,ACEI和ARB,但在血液透析患者中却是首选降压药物,可能是由于交感神经系统的过度激活及钙- 磷紊乱等因素,血液透析患者常合并心律失常,因此既能降低交感神经系统活性又能改善心律失常的β受体阻滞剂优势明显,但在临床使用中要注意监护是否出现房室传导阻滞及心率减慢等药品不良反应。
二氢吡啶类CCB 由于降血压效果显著,无绝对禁忌证等优点使其在降压药物中处于优势地位,在血液透析患者中使用效果满意,故推荐强度仅次于β受体阻滞剂,另外,二氢吡啶类CCB 还有一个重要优势是不能通过透析去除。
ACEI 和ARB 因能抑制RAS 及降低心血管事件发生率,国内外指南将其推荐为一线降压药物,然而研究显示在透析人群中,该益处却未显现,原因可能是由肾脏分泌的肾素在透析患者中水平较低,因此RAS 抑制剂不能发挥与非透析高血压患者相同的益处[26]。但由于血液透析患者的高血压情况较严重,单药常常不能控制[29],RAS抑制剂仍是联合用药的选择之一[30],此外使用时应注意监护患者的血钾水平及是否出现咳嗽等药品不良反应。
其他降压药物如MRA、α 受体阻滞剂等,由于改善临床结局证据不足等原因一般不用于血液透析患者的降压治疗,除非上述3种降压药均不能使用时方可考虑使用。
综上所述,血液透析患者抗高血压药物应首选β受体阻滞剂,其次是二氢吡啶类CCB。ACEI 和ARB 虽能降低血压,但随机试验并不强烈支持其用于血液透析患者。在临床应用中应结合血液透析患者的病理特点和降压药物的代谢特点合理选择抗高血压药物,并注意针对性加强用药监护,从而进一步有效控制血压,减少心血管并发症的发生。

