不同温度下外加磁场对磁性纳米微粒分散性的影响
逯阵毫,杨阳,李冰,王玉堂
(郑州安图生物工程股份有限公司,河南 郑州 450000)
纳米技术是目前最重要的现代科学研究之一[1],纳米粒子以其独特的尺寸和理化性质优势,使其在生物医学、材料科学、环境工程等多个领域广泛应用[2],各种纳米粒子的合成和应用收到广泛关注。磁性纳米颗粒是纳米材料的一种,随着纳米生物技术的最新发展和需求,磁性纳米颗粒在生物医学领域的应用潜力日益增大。磁性纳米粒子通常分为纯金属、金属氧化物和磁性纳米复合材料,生物医学领域常用的磁性纳米粒子有钴(Co)、铁(Fe)、镍(Ni)、钛(Ti)及其氧化物,其中氧化铁磁性纳米粒子(通常为Fe2O3或Fe3O4)因毒性较低而使用最多[3],这些磁性纳米微粒可以被磁场检测和操纵,从而实现磁成像、磁分离、药物和基因传递等功能。
在体外诊断领域,磁性纳米微粒作为固相载体可以实现待测物质的快速分离,其分散性对其性能有直接的影响。例如,在储存过程中如果发生凝集,磁微粒重新悬浮时无法重新分散均匀,测试结果就会表现出重复性较差,甚至出现跳孔、漏检等异常现象;导致磁微粒凝集的因素很多,表面Zeta 电位的改变,偶联蛋白的性质,保存条件发生改变等等。在磁微粒试剂盒的开发中,磁微粒的分散性是试剂盒性能的一项重要指标[4],试剂盒保存过程中,因为重力的作用磁微粒沉降在容器底部,随时间的延长,磁微粒发生凝集的概率明显增加,因此磁微粒的分散性加速考核就显得极其重要。目前,研究磁微粒分散性加速考核多采取磁加速手段,具体操作为在磁微粒容器底部外加一定强度的磁场,根据阿伦尼乌斯经验方程,采取增加温度的方式加速考核[5]。
本文重点研究不同温度下的外加磁场对磁微粒分散性的影响,同时对磁微粒的粒径、磁响应、Zeta 电位进行表征,试图找到保存温度与磁微粒分散性之间的关系,为磁微粒长期的保存提供借鉴意义。
1 材料与方法
1.1 材料
表面羧基磁性纳米微粒购自德国Merk 公司;系列小鼠单克隆抗体mAb1-mAb5 购自郑州伊美诺生物技术有限公司;牛血清白蛋白(BSA)购自Sigma 公司;磷酸氢二钠、磷酸二氢钠(纯度分析纯)购自Sigma 公司;2-(N-吗啉)乙磺酸(MES)购自Sigma 公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)购自Sigma 公司;N-羟基琥珀酰亚(NHS)购自Sigma 公司。
1.2 设备
磁吸加速装置,自制;垂直混匀器(宁波新芝生物科技有限公司,型号:HS-3);光学显微镜(日本奥林巴斯,型号:BX-43),显微数字相机(广州市明美光电技术有限公司,型号:MSX11);激光粒度仪(马尔文帕纳科,型号:MX3000);Zeta 电位仪(马尔文帕纳科,型号:ZEN3600)。隔水式电热恒温培养箱(上海跃进医疗器械有限公司,型号:HH-B11·360-BS-II);星星陈列柜(星星制冷设备有限公司,型号:LSC-518Y);Sepmag A200 磁分离器。
1.3 磁微粒-蛋白偶联
偶联过程采用EDC+NHS 活化磁微粒表面的羧基基团,具体步骤如下:抽取30 μL 磁微粒原液,用磷酸盐缓冲液(pH 7.0)洗涤2 次,加入20 mg/mL EDC MES 缓冲液和20 mg/mL NHS MES缓冲液各50 μL,震荡反应1 h,去上清后加入300 μL MES 缓冲液洗涤2 次,加入10 μL IgG 溶液,震荡反应2 h,去上清后加入300 μL 1%BSA磷酸盐缓冲液封闭30 min,最后用1%BSA 磷酸盐缓冲液定容至3 mL,2~8 ℃保存备用。同时制备没有包被任何蛋白的磁微粒作为对照,共制备6 种不同包被蛋白的磁微粒混悬液,用于磁加速考核。
1.4 磁吸加速
将所有磁微粒混悬液分成三组,放入磁吸加速装置上,分别放置于4℃、25℃、37℃,放置天数3 d、7 d、10 d,磁吸加速完成后,将每瓶磁微粒混悬液置于垂直混匀器上混匀30 min,目测磁微粒分散状态,进行磁微粒表征。
1.5 磁性纳米微粒表征
1.5.1 分散性 抽取5 μL 磁微粒混悬液制片,置于光学显微镜下观测,拍照比较分散性,以磁微粒原液为对照。
1.5.2 粒径 抽取2 mL 磁微粒混悬液作为样本,利用激光粒度仪测定粒径,每个样本重复三次,求平均粒径。
1.5.3 磁响应 抽取2 mL 磁微粒混悬液加入玻璃管中,放入Sepmag A200 测定磁响应时间。
1.5.4 Zeta 电位 抽取1 mL 磁微粒混悬液,用1 mL 洗涤3 次,最后定容到原来体积1 mL,利用Zeta 电位仪测定Zeta 电位。
2 结果
2.1 分散性
由图1 可见,不同包被抗体的磁微粒混悬液在不同温度条件下磁吸加速,重悬后磁微粒的分散性有明显差异,37℃下磁吸加速,磁珠分散性最差,25℃次之,4℃分散性最好,同一批磁微粒原液,与是否包被抗体、抗体的种类无显著关系。包被其他单抗的磁微粒显示出相同的趋势。
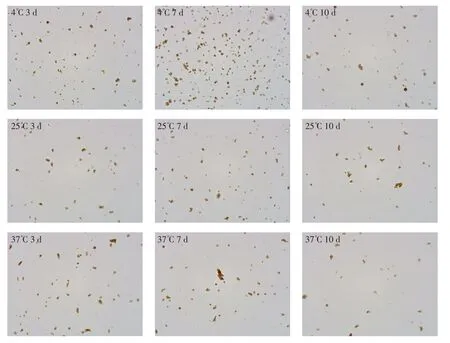
图1 包被不同蛋白的磁微粒混悬液磁吸加速后分散性(以mAb1 为例)
由图2 可见,包被同样蛋白不同批次原液在不同温度条件下磁吸加速,重悬后磁微粒的分散性有明显差异,37℃下磁吸加速,磁珠分散性最差,25℃次之,4℃分散性最好,同一批磁微粒原液,与是否包被抗体、抗体的种类无显著关系。其他批次磁微粒表现出相同的趋势。
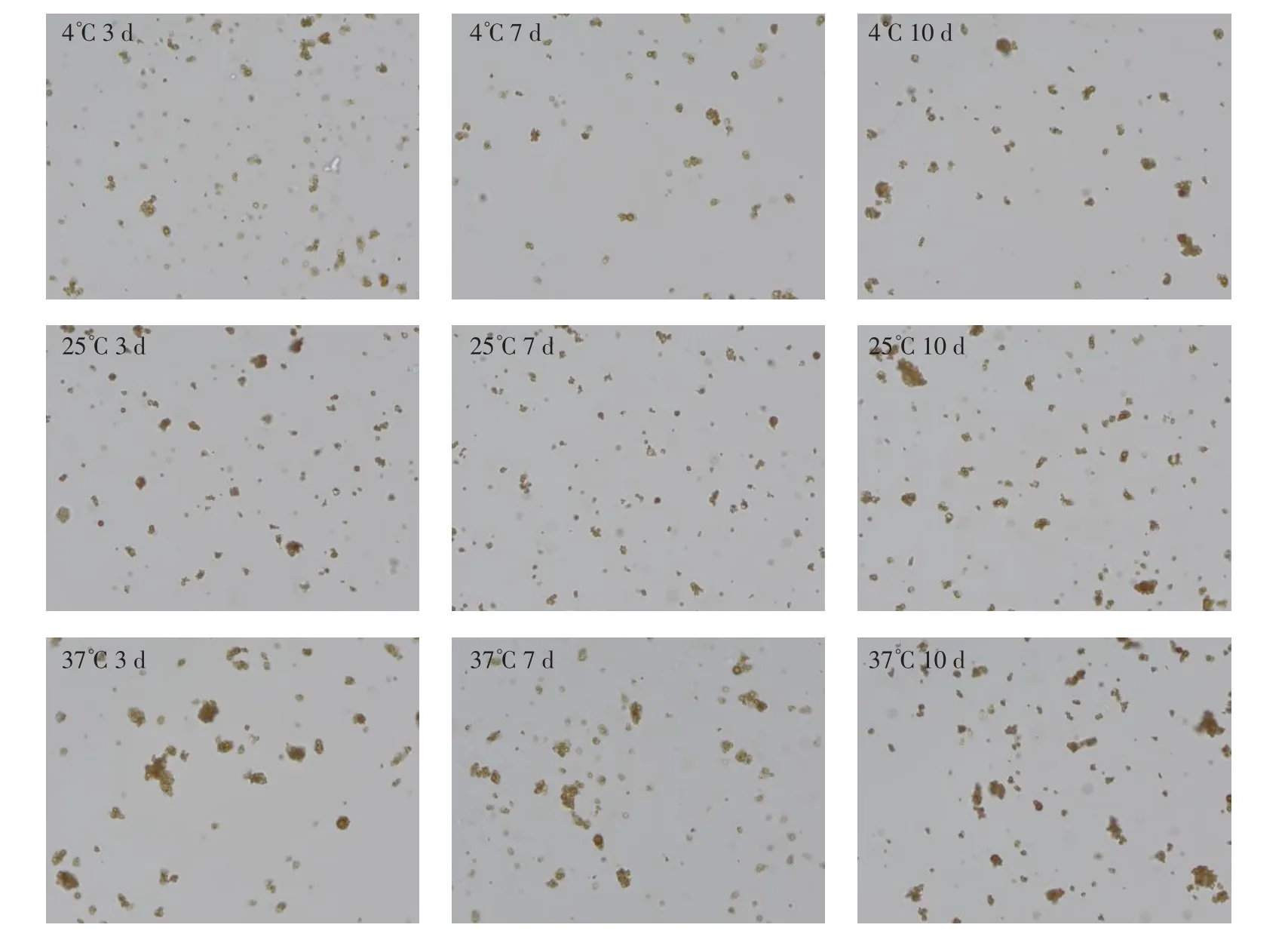
图2 不同批次磁微粒混悬液磁吸加速后分散性(以M8932 为例)
2.2 粒径
数据表明,磁微粒包被抗体后,磁加速同样的时间,温度越高,磁微粒粒径越大,表明磁微粒分散性越差,与光学显微镜观察到的结果一致。包被不同的单抗粒径变化趋势一致,未包被任何单抗的裸磁珠也表现出同样的趋势,说明磁微粒磁加速后分散程度与包被抗体的性质无明显关系。见表1。

表1 包被不同单抗的磁微粒在不同温度下磁加速3 d、7 d、10 d 后的粒径变化(以mAb1 为例)
数据表明,不同批次磁微粒包被抗体后,磁加速同样的时间,温度越高,磁微粒粒径越大,表明磁微粒分散性越差,与光学显微镜观察到的结果一致,不同批次的磁微粒粒径变化趋势一致,说明磁加速后的分散程度与磁微粒批次无明显关系。见表2。

表2 不同批次磁微粒在不同温度下磁加速3 d、7 d、10 d后的粒径变化(以M8932 为例)
以上数据均表明,磁加速分散程度与包被抗体、磁微粒批次无明显关系,与外加磁场时的温度有明显关系,温度越高,磁加速后的分散性越差。
2.3 磁响应
数据表明,磁微粒包被抗体后,磁加速同样的时间,温度越高,磁响应越小,粒径数据表明,温度越高粒径有增大趋势,经验表明,粒径增大磁响应会变小。包被不同的单抗磁响应变化趋势一致,说明磁微粒磁加速后磁响应变化与包被抗体的性质无明显关系。见表3。
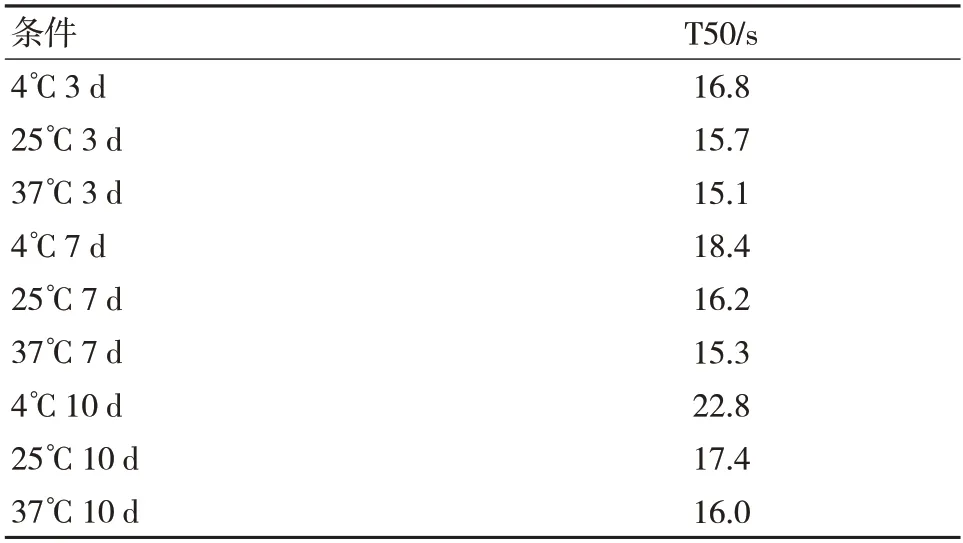
表3 包被不同单抗的磁微粒在不同温度下磁加速3 d、7 d、10 d 后的磁响应变化(以mAb1 为例)
数据表明,不同批次磁微粒包被抗体后,磁加速同样的时间,温度越高,磁响应越小,粒径数据表明,温度越高粒径有增大趋势。不同批次磁微粒磁响应变化趋势一致,说明磁微粒磁加速后磁响应变化与磁微粒的性质无明显关系。见表4。
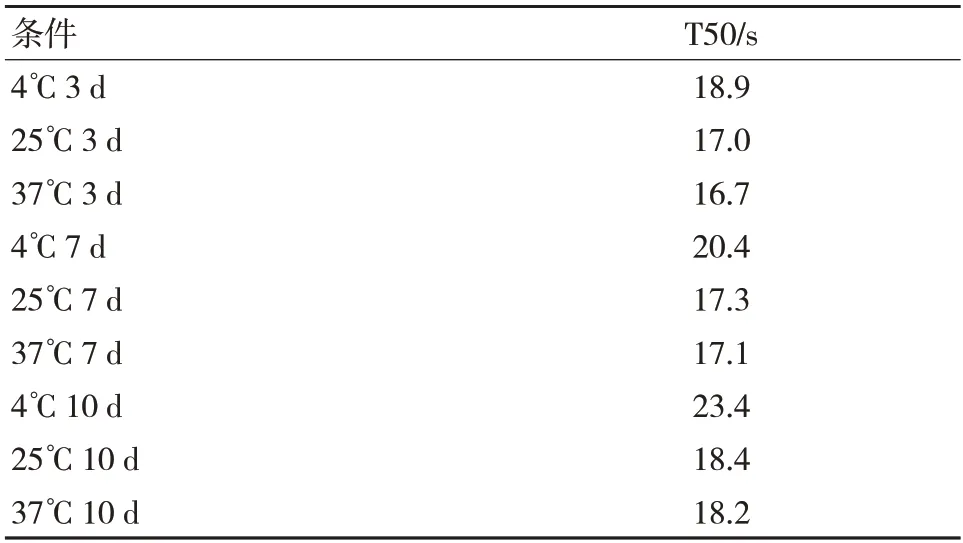
表4 不同批次磁微粒在不同温度下磁加速3 d、7 d、10 d后的磁响应变化(以M8932 为例)
2.4 Zeta 电位
数据表明,磁微粒包被不同的抗体,磁加速同样的时间,Zeta 电位变化并不明显。包被不同单抗的磁微粒Zeta 电位变化同样不明显。不同批次的磁微粒Zeta 电位同样无明显变化,说明磁微粒磁加速后Zeta 电位无明显变化,与包被的抗体和磁微粒本身的性质无明显关系。见表5、表6。

表5 包被不同单抗的磁微粒在不同温度下磁加速3 d、7 d、10 d 后的Zeta 电位变化(以mAb1 为例)

表6 不同批次磁微粒在不同温度下磁加速3 d、7 d、10 d后的Zeta 电位变化(以M8932 为例)
3 讨论
磁微粒长期保存过程中会受重力的影响而在底部沉积,不同的保存温度对磁微粒的分散性有显著影响。从实验中可以得到,在37℃保存时,对磁微粒的分散性有负面影响,在4℃保存时影响小于25℃和37℃,粒径数据证实37℃时的粒径大于25℃和4℃,证实37℃时磁微粒凝集程度大于25℃和4℃;磁响应方面,37℃时由于磁微粒凝集程度最大,磁响应也是最快的,但是Zeta 电位却没有明显变化趋势。
同时,不同批次磁微粒,包被不同蛋白的磁微粒,都有同样的趋势,分散性与外界温度有明显关系。这种变化的发生,可能与温度改变了蛋白表面的水化层有直接关系[6]。蛋白质溶液中温度稍高时,蛋白质间分子间作用力增加,加速蛋白质的凝集[7],同时,蛋白质构象发生轻微改变,导致水化层的厚度减小,不利于蛋白质胶体的稳定性[8]。
综上所述,本研究可为磁微粒试剂盒保存环境的选择以及磁微粒凝集方面提供一定参考。

