新型冠状病毒核酸PCR检测假阳性核酸污染类型的鉴别方法
王 爽 潘 阳 徐新民 栗雅杰 周 淳 张 悦 王雅杰*
(1.首都医科大学附属北京地坛医院检验科,北京 100015; 2. 北京市疾病预防控制中心传染病地方病控制所,北京 100013)
随着新型冠状病毒肺炎(COVID-19)疫情的爆发和流行,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)核酸检测已经成为各临床实验室不可缺少的检测项目。大规模爆发和聚集性疫情的产生使得实验室的检测压力出现前所未有的增加[1-2]。面对检测任务的增加,实验室正常运行是最重要的保障,其中避免实验室污染以及实验室一旦发生核酸污染后的消除也是实验室负责人必须重视的一项内容。
假阳性主要来源于实验室环境污染、标本污染、非特异性扩增等[2-3]。个别假阳性情况能通过复查核酸或重新提取后纠正过来。如出现一些特殊情况,如一个96孔板中有很多阳性,或重复测试仍为阳性,但这种检测结果和流行病学或临床不符,就必须考虑是实验室本身的问题。筛查为主的核酸检测机构出现检测假阳性主要是阳性质控品造成的,包括含待测基因的质粒或假病毒。对于收治确诊患者的定点医疗机构或接触入境阳性人员的实验室,如实验操作不当等原因,阳性样本发生溢撒或产生大量气溶胶,可使周围环境被病毒污染[4-6]。实验室一旦发生核酸污染,检测工作必须紧急停止,直到确定消除污染后才能重新开始检测。发生核酸污染后需要第一时间查找污染源和污染原因,明确原因后才能采取有效的去污染措施。本文的目的是建立实验室内部的污染鉴别方法,当实验室出现污染后,能及时鉴定出污染类型,从而缩小并明确造成污染的原因,使得检测工作尽快恢复。
1 材料与方法
1.1 样本
A组DNA质粒型阳性质控品:含N基因、ORF1ab基因片段;B组RNA假病毒阳性质控品:含N基因、ORF1ab基因片段的假病毒和RNP基因的假病毒混合物;实验当日5例确诊患者弱阳性核酸样本,编号为S101、S102、S103、S104和S110。本研究获得首都医科大学附属北京地坛医院伦理委员会批准(伦理编号:2020-060)。所有研究对象均签署了知情同意书。
1.2 仪器与试剂
天隆Gentier 96E型实时荧光定量PCR仪购自西安天隆科技有限公司;核酸提取试剂(QIAamp Viral RNA Mini Kit,批号:166020025)购自德国QIAGEN公司;达安新型冠状病毒2019-nCoV核酸检测试剂盒(批号:2021056)购自中山大学达安基因股份有限公司;DNase为TURBO DNA-freeTM试剂盒(Invitrogen,批号:01049921)购自美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样本的处理
由污染引起的扩增都在较高循环阈值cycle threshold (Ct)水平,使用无RNA酶水将A组DNA质粒型阳性质控品进行4个稀释度(5、25、125和625倍)的稀释。B组假病毒已知浓度为1×104拷贝/mL,无须稀释。选取的5例确诊患者核酸样本ORF1ab基因和N基因PCR检测的原始Ct值在33~40之间,无须稀释。
1.3.2 DNase的使用
吸取15 μL样本到0.5 mL EP管中,加入2 μL 10×TURBO DNase 缓冲液和1 μL TURBO DNase。对照组为15 μL样本加入2 μL 10×TURBO DNase 缓冲液和1 μL H2O,金属浴37 ℃反应30 min。在反应后的各管中加入2 μL DNase 灭活剂,室温放置5 min,离心2 min,吸取上清作为下一步模板。
1.3.3 PCR反应程序
根据达安新型冠状病毒2019-nCoV核酸检测试剂盒说明书中的程序进行PCR反应,反应程序详见表1,在进行RNA组分鉴别时,去掉步骤1的反转录过程,只保留步骤2和步骤3进行扩增。检测通道为:VIC通道(ORF1ab基因)、FAM通道(N基因)和CY5通道(内标RNP基因)。由于不同厂家的检测试剂差异,对于A组和B组阳性质控品,达安新型冠状病毒2019-nCoV核酸检测试剂盒只能扩增出N基因,不能扩增出ORF1ab基因。

表1 PCR反应程序Tab.1 PCR setup
1.4 统计学方法

2 结果
2.1 DNase对不同模板浓度(稀释度)的抑制情况比较
使用DNase进行DNA类型污染的鉴别,由于实际工作中DNase的使用是按照说明书进行的,对于模板的浓度含量是否产生不同的结果需要实验来验证。将A组DNA质粒型阳性质控品的4种稀释水平使用DNase处理前后的N基因扩增检测情况,结果如图1所示,A图显示对照组在4种稀释水平均可以正常扩增出N基因的扩增曲线,B图显示的DNA型阳性质控品在经DNase处理后均无法扩增出目标片段,表明DNase对各稀释度的DNA模板都可以清除降解。

图1 比较DNase处理与否对DNA质粒型阳性质控品的扩增情况影响Fig.1 Comparison of the amplification of DNA plasmid positive quality control samples with or without DNase treatment
A:theNgene amplification curves of four positive quality control samples with different dilutions;B:no amplification curve in four DNase treatment groups;RFU: relative fluorescence units.
2.2 DNase不同处理时间的扩增结果比较
为探讨DNase处理时间对扩增结果的影响,使用DNase处理2.1中4种稀释度的DNA质粒质控品,反应时间分别设定为15、30和60 min。将酶消化后的DNA质控品作为扩增模板进行靶基因(N基因)的扩增,Ct值结果如表2所示,将4个稀释度下对照组3个时间点的N基因Ct值进行比较,数据显示3组之间的差异无统计学意义(P>0.05)。4个稀释度下DNase处理15、30和60 min后检测N基因均无曲线扩增,说明DNase处理时间在15 min以上均可起到清除DNA模板的作用。
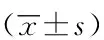
表2 A组DNA质粒型阳性质控品在对照和DNase不同作用时间下N基因检测Ct值比较Tab.2 Comparison of Ct value of N gene of DNA plasmid positive quality control samples at 3 different DNase treatment time
2.3 DNase对RNA成分扩增的影响
为探索DNase对RNA扩增的影响,使用DNase处理RNA型假病毒的阳性质控品。从图2中可以看出,RNA型假病毒的阳性质控品经DNase处理前(图2A)、后(图2B),ORF1ab和N基因的扩增曲线并没有发生变化。而从阳性患者标本的扩增曲线看(图2C、D),经DNase处理后的曲线会发生后移,Ct值相应增大(图3,表3)。值得注意的是,当检测 Ct 值过高的核酸样本时,DNase处理后会使核酸浓度有所降低,可能会导致高Ct值(灰区附近)的检测结果呈现阴性(表3)。

图2 DNase处理不影响RNA组分的扩增。Fig.2 The amplification of RNA components was not affected with DNase treatment
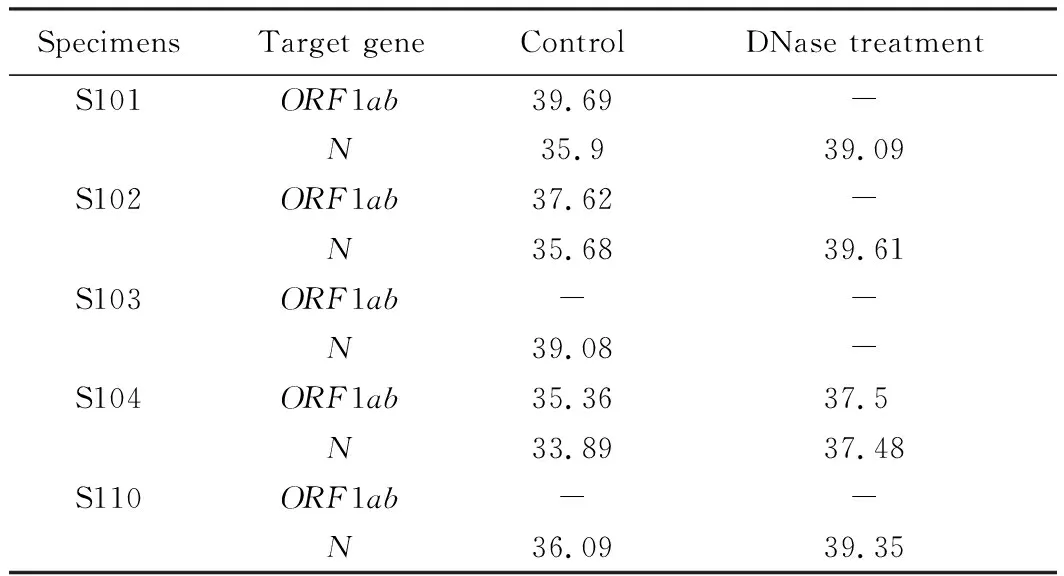
表3 5例患者核酸经DNase处理后ORF1ab和N基因的Ct值检测结果变化Tab.3 Comparison of Ct values of ORF1ab and N genes after DNase treatment in 5 confirmed patients
2.4 RNA类污染的鉴别
A组DNA质粒型阳性质控品、B组RNA类型假病毒,按试剂盒说明书设置反应条件,将步骤1反转录(50 ℃,15 min)去除后,开始扩增检测。从图3A、B两图可以看出,完整反应条件下可以扩增出RNA类型假病毒的N基因和RNP内标基因,去除这一步骤则不能扩增出目的片段;质粒型阳性质控品为DNA成分,去掉反转录后(图3D)仍然能和完整反应条件下一样(图3C)正常扩增,且Ct值接近原始核酸检测Ct值,提示DNA成分没有反转录过程也可以正常扩增。
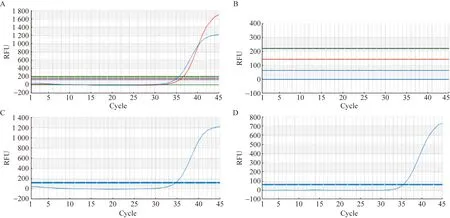
图3 去除反转录步骤的扩增可以对比验证RNA类型的污染情况Fig.3 The amplification without reverse transcription in RT-PCR could be used to identify and verify the contamination of RNA type
2.5 核酸污染类型鉴别
由于实时荧光RT-PCR方法通常无法区分所检测核酸片段的类型,通过结合去除反转录步骤以及使用DNase两种处理方式比较前后结果的变化来鉴别核酸污染类型。①去除反转录步骤结果无变化,DNase处理后结果阴性,可鉴定为DNA类型污染;②去除反转录步骤结果阴性,DNase处理后无变化,可鉴定为RNA类型污染;③去除反转录步骤结果阴性,DNase处理后Ct值增高或结果为阴性,可鉴定为RNA类型污染(模板被DNase稀释所致);④单独通过去除反转录步骤、DNase处理步骤后结果为阳性,说明存在DNA和RNA两种类型共同污染(表4)。

表4 核酸污染类型鉴定策略总结Tab.4 Summary of identification strategy
3 讨论
核酸检测具有灵敏度高、特异性好的特点,但对于核酸检测结果的准确性,需要从多方面因素来保证。由于核酸检测阳性结果被视为SARS-CoV-2感染诊断的金标准[2,7-8],阳性结果的报告直接决定相关疫情的后续处理,因样本在实验室受污染而导致“阳性”的情况在很多实验室都出现过,而假阳性情况则会造成人员恐慌以及流行病学调查和防控措施过度等问题[9-10]。除了考虑实验室生物安全、风险评估等措施[11-12],根据SARS-CoV-2核酸检测的基本原理和条件,从检测样本采集、运输、保存的方式,试剂盒的质量,以及临床实验室的管理等多方面,鉴定出污染类型的工作也是应对实验室检测“假阳性”的重要工作之一。
这里笔者分别结合DNA型阳性质控品、RNA型阳性质控品和阳性患者核酸标本使用实验室内的试剂来进行污染类型的鉴别并总结。使用商品化DNase处理鉴定DNA类型的污染已经在实验中得到了证实。对于Ct值高至29(1∶5稀释)的阳性质控品,将反应时间减少至15 min都可以通过DNase清除抑制,从而鉴定出DNA污染类型[13-14]。本结果也显示,鉴定低载量(较高Ct值)样本核酸时,DNA酶处理后可能会使RNA浓度进一步降低,导致检测结果为阴性。实际上,很多污染现象都是以小翘尾的形式出现的,应使用另外一到两种扩增不同区域的高灵敏检测试剂进行验证。RNA类的污染可见于灭活疫苗的污染,含有靶基因的假病毒污染,阳性样本的污染等。一些操作失误如加样器深入阳性样本采样管时沾染,表面活性剂在管口产生气泡或液体滴撒操作台面等均可能导致核酸污染。同时,有证据[6]显示SARS-CoV-2的气溶胶传播,在这些患者产生的气溶胶浓度达到105拷贝/mL。对于RNA类型的鉴别,最直接有效的方法即将完整的实时荧光定量PCR步骤去除反转录过程,使得RNA成分无法反转录,进而中断目标基因的扩增。这一方法的优势是简单快速,不需要额外的试剂,唯一的不足是痕量DNA的污染也会影响最后的污染类型推断。
各个实验室都有应对污染的有力措施。首先是实验室的设施保障,比较理想的结构是在独立的PCR实验室进行核酸提取和加样,然后将加完样的反应体系转运至扩增室进行扩增。这样既可以避免扩增产物对样本制备过程的污染,也可以避免样本制备区泄漏的生物安全风险。对于常出现的扩增区产物污染,很多好习惯是简单易行的,如对完成的PCR反应管盖严后迅速放入密闭的医疗垃圾桶并及时处理;加强扩增区的消毒(消毒剂擦地、紫外灯照射)和通风。无论是怎样的实验室设置,尽可能实施空气通风来消除SARS-CoV-2气溶胶是预防污染的最佳手段[6]。引起实验室假阳性的原因多种多样,涉及实验活动的方方面面,寻找准确原因不是件容易的事。但是,可以通过先鉴别出污染的类型来缩小怀疑的范围,以便逐一排查,最后准确定位。另一方面,准确地了解污染情况对开展预防工作也是十分重要的提示,很有可能鉴定出的污染情况是以前没有关注过的实验习惯和手法,对生物安全意识和更正操作步骤都很有意义。后期笔者会将这一方法应用到实际工作中,如出现实验室环境、确诊患者病区及与流行病学不符的人员标本等检测出现结果阳性的情况,通过本方法来鉴别出所测标本阳性的类型,并确定与实际结果不符的原因,为方舱实验室新型冠状病毒核酸检测积累更多经验。

