p21调控胃癌POLD1基因的初步机制探究
阮细玲,黄幼生,翁 阳,杨 丞,陈孟柚,胡嘉影,徐 恒
胃癌发病率位居全球恶性肿瘤的第5位,位居国内恶性肿瘤的第3位[1]。近年来针对胃癌的免疫治疗、新辅助治疗等方法取得一定的疗效,但晚期胃癌患者的病死率仍较高。目前,作用于特定靶点的小分子靶向药物因其药物不良反应较轻、耐药率低、患者服用方便等优点成为晚期胃癌患者的新治疗手段之一[2],小分子靶向药物依据作用机制分为抑制肿瘤血管增生和抑制肿瘤细胞增殖两类[3]。
DNA聚合酶δ(polymerase deta, Polδ)是惟一与细胞周期相关且在DNA复制中起主导作用的DNA复制酶[3-4],其催化亚基p125具有5’-3’聚合酶和3’-5’外切酶两种活性,编码该亚基的基因称为POLD1。Polδ的催化亚基p125催化活性的提高与其表达调控异常有关[5]。
作为细胞周期蛋白激酶抑制因子,p21在细胞周期进程的调控中发挥重要作用。我们推测其可能参与了对POLD1基因的调控,本文将探究其可能的调控模式。通过对p21调控胃癌POLD1基因表达初步机制的分析,以探索基于降低POLD1基因表达并阻断癌细胞恶性增殖的分子靶点。
1 材料与方法
1.1 实验材料胃癌细胞株MGC-803购自中国科学院上海生物细胞研究所;pXJ41-neo载体由新加坡国立大学王跃教授惠赠,pXJ41-p21i是将p21干扰质粒的cDNA构建入pXJ41-neo载体获得的真核表达载体,由北京师范大学桑建利教授惠赠;DMEM培养基购自Hyclone公司;胎牛血清购自杭州四季青公司;高效真核转染试剂Vigofect购自威格拉斯生物公司;RNA提取试剂Trizol购自Invitrogen公司;逆转录试剂盒购自Fermentas公司;荧光定量PCR试剂盒购自天根生化科技公司;兔抗人p21抗体C19、山羊抗人Polδ(p125)抗体C20为Santa Cruz产品;远红外荧光标记的山羊抗兔及兔抗山羊二抗为美国KPL公司产品。
1.2 方法
1.2.1生物信息学分析p21与POLD1蛋白-蛋白互作关系(protein-protein interaction, PPI) String(Search Tool for the Retrieval of Interacting Genes/Proteins)是已知和预测的蛋白质与蛋白质相互作用的在线数据库,本实验通过String探讨p21与POLD1 PPI,构建关键的PPI网络。随后,利用生物信息学软件Cytoscape 2.6对该PPI网络进行了映射,构建了PPI模块。
1.2.2稳定转染p21干扰质粒 MGC-803细胞培养于含100 mL/L胎牛血清的DMEM培养基,转染前1 h给细胞换用无血清DMEM培养基。质粒与转染试剂Vigofect 5 μg ∶3 μL比例制备转染复合物,15 min后均匀滴入培养板细胞,转染后12 h便可在荧光显微镜下观察绿色荧光表达,转染后24 h将细胞传代转种,用含200~400 μg/mL G418的DMEM培养基培养直至筛选出阳性克隆。将实验分为3组:转染p21干扰质粒pGPU6/GFP/neo-p21i的803-p21i细胞;转染阴性对照质粒pGPU6/GFP/neo-shNC的阴性对照组803-NC细胞;未经转染的胃癌MGC-803细胞为空白对照组803细胞。(1)荧光定量PCR实验检测相关细胞周期因子的mRNA相对水平。应用Primer premier 5.0软件设计各基因的引物序列(表1)。Trizol试剂提取细胞总RNA,逆转录得到cDNA,ABI 7500荧光定量PCR仪上进行反应,反应体系:9 μL PCR mix、9 μL去离子水、1 μL引物、1 μL cDNA。以GAPDH作为内参,PCR条件:95 ℃预变性2 min,95 ℃变性20 s、60 ℃退火30 s、72 ℃延伸31 s,合计40个循环,采用比较Ct法,7500 Software v 2.0.5分析数据。(2)Western blot法检测相关细胞周期因子的蛋白表达水平。RIPA裂解液提取细胞总蛋白,测定浓度,加入上样缓冲液煮沸5 min变性后上样电泳。100 mA电流条件下转膜2 h,5%脱脂奶粉封闭2 h,4 ℃摇床孵育一抗(p21、p125一抗稀释比分别为1 ∶500、1 ∶2 000)过夜,PBST洗膜10 min×3次,室温孵育二抗(稀释比1 ∶5 000)1 h,PBST洗膜10 min×3次,PBS洗1次(10 min),最后用LI-COR Odyssey红外荧光扫描成像系统扫描PVDF膜,Odyssey V 3.0软件分析图像及数据。

表1 荧光定量PCR实验设计的引物序列
1.2.3免疫共沉淀实验分析p21与p125的相互作用 (1)免疫细胞化学分析胃癌细胞MGC-803内p125、p21蛋白定位:胰酶消化MGC-803细胞后用盖玻片制作细胞爬片,DMEM完全培养基中培养24 h后取出爬片,4%多聚甲醛固定爬片30 min,然后用中性树胶将爬片的背面粘在载玻片上,正面滴加PBS以防干燥,用0.3%Triton X-100通透10 min,PBS洗涤,以非免疫山羊血清室温下封闭30 min,置3%H2O2水溶液中室温15 min以阻断内源性过氧化物酶,PBS洗涤3 min×3次。(2)免疫共沉淀实验:用IP裂解缓冲液(用前加入蛋白酶抑制剂Cocktail)冰上裂解细胞30 min,12 000 r/min离心30 min后取上清,将蛋白浓度调整为1 μg/μL。将1 μg相应的抗体加入到细胞裂解液中,4 ℃缓慢摇晃孵育过夜。加入预处理的protein A/G-beads 4 ℃缓慢摇晃孵育2~4 h。免疫沉淀反应后,4 ℃、3 000 r/min离心3 min,弃上清,用protein A/G-beads裂解缓冲液洗3次,PBS洗涤3次。加入2×SDS上样缓冲液,沸水浴8 min进行蛋白变性;12 000 r/min离心1 min,将上清转移至新的EP管中。SDS-PAGE电泳后进行Western blot分析。

2 结果
2.1 生物信息学软件分析p21与POLD1基因的关系生物信息学软件Cytoscape、String分析结果显示,p21与POLD1基因通过CDK2、PCNA而相互联系(图1),亦与CDK4、CDK6、Cyclin E1、Cyclin D1、p53等细胞周期调控因子间接相关。
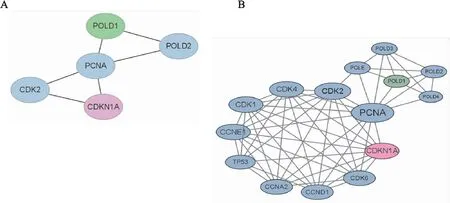
图1 生物信息学软件分析p21与POLD1基因之间的相互关系:A.p21(CDKN1A)与POLD1之间通过CDK2、PCNA相互联系;B.p21(CDKN1A)对POLD1的调控与CDK4、CDK6、Cyclin E1、Cyclin D1、p53等细胞周期调控因子间接相关
2.2 稳定转染p21干扰质粒转染p21干扰质粒及阴性对照质粒12 h后便可在荧光显微镜下观察到绿色荧光蛋白发出的荧光(图2),表明转染成功。
2.2.1相关细胞周期因子的mRNA表达水平 荧光定量PCR实验结果显示,与阴性对照组803-NC细胞、空白对照组803细胞相比,实验组803-p21i细胞的p21 mRNA低表达,而POLD1 mRNA表达上调。其他相关因子中,p53 mRNA表达受到抑制,CDK4、CDK2、PCNA的mRNA表达上调,差异有统计学意义(P<0.05,图3)。

图3 荧光定量PCR检测p21低表达细胞的mRNA水平:实验组803-p21i细胞的POLD1、CDK4、CDK2、PCNA mRNA表达上调,p53 mRNA表达受到抑制
2.2.2相关细胞周期因子的蛋白表达水平 Western blot法检测结果显示,实验组803-p21i细胞的p125、CDK4、CDK2、PCNA蛋白表达水平均高于对照组803-NC细胞、803细胞,p53蛋白表达水平则低于对照组803-NC细胞、803细胞,这与各基因对应的mRNA相对表达水平的变化相一致(P均<0.05,图4)。
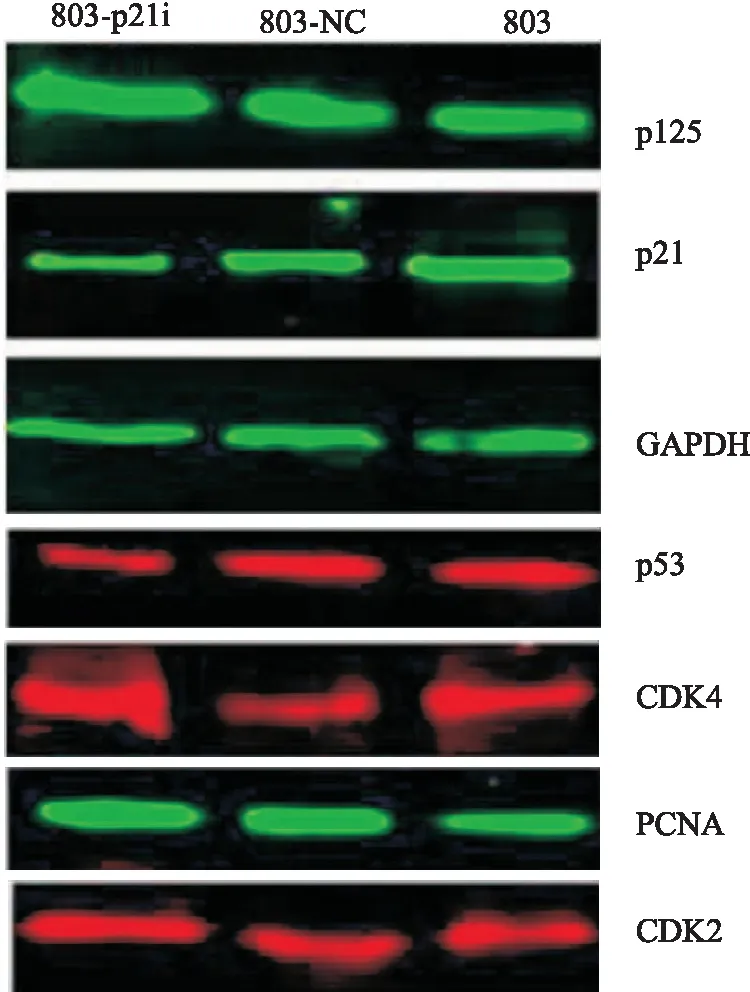
图4 Western blot法检测p21低表达细胞的相关蛋白表达
2.3 免疫共沉淀实验分析p21与p125的相互作用
2.3.1免疫细胞化学 免疫细胞化学染色结果显示,p125表达定位于胃癌MGC-803细胞胞核;p21蛋白表达定位于细胞质和细胞核(图5)。
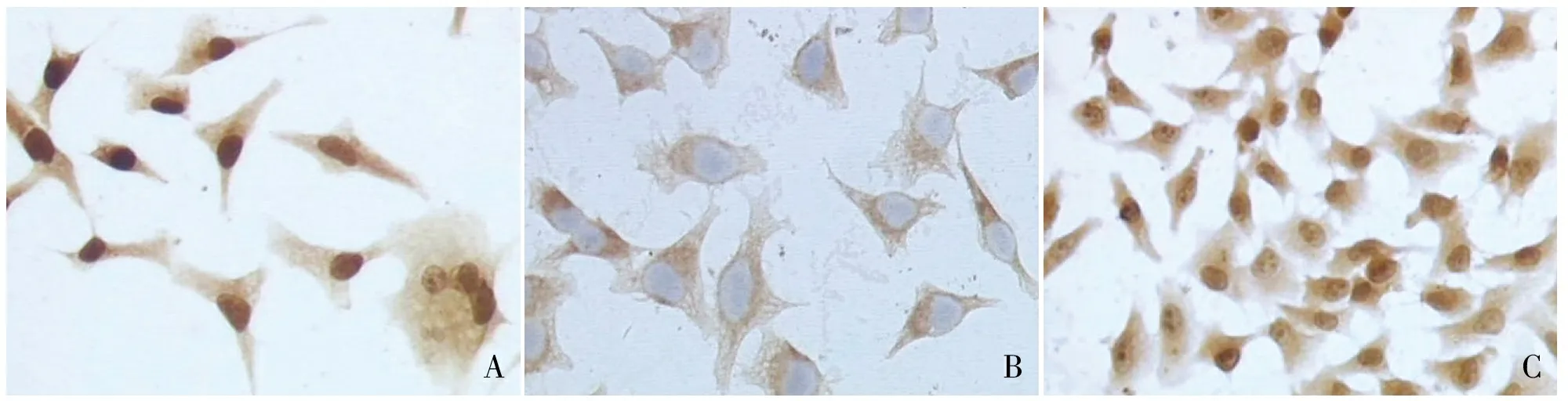
图5 免疫细胞化学检测p125、p21在胃癌细胞MGC-803中的表达:A.p125表达定位于细胞核;B.p21表达定位于细胞质;C.p21表达定位于细胞核,MaxVision法
2.3.2免疫共沉淀实验 分别用p21及p125抗体沉淀MGC-803细胞中提取的总蛋白,获得的沉淀物进行Western blot法检测。用p21抗体沉淀时,沉淀物中检测到p21蛋白,但未检测到p125蛋白,反之用p125抗体沉淀时,检测到p125蛋白,但未能检测到p21蛋白,实验重复3次,结果均一致。表明p21与p125并无蛋白质直接相互作用,或结合作用极弱未能被检测出(图6)。
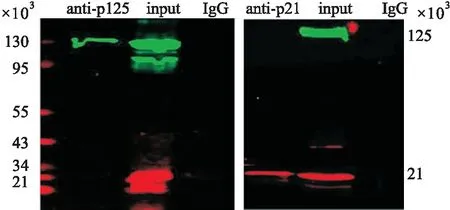
图6 免疫共沉淀实验分析p21与p125的相互作用:图左侧为p125抗体沉淀总蛋白;图右侧为p21抗体沉淀总蛋白
3 讨论
Polδ是真核生物DNA复制最重要的聚合酶之一,其由4个亚基组成,其中p125是其催化亚基,同时具有聚合酶和外切酶功能,p125的编码基因为POLD1,其表达受到细胞周期的调控[3]。Northern blot实验显示,Polδ mRNA表达水平在G1/S期升高了3倍。用Western blot法检测Polδ调控蛋白水平也显示在G1/S期达到峰值,其变化与mRNA水平的变化相似[6]。本期前期实验结果亦发现,POLD1在S期的启动子活性高于G2期或G1期,且在S期早期最高,表明POLD1启动子的活性受到细胞周期严格调控,在G1/S交界处发挥功能的周期相关蛋白可能对其活性调控尤为重要[7]。
p21是一种小分子量非结构化蛋白质,其可以通过与细胞周期蛋白依赖性激酶结合从而使其失活。有研究表明,S期p21的水平决定着DNA复制速度,以保持基因组的稳定性[8]。所以p21曾被认为是一种肿瘤抑制因子[9],主要作用是抑制细胞周期进程,从而导致细胞生长抑制[10-13]。作者推测p21很可能参与了对POLD1的调控,并提出了两种假设:(1)p21蛋白直接与POLD1编码的蛋白质p125相互结合,从而影响Polδ聚合酶功能的发挥。(2)p21不与p125相互作用,而是通过影响其他细胞周期调控因子的表达从而间接地调控POLD1的表达。
本实验采用免疫细胞化学法检测发现p125主要定位于MGC-803细胞胞核内,这与p125在子宫颈癌及子宫颈上皮内病变组织中的亚细胞定位一致[14]。最近也有学者研究发现p125在子宫颈癌细胞株Hela中的表达定位可以在细胞核与细胞质之间来回穿梭[4]。p21蛋白既可定位于细胞质,也可定位于细胞核,定位于不同部位的p21可能发挥着不同的功能[15]。结合p21在胃癌细胞中的亚细胞定位结果,作者认为p21与p125蛋白间可能有直接相互作用。然而,本组的免疫共沉淀实验并未检测到p125蛋白与p21蛋白直接相互作用。提示胃癌细胞MGC-803内p21并未与p125直接结合,或者结合的量极其微弱,Western blot法未检测及。据此作者认为p21与p125不是通过蛋白-蛋白相互作用的方式影响Polδ复制全酶的形成进而影响其DNA复制活性。
本实验通过生物信息学数据库String及软件Cytoscape发现,p21与POLD1之间通过CDK2、PCNA而比较紧密地联系起来,还与CDKs、Cyclin等细胞周期调控相关因子有关。
哺乳动物的细胞周期是由细胞周期蛋白及其相关的细胞周期蛋白依赖性激酶(CDK)复合物驱动的。细胞周期蛋白CDK的异常失调是癌症的标志[16]。CDK4/6在细胞周期的早期具有关键作用,CDK2在细胞周期后期起作用,并具有相当广泛的蛋白质底物,其中一些是正常细胞增殖所必需的[17],据此我们推测CDKs可能参与了p21对POLD1基因的调控。
PCNA是一个与DNA复制、细胞周期、细胞凋亡等相关的蛋白质,目前已发现PCNA可以与Polδ的多个亚基相互结合,在Polδ催化亚基p125的N端存在和PCNA相互作用的保守区域-N2(N末端129-149位),其含有一个PIP盒[18]。DNA复制时,PCNA与Polδ形成复制复合体,使前导链上连续的DNA复制继续进行。而p21的N末端具有保守的CDK/Cyclin结合位点,C末端具有PCNA结合的位点,PCNA-p21复合物可以与多种CDK/Cyclin形成四聚体,使CDK活性被抑制[8]。
有研究表明,p53对G1期向S期的过渡非常关键,注射特异的p53单克隆抗体,会导致细胞不能由G1期进入S期[8]。Cyclin D-CDK4/6复合物在G1期与p21、p27相互作用,阻止CKI与Cyclin E/CDK2结合,从而阻断G1期进程[19]。最近有研究用生物信息学分析发现了210个预期受p53-p21-DREAM-CDE/CHR途径调控的靶基因,大多数是G2期和有丝分裂的重要调节因子,包括细胞周期基因B-MYB(MYBL2)、BUB1、CCNA2、CCNB1、POLD1和RAD54L等基因。Fischer等[20]认为p53阻滞G2/M细胞周期主要是通过p53-p21-DREAM-CDE/CHR途径下调这些基因。
为探究p21是否通过这些相关的细胞周期调控因子来间接调控POLD1基因,本实验建立p21低表达的胃癌细胞系,并检测了POLD1、CDK2、PCNA的基因和蛋白表达水平,结果发现POLD1、CDK2、CDK4、PCNA的表达水平与p21呈负相关,而p53则与p21呈正相关。这表明细胞周期调控因子CDK2、CDK4、PCNA及p53均参与p21对POLD1的调控。另外,有研究者在POLD1启动子中发现了4个潜在的CpG岛,发现转录因子E2F1可与这些位点结合,其结合亲和力随年龄增大而衰减,表明E2F1在衰老过程中可通过结合POLD1启动子而下调POLD1的表达[21]。那么p21是否通过E2F1而间接调控POLD1的表达仍需进一步探究。
总之,本实验结果显示,p21并非通过和p125蛋白-蛋白相互作用的模式调控POLD1基因,而是通过细胞周期调控因子CDK2、CDK4、PCNA、p53等间接调控POLD1基因的表达,更深入的调控机制有待后续实验深入探究。

