大泷六线鱼精巢支持细胞分离培养体系的建立和优化❋
王旭亮, 彭美婷, 赵 茜, 牛晶晶, 齐 洁,2❋❋
(1. 中国海洋大学海洋生命学院, 海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003; 2. 中国海洋大学三亚海洋研究院, 热带海洋生物种质资源开发与种业工程实验室, 海南 三亚 572000)
支持细胞是精巢中不可或缺的一类重要细胞,在生物体的精巢生长发育和精子发生过程中起到至关重要的作用,并且可以促进精原干细胞的维持与自我更新[1]。在成熟精巢中,支持细胞的数量影响了生殖细胞和精子的数量[2]。支持细胞呈不规则的多边形,四周有很多形态各异的凹陷,生殖细胞多附着于凹陷中。在体外单独培养精原细胞往往不易成活,但将支持细胞作为滋养层细胞与之共同培养时,可促进精原细胞的生长增殖[3-4]。这是由于支持细胞的细胞质中含有大量的细胞器,如线粒体、内质网和高尔基体等[5],这些细胞器可为精原细胞提供自我更新和维持过程中所需的多种因子,包括转铁蛋白、碱性成纤维细胞生长因子2(FGF2)、神经胶质细胞源性神经营养因子(GDNF)、胰岛素样生长因子1(IGF-1)和白血病抑制因子(LIF)等[6-15]。此外,相邻的支持细胞间通过紧密连接的形式构成血睾屏障(BTB),其外质特化结构可维持细胞之间的连接,促进精原细胞黏附于支持细胞上[16-21]。目前,国内外对支持细胞的研究报道大多数集中在哺乳动物上,在鼠、兔、牛和羊中已经报道了精巢支持细胞的分离、纯化及培养方法[22-25]。鱼类中,在尼罗罗非鱼、褐牙鲆和暗色颌须鮈中已有精巢支持细胞的分离培养研究,而其他鱼类中关于精巢支持细胞的研究较少[26-28]。
大泷六线鱼(Hexagrammosotakii)是中国北方特有的海水经济鱼类之一,因其怀卵量少、鱼卵具有高黏性以及遇到海水后极易黏结成团块状等特性,导致其人工授精与孵化存在着诸多困难[29]。通过移植大泷六线鱼的精原细胞至种内或种间受体鱼可能是解决大泷六线鱼大规模繁育的方法之一。本研究对大泷六线鱼精巢支持细胞进行了分离、体外培养和鉴定,以期为建立其支持细胞的细胞系奠定基础,同时也为其精原细胞稳定的体外培养环境提供理论参考。
1 材料与方法
1.1 动物来源与取样
本实验选取健康、生长状态良好且处于精原细胞增殖期的大泷六线鱼(体长12~18 cm,体质量40~60 g),用浓度100 mg/L的MS-222麻醉剂将大泷六线鱼麻醉10 min后,对其进行断椎处理,从泄殖孔剖开腹腔后取出精巢并将其放于含20%三抗(青霉素-链霉素-两性霉素B混合溶液)的PBS缓冲液(1 L配方:8.5 g NaCl、2.684 g Na2HPO4·12H2O、0.39 g NaH2PO4·2H2O,pH=7.4)中浸泡除菌10 min。
1.2 大泷六线鱼精巢支持细胞的分离和原代培养
用含10%三抗(青霉素-链霉素-两性霉素B混合溶液,其中青霉素含量为10 mg/mL,链霉素含量为10 mg/mL,两性霉素B含量为25 μg/mL)的PBS缓冲液将解剖获得的精巢清洗5~6次,彻底去除精巢外部的结缔组织及血块;取适量精巢组织放入含有1 mL无血清培养基的细胞培养瓶中,剪成1 mm3左右的组织块;并用直径0.4 μm的筛网将组织块与精子、其他游离的细胞以及细胞碎片分离;然后用无血清培养基对组织块进行清洗,清洗2次后暂存于无血清培养基中备用。
1.2.1 组织块培养法原代培养 将组织块均匀铺在培养瓶中,静置待组织块固定后,向培养瓶中无组织块的一侧加入培养基,在组织块不接触培养基的条件下倒置4 h使组织块黏附在培养瓶中,随后将培养瓶翻转使组织浸入培养基,在无CO2、24 ℃恒温培养箱中继续培养。待组织周围有细胞呈放射状迁出后,更换培养基,此后每3天进行1次换液。
1.2.2 酶解法原代培养 将收集的组织块放于含1 mg/mL胶原酶Ⅳ的无血清培养基的细胞培养瓶中,在24 ℃条件下摇晃酶解2 h,期间通过镜检观察酶解程度,待大多数组织被酶解成单个细胞后,加入胎牛血清(FBS)终止酶解反应,用移液枪将酶解后的细胞团吹散。然后向培养瓶中加入适量的培养基,放于24 ℃恒温培养箱中培养,待细胞贴壁生长后,更换新的培养基,此后每3天进行1次换液。
1.3 不同培养基对支持细胞原代培养的影响
1.3.1 基础培养基对支持细胞原代培养的影响 分别使用L-15、DMEM/F12和DMEM培养基进行支持细胞原代培养,24 ℃恒温培养7 d后,观察不同培养基中细胞的迁出和贴壁状态。
1.3.2 胎牛血清(FBS)浓度和生长因子对支持细胞原代培养的影响 在含有不同浓度FBS的L-15培养基中,添加0.1 mmol/L非必需氨基酸(BioInd)或1%鱼胚胎提取液,24 ℃恒温培养7 d后观察细胞的迁出和贴壁状态。
鱼胚胎提取液的制备:取大泷六线鱼桑椹胚或囊胚时期的胚胎,经过3次反复低温冻融(-80 ℃),4 000 r/s离心5 min,吸取上清液并通过0.22 μm滤膜过滤除菌获得鱼胚胎提取液。
1.4 大泷六线鱼精巢支持细胞传代培养
待细胞的贴壁率达到75%以上时,可对细胞进行传代。首先,弃去原有培养基,使用不含FBS的培养基或PBS缓冲液清洗贴壁细胞2次,加入1 mL 0.25%胰蛋白酶室温酶解5 min后,轻轻摇晃培养瓶使细胞脱落。待细胞悬浮后,加入1 mL FBS终止酶解反应;然后,用移液枪将细胞团吹打成单细胞,再加入适量新鲜培养基,于24 ℃恒温培养箱中继续培养,每2 d进行1次换液。
1.5 大泷六线鱼精巢支持细胞的染色鉴定
使用BCIP/NBT碱性磷酸酶染色试剂盒(Beyotime)对贴壁的细胞进行染色(染色方法按试剂盒说明书进行),其中干性的细胞会被染成紫色,非干性的细胞无法被染色,从而可以鉴定贴壁细胞是否为支持细胞,同时以干性的精原细胞作为阳性对照。
1.6 大泷六线鱼精巢支持细胞的分子鉴定
通过TRIzol法提取支持细胞总RNA,利用PrimeScript RT reagent Kit(Taraka)合成cDNA用于qPCR检测。使用Primer Premier 5.0软件设计大泷六线鱼wt1、plzf、vasa基因的特异性引物(见表1),选用18SrRNA基因作为内参,利用LightCycler 480 real-time PCR system(Roche)进行qPCR检测。反应体系共20 μL,包括10 μL 2×SYBR® Premix Ex TaqTMⅡ (Takara)、0.4 μL 10 nmol/L正反向引物、2 μL 5 ng/μL模板cDNA和7.2 μL灭菌DEPC水。反应条件:95 ℃预变性5 min;95 ℃ 15 s,60 ℃ 45 s,共40个循环;每组设置3个重复。数据分析采用2-ΔΔCt的方法,通过SPSS 14.0软件对进行显著性分析,P<0.05时表明具有显著性差异。

表1 本研究中所用到的引物序列
1.7 支持细胞增殖曲线的绘制
利用血球计数板进行细胞计数,即5个中方格细胞数总和÷稀释倍数×103=1 mL的细胞总数。将悬液细胞数量控制在104个/mL左右,在24孔板中进行传代培养,每2 d更换1次培养基,每天进行细胞计数,连续统计6 d,绘制细胞增殖曲线。
2 结果
2.1 大泷六线鱼精巢支持细胞的分离和原代培养
2.1.1 组织块培养法对原代精巢支持细胞迁出的最适培养条件筛选
2.1.1.1 不同基础培养基对原代精巢支持细胞迁出的影响 通过组织块培养法分离获得的支持细胞在L-15、DMEM/F12和DMEM 3种基础培养基中均从第三天开始迁出。7 d后,组织块周围出现小面积的生长晕,如图1所示。比较细胞迁出结果可知L-15基础培养基(见图1A)为大泷六线鱼组织块培养法精巢支持细胞原代培养的最适培养基,其细胞迁出的数量和范围均远高于另外2种培养基(见图1B、C)。
2.1.1.2 FBS浓度和生长因子对原代精巢支持细胞迁出的影响 为探究不同浓度FBS对原代精巢支持细胞迁出的影响,向L-15培养基中分别添加5%和10%的FBS,结果显示添加FBS有利于原代精巢支持细胞的迁出,FBS添加组(见图2B、C)相对未添加组(见图2A)的细胞迁出效果更好,其中添加10% FBS促进细胞迁出效果最佳。此外,在含10% FBS的基础上再添加0.1 mmol/L非必需氨基酸(见图2E)或1%鱼胚胎提取液(见图2H)可进一步促进原代精巢支持细胞的迁出。

(A:L15培养基;B:DMEM//F12培养基;C:DMEM培养基。比例尺:100 μm。A: L15; B: DMEM/F12; C: DMEM. Scale bar: 100 μm.)

(A、D、G: 无血清添加;B、E、H:添加10% FBS;C、F、I:添加15%FBS;A、B、C:未添加血清外其他成分;D、E、F:添加0.1 mmol/L所有类型非必需氨基酸;G、H、I:添加1%鱼胚胎提取液。比例尺:100 μm。A, D, G: no serum added; B, E, H: 10% FBS added; C, F, I: 15% FBS added; A, B, C: no other components except serum added; D, E, F: 0.1 mmol/L each non-essential amino acid added; G, H, I: 1% extracting solution from fish embryos added. Scale bar: 100 μm.)
2.1.2 酶解法对原代精巢支持细胞最适培养条件的筛选 根据组织块培养法实验结果对培养基类型和FBS添加浓度进行调整,酶解法培养条件优化实验选取L-15、DMEM/F12和M199 3种培养基,然后将5%和10% FBS分别添加到每种培养基中,培养7 d后的细胞贴壁数量和状态如图3所示。对各组结果进行比较表明含10% FBS的L-15培养基同样适合酶解法分离的精巢支持细胞的原代培养。
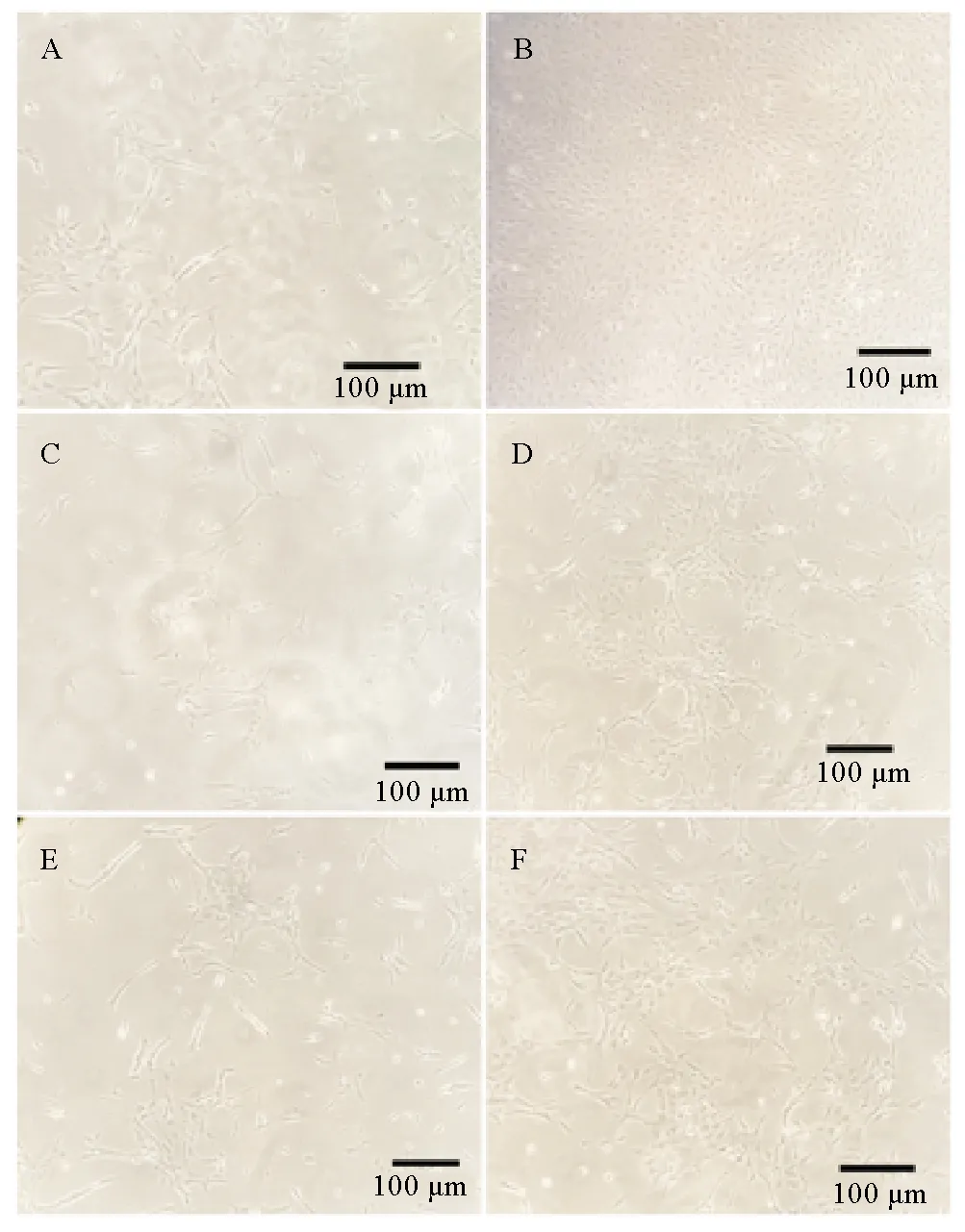
(A、B:L-15;C、D: DMEM/F12;E、F: M199;A、C、E:添加5%FBS;B、D、F:添加10%FBS。比例尺:100 μm。A, B: L-15; C, D: DMEM/F12; E, F: M199; A, C, E: 5% FBS added; B, D, F: 10% FBS added. Scale bar: 100 μm.)
2.2 大泷六线鱼精巢支持细胞的鉴定
2.2.1 精巢支持细胞的形态观察 用筛选的最适培养基(L-15)对大泷六线鱼精巢支持细胞进行原代培养,在细胞贴壁率达到75%以上时进行传代培养,并对2种方法分离培养的细胞进行形态观察。结果显示组织块培养法分离培养的细胞形态多样,表明除支持细胞外,还存在梭形的成纤维细胞和少量圆形的生殖细胞(见图4A);酶解法分离培养的细胞形态单一,呈现不规则多边形,并未出现其他类型的细胞(见图4B)。因此,利用酶解法分离培养获得精巢支持细胞纯度更高,可用于后续实验。

(A:组织块培养法分离培养的精巢支持细胞;B:酶解法分离培养的精巢支持细胞。比例尺:100 μm。A: Sertoli cells isolated and cultured by explanted tissue culture method; B: Sertoli cells isolated and cultured by enzyme digestion culture method. Scale bar: 100 μm.)
2.2.2 酶解法迁出的精巢支持细胞的染色鉴定 通过碱性磷酸酶染色来检测酶解法分离并培养的精巢支持细胞是否存在精原细胞。结果显示,酶解法分离和培养的精巢支持细胞未被染成紫色(见图5A),而具有精原细胞的对照组则被染成深紫色(见图5B),表明培养的细胞中不存在干性的精原细胞。

(A:支持细胞碱性磷酸酶染色结果;B:精原细胞碱性磷酸酶染色结果。比例尺:50 μm。A: Sertoli cells staining; B: Spermatogonia staining. Scale bar: 50 μm.)
2.2.3 酶解法迁出的精巢支持细胞的分子鉴定 利用精巢不同类型细胞的标记基因对酶解法分离和培养的细胞进行分子鉴定,结果显示生殖细胞标记基因plzf、vasa几乎不表达,而支持细胞标记基因wt1高表达,因此wt1表达水平显著高于plzf和vasa,这说明可通过酶解法来分离培养获得纯度较高的大泷六线鱼精巢支持细胞(见图6)。

图6 wt1、vasa和plzf基因在酶解法分离培养的 精巢支持细胞中的表达水平
2.3 大泷六线鱼精巢支持细胞的生长曲线
对稳定传代的精巢支持细胞进行了生长周期测定,结果显示:在接种的初级阶段(1~3 d),细胞快速增殖,细胞数目急剧增加;在中间阶段(3~4 d),细胞的增殖速度放缓,细胞数目稳定上升;在接种后第四天,细胞有衰退迹象,但数目维持稳定;接种后第五天,细胞进入衰退期(见图7)。

图7 大泷六线鱼精巢支持细胞的生长曲线
3 讨论
3.1 支持细胞的原代培养方法
获取原代支持细胞一般采用胰蛋白酶消化法和差速贴壁法[30]。本研究中,采用了2种方法获取原代细胞:组织块培养法和酶解法。用组织块培养法迁出的细胞中虽然大部分都是支持细胞,但还存在一些成纤维细胞及生殖细胞,细胞培养后期很难将除支持细胞外的其他细胞去除,而酶解法得到的细胞类型比较单一,所以酶解法是获取高纯度支持细胞的最优方法。
在哺乳动物精巢支持细胞系建立的过程中,多采用胰蛋白酶对精巢组织进行酶解消化。针对鱼类细胞通常较为脆弱这一特点,本文作者使用胶原酶Ⅳ对精巢组织块进行酶解消化,相较于胰蛋白酶酶解消化,胶原酶酶解消化组织更温和,酶解消化后分离的细胞损伤更小,所获得的细胞在24 h后的贴壁率可以达到95%以上。此时使用差速贴壁法除去原培养基中的悬浮细胞,并用1×PBS缓冲液清洗贴壁细胞2次,更换培养基,除去生殖细胞来进一步纯化分离的细胞,从而提高培养细胞的纯度。
3.2 不同培养基对原代细胞培养的影响
在细胞培养中,培养基的组成成分在细胞的生长和增殖中起到重要作用。不同的基础培养基,不同的FBS浓度以及生长因子的添加等都会对细胞的生长增殖产生影响。常用的基础培养基有MEM、DMEM、DMEM/F12、M199和L-15等[31]。MEM是最基本的培养基,主要用于一些贴壁细胞的培养;DMEM培养基是在MEM基础上研制的,含有葡萄糖与各种氨基酸,常用于快速生长的细胞培养。DMEM/F12与M199基础培养基中虽然加入了HEPES作为缓冲剂,但在长时间培养细胞的情况下,也会导致培养液pH显著升高,而支持细胞在高pH的培养环境中难以贴壁,不利于细胞生长。L-15培养基中除了添加HEPES作为缓冲剂外,还含有高浓度的氨基酸,同时使用半乳糖代替常用的葡萄糖,进一步提高了培养基的缓冲能力,以解除pH变化较大不利于细胞培养的限制。由于L-15培养基的组成成分中没有添加NaHCO3,因此不需要CO2作为缓冲,本实验的大泷六线鱼精巢支持细胞在L-15培养基且无CO2的恒温培养箱中培养,培养基中因长时间细胞培养而升高的pH可用培养基中的丙酮酸代谢产生CO2来平衡。
细胞培养中必须添加营养物质或生长因子等才能使细胞正常生长与增殖。培养基需要添加一定浓度的血清,血清浓度依据培养细胞种类而定。目前广泛使用的血清主要为马血清和胎牛血清(FBS)。马血清常用于有丝分裂后的神经元培养,即使其浓度较高,也能促进细胞的分化;FBS常用于培养增殖细胞,也可用于多种细胞系的传代培养和细胞的原代培养。在大鼠睾丸支持细胞培养中,采用的FBS浓度为20%[32],而在本研究中发现,较低浓度的FBS(10%)更适用于硬骨鱼支持细胞的培养,因此推测这可能与加入FBS后培养基的微环境改变(pH及渗透压)相关。综上筛选出大泷六线鱼精巢支持细胞的最优培养基,即添加0.1 mmol/L非必需氨基酸或1%鱼胚胎提取液且含10% FBS的L-15培养基。
3.3 支持细胞的鉴定
由于在精原细胞的体外培养中,支持细胞通常作为滋养层细胞,所以对支持细胞类型的鉴定尤为重要。在小鼠中,已有研究表明wt1基因可在未成熟的支持细胞中表达,且一直持续表达至支持细胞成熟后,是广泛应用的支持细胞标记基因[33];除了分子标记鉴定外,还可以通过细胞染色的方法对支持细胞的纯度进行鉴定[34]。通过罗丹明123染色可观察到支持细胞细胞质中线粒体的含量较高,这与其分泌的能力强相关;同时用碱性磷酸酶染色,支持细胞呈阴性,未被染成紫色。这些方法都能对支持细胞进行有效的分离和鉴定[35]。
在本研究采用了形态观察、细胞干性染色及分子标记基因表达等方法对分离出的细胞进行了鉴定。分离的细胞具有与大鼠睾丸支持细胞相同的多边形上皮样细胞形态[36],同时通过细胞碱性磷酸酶染色显示细胞中没有包含具有干性的精原细胞,并且分离的细胞中大量表达支持细胞的标记基因wt1,这些试验结果表明,本实验中所分离和培养的细胞是大泷六线鱼精巢支持细胞。

