青梗菜游离小孢子培养关键因素研究
张 琨, 王一衡, 王 琦
(1.山西大同大学生命科学学院, 山西 大同 037009;2.天津市农业科学院生物技术研究所, 天津 300384)
青梗菜(BrassicacampestrisL. ssp.chinensisMakino var.communisTsen et Lee)是十字花科芸薹属芸薹种白菜亚种的一个变种,属于小白菜中的一种,别名青菜、油菜等。其株型直立,头大束腰,叶色亮绿,味道鲜嫩,营养价值高,是我国产销量较大的蔬菜种类之一。选育优质、整齐度高、抗病、耐抽薹的青梗菜新品种始终是育种工作者的目标。目前,生产上青梗菜主要是利用其异花授粉、天然杂交率高的特点进行杂种优势育种。按常规育种程序推算,杂交前的连续多代自交纯化亲本需要5~8年,不仅费时费工,而且缺乏对市场需求变化的有效把握。近年来,随着单倍体育种技术的不断发展,利用游离小孢子培养快速创制纯系、辅助传统育种,已在白菜[1-2]、甘蓝[3-4]、玉米[5]等作物的商业育种中得到了广泛应用,不仅大幅缩短育种周期,同时增加对有益遗传性状的选择概率,显著提高育种效率[6]。
自1973年Nitsch等[7]首次报道了毛曼陀罗游离小孢子培养获得成功以来,以小孢子培养为核心的单倍体诱导技术已在200余种植物中得到了应用[8]。青梗菜小孢子培养研究起步较晚,1992年曹鸣庆等[9]发表了包括青梗菜在内的多种小白菜类蔬菜作物小孢子培养简报,奠定青梗菜小孢子培养的技术基础。此后,研究人员对青梗菜小孢子胚诱导因素等进行大量探索,并取得较大进展[10-12]。2009年,冯辉等[13]率先通过游离小孢子培养创制出青梗菜双单倍体(Doubled Haploid,DH)系,并成功应用于杂交选育实践。然而,青梗菜小孢子培养由于受供体植株基因型、培养预处理以及培养基种类等多方面因素的影响,其出胚率不高、胚状体成苗率低等仍是实际应用中的一大难题。为此,本研究以10种不同基因型青梗菜为试材,对小孢子培养中影响胚发生和胚成苗的关键因素进行研究,为优化青梗菜小孢子培养体系、高效稳定地获得青梗菜DH株系奠定基础。
1 材料与方法
1.1 材 料
试验以10份不同基因型青梗菜材料为供体进行游离小孢子培养(表1)。8月底将萌动的青梗菜种子在4 ℃低温条件下春化20 d,9月中旬播种,10月底移栽于温室。采用常规栽培管理方法,于12月初至翌年3月开花取样进行小孢子培养。
1.2 方 法
1.2.1小孢子分离和培养
于盛花期,从健壮植株上取2~3 mm长的花蕾(单核靠边期),4 ℃低温预处理1 d。参照黄天虹等[14]的方法分离、纯化小孢子后,用1/2 NLN培养基进行小孢子悬浮培养。按每皿4个花蕾的小孢子密度,将小孢子悬浮液以每皿5 mL分装于直径60 mm的培养皿中,Parafilm膜封口。33 ℃暗培养下热激处理1 d,转至25 ℃恒温箱中继续暗培养,20 d后统计小孢子胚数目。
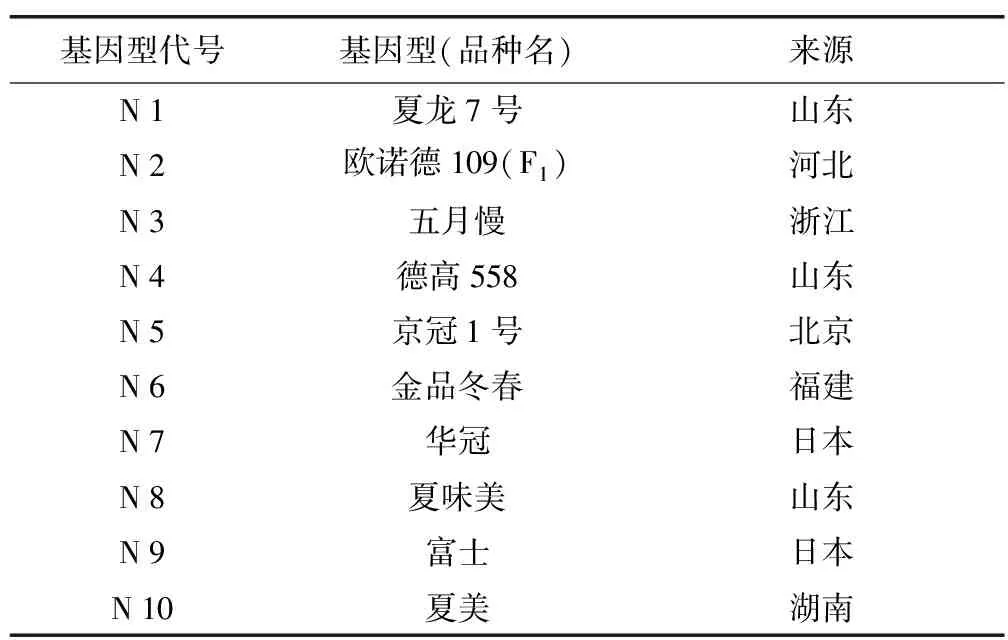
表1 供试青梗菜及来源
1.2.2各因素对小孢子培养胚胎发生能力影响分析
基因型试验:以上述10个青梗菜品种为试材,在胚状体诱导培养基1/2 NLN上培养。
温度试验:以易出胚基因型N 1、N 2和难出胚基因型N 7、N 8为材料,分别进行接种前4 ℃低温预处理和接种后33 ℃高温预培养试验。高、低温处理时间设置0、1、2、3、4 d各5个试验处理组。所有处理均培养于1/2 NLN培养基,试验以未经温度处理的材料为对照。
植物生长调节剂试验:选择N 2、N 5和N 9为处理材料,以1/2 NLN培养基为基础,共设计8种不同浓度配比的激素组合(表3),试验以未添加激素处理的材料为对照。
各试验中每个处理设置重复3次,每个重复5皿,20 d后统计小孢子的出胚数。
1.2.3小孢子培养植株再生
将易出胚材料N 1、N 2获得的不同发育时期的胚状体,接种于MS +100 mg/L活性炭的胚状体再生培养基,光照培养室(25 ℃,2 000 lx、16 h光照/d)培养至胚状体长出真叶,转入1/2 MS+0.10 mg/L NAA生根培养基,培养14 d后统计植株生根情况。
1.2.4数据分析
利用SPSS 24.0软件对数据进行统计处理。
2 结果与分析
2.1 基因型对小孢子胚诱导率的影响
试验结果显,供试的10个青梗菜品种在小孢子培养20 d后全部获得了胚状体(图1),但不同基因型的出胚率差异显著(表2)。出胚率最高的是N 1,平均每花蕾出胚6.42个;最低的是N 10,平均每花蕾出胚0.17个,二者相差达38倍。按照胚胎发生能力,可将供试材料分为易出胚、中出胚和难出胚三类基因型。其中,易出胚基因型2个,中出胚基因型4个,难出胚基因型4个,表明不同基因型对青梗菜小孢子胚胎形成影响很大。

表2 不同基因型对青梗菜小孢子出胚率的影响Table 2 Effect of genotypes on formation of microspore-derived embryos in pakchoi
图1 青梗菜小孢子培养20 d后形成的胚状体Fig.1 Microspore-derived embryoids after 20 days culture in pakchoi
2.2 温度处理对小孢子胚诱导率的影响
从图2可见,接种前对青梗菜花蕾进行1 d的4 ℃低温预处理,可提高小孢子胚诱导率,但处理超过2 d,小孢子出胚率则明显降低。如图3所,接种后的高温诱导是小孢子成胚的关键。供试不同基因型材料未经33 ℃高温处理,均未形成胚状体;1~2 d的热激处理条件对青梗菜诱导出胚最为有利,热激超过2 d,诱导效果下降。
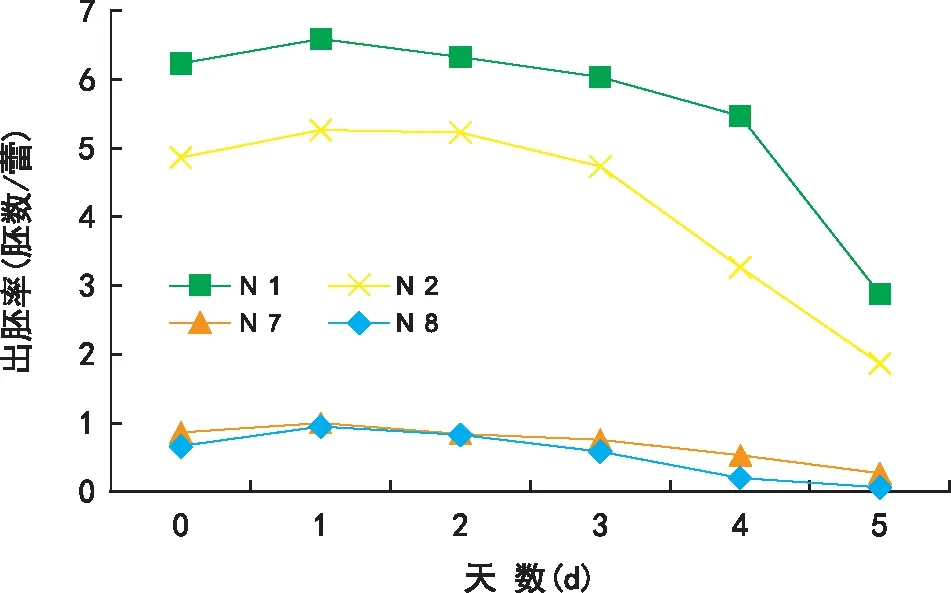
图2 低温预处理对青梗菜小孢子出胚率的影响Fig.2 Effect of low-temperature pretreatment on formation of microspore-derived embryos in pakchoi
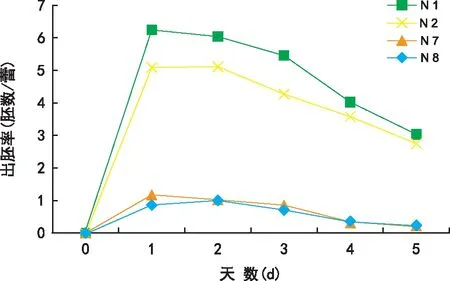
图3 热激处理对青梗菜小孢子出胚率的影响Fig.3 Effect of heat shock treatment on formation of microspore-derived embryos in pakchoi
2.3 外源激素对小孢子胚诱导率的影响
在1/2 NLN培养基中添加较低浓度的NAA和6-BA,有助于促进青梗菜小孢子胚状体诱导。表3说明,在未添加外源激素的培养基(A)中,虽可诱导胚状体发生,但产胚量较低。此外,加入较高浓度激素(H),也会对青梗菜小孢子胚胎发生产生抑制作用。本试验中0.20 mg/L NAA+0.05 mg/L 6-BA的外源激素组合对青梗菜小孢子胚诱导效果最好。
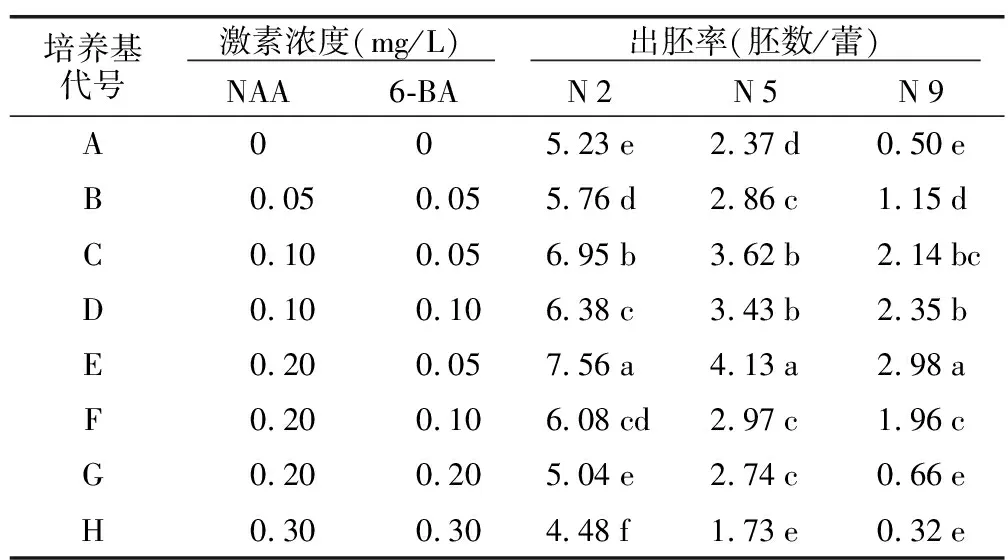
表3 激素处理对青梗菜小孢子出胚率的影响Table 3 Effect of hormone treatment on formation of microspore-derived embryos in pakchoi
2.4 胚状体发育时期对小孢子植株再生的影响
从表4可以看出,青梗菜小孢子诱导形成的胚状体,存在子叶形胚、鱼雷形胚、心形胚等不同发育阶段类型,胚胎发育表现出不同步现象。不同基因型材料中子叶形胚的占比最大,将子叶形胚依次转至再生培养基和生根培养基,胚状体逐渐变绿(图4 a),其中75%以上的子叶形胚经分化、发育(图4 b、c),可形成根芽俱全的再生植株(图4 d)。鱼雷形胚和心形胚经分化发育也可诱导植株再生,但成苗数和成苗率较低。圆球形胚在此过程中分化困难,多数褐化死亡。由此可见,子叶形胚再生成苗能力最强,胚状体所处发育阶段是影响胚成苗的关键。

注:a为小孢子胚状体萌发;b为小孢子胚分化;c为小孢子培养试管苗;d为再生苗诱导生根。图4 青梗菜小孢子植株再生过程Fig.4 The regeneration of microspore-derived plant of pakchoi

表4 胚状体发育时期对青梗菜小孢子胚植株再生的影响Table 4 Effect of embryoid development stage on microspore-derived plant regeneration in pakchoi
3 讨论与结论
游离小孢子培养技术在芸薹属作物中已得到广泛研究,但小孢子出胚率和再生率普遍较低始终是限制其高效应用的重要障碍。在影响小孢子培养的众多因素中,基因型对胚胎发生及培养能否获得成功具有决定性作用。研究表明,不同基因型大白菜的产胚率差别很大,从3.8~42.4胚/蕾不等[15]。甘蓝型油菜低出胚基因型和高出胚基因型相比,其胚胎诱导率相差百倍以上[16]。小白菜大部分基因型产胚率不高,胚产量普遍在5胚/蕾以下[10-14]。本研究所选用的10个青梗菜基因型材料,全部获得了小孢子胚,基因型反应范围达100%,但不同基因型间产胚率差异极大,明显形成了易出胚、中出胚和难出胚三类基因型。其中易出胚基因型N 1是难出胚基因型N 10的38倍,证明了基因型对青梗菜小孢子诱导胚胎形成有显著影响。有研究发现,将较难出胚的基因型通过杂交方法转移至易出胚基因型,可扩大小孢子胚胎发生的基因型范围,提高胚诱导率[17]。在实际工作中,可利用此特点使一些农艺性状好但出胚率低的种质资源得以利用。
温度是影响小孢子培养成功的关键因素之一。在小孢子接种前,4 ℃低温预处理花蕾,有利于启动脱分化和提高小孢子成胚效率[18]。黄天虹等[14]发现接种前的低温胁迫处理对不结球白菜小孢子胚胎发生是必需的,未经低温预处理的小孢子难以诱导胚状体形成。耿建峰等[19]则认为,低温预处理对白菜小孢子胚诱导率影响不大。本试验结果表明,未经低温预处理的青梗菜小孢子也可诱导胚胎发生,4 ℃处理1 d可明显提高其胚诱导率,但超过2 d诱导率反而降低,这可能是短时间低温处理可使小孢子保持较高的生物活性,而处理时间过长则会使小孢子活力降低,难以启动脱分化。接种后给予短时热激处理,可提高小孢子培养的效率[20]。本研究发现,热激处理对青梗菜小孢子胚状体诱导十分关键。对青梗菜小孢子于33 ℃进行1~2 d的热激处理后,明显提高了胚状体诱导频率,热激超过2 d,诱导率反而下降,这与耿建峰等[19]的研究结论相似。
外源激素对不同芸薹属作物小孢子胚发生的影响存在一定差异。多数研究认为,在胚状体诱导培养基中添加一定浓度的生长素和细胞分裂素,可显著提高胚状体诱导效果[12-13,21-22]。但也有报道发现,外源激素对小孢子胚诱导率作用不大[19],甚至超过适宜浓度时还会出现抑制作用[11-21]。在本试验中,低浓度NAA(0.20 mg/L)和6-BA(0.05 mg/L)对青梗菜小孢子胚诱导效果最好,不加外源激素的培养基产胚量较低,说明外源激素是影响青梗菜小孢子胚诱导的重要因素。同时高浓度激素反而阻止了青梗菜小孢子胚胎的形成,推测可能是过量激素对小孢子产生了毒害作用。
小孢子胚的质量是影响其能否发育成苗的内在因素,选择适宜发育阶段的胚状体可有效提高再生成苗的成功率。申书兴等[23]研究表明,通过小孢子培养获得的胚状体其发育存在不同步性,往往是子叶形胚、鱼雷形胚、心形胚、圆球形胚及畸形胚等多种不同类型并存,不同类型胚状体胚成苗率不同,其中子叶形胚成苗能力最强。本研究结果显,子叶形胚成苗率最高,少量鱼雷形胚和心形胚能萌发转绿,但大部分不能分化成苗,圆球形胚和畸形胚不能成活,多数褐化死亡。因此,如何有效提高青梗菜小孢子胚发育的同步性,促进子叶形胚的大量形成和正常发育,是决定青梗菜小孢子植株再生的关键,也是后续研究工作的一大重点。

