贝那普利对肝纤维化大鼠NOX4和Nrf2的影响
李 静,申风俊
(山西医科大学第一医院消化内科,太原 030001;*通讯作者,E-mail:919016603@qq.com)
肝纤维化(hepatic fibrosis,HF)是一个细胞外基质过度沉积的病理性过程,目前已知,氧化应激(oxidative stress,OS)和肾素-血管紧张素系统在肝纤维化的进展过程中都发挥了重要的作用,且两者相互作用。氧化系统及抗氧化系统的平衡在机体内环境稳态的维持中起着重要作用。肝脏的内环境在氧化代谢产物活性氧簇(reactive oxygen species,ROS)的生成与消除中维持着动态平衡,各种病因导致的肝纤维化均有氧化应激的参与。还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)是机体内氧化系统的一个多蛋白复合体,是目前已知唯一的专职产生ROS的酶类[1]。当机体受到氧化性刺激因素作用时,NOX4能够促进ROS产生,介导氧化应激损伤。有研究表明,在肝脏组织和被血清培养激活的原代造血干细胞中,NOX4 mRNA明显增多,而在缺乏NOX4的造血干细胞中,ROS生成则被减弱[2]。核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)作用于各种酶转录因子,在抑制肝脏炎症的发展中起着重要作用。对小鼠的功能性分析表明,Nrf2通过改善纤维生成对慢性肝病的起始和进展起保护作用。人肝组织免疫组化分析显示,慢性肝病患者肝组织中氧化应激水平升高,Nrf2表达增加[3]。局部肾素-血管紧张素(RAS)系统的经典RAS途径中,血管紧张素Ⅱ(AngⅡ)是核心效应分子,它是一种重要的炎症促进因子,能够促进细胞外基质(ECM)合成以及细胞增殖,促进纤维化的形成。肾素血管紧张素转换酶抑制剂(ACEI)在长期治疗高血压的过程中,可抑制心肌重塑,能够用来治疗心力衰竭,因此认为ACEI有抗纤维化的作用。许莹莹等[4]通过观察发现,ACEI类药物贝那普利能够升高Nrf2 mRNA、降低NOX4 mRNA水平,显著改善肝纤维化的程度。但对于贝那普利是否能够影响NOX4及Nrf2的蛋白质表达水平,进而影响肝纤维化的发生发展鲜有研究。本实验建立四氯化碳诱导的肝纤维化大鼠模型,用免疫组化的方法研究贝那普利是否可以通过影响NOX4和Nrf2的表达,进而干预肝纤维化的进程,并探讨血管紧张素转换酶抑制剂抗肝纤维化的机制,为临床防治肝纤维化寻找新的治疗靶点。
1 材料和方法
1.1 实验材料
清洁级健康雄性SD大鼠购于河北医科大学实验动物中心;四氯化碳购于天津市风船化学试剂科技有限公司;贝那普利由北京诺华制药有限公司提供;NOX4和Nrf2抗体试剂盒和多聚体抗兔IgG-HRP试剂盒购于太原市正和生物科技有限公司;DAB显色试剂盒、二甲苯、乙醇等由山西医科大学第一医院病理科提供。
1.2 实验方法
将22只清洁级健康雄性SD大鼠(180~210 g)随机分为3组:对照组6只,模型组8只,治疗组8只。模型组及治疗组予40%四氯化碳皮下注射,初始剂量为5 ml/kg,之后剂量为2 ml/kg,2次/周,共8周;对照组予等剂量油剂皮下注射,2次/周,共8周。在造模同时,治疗组予贝那普利灌胃,剂量为10 mg/(kg·d),对照组和模型组予等剂量生理盐水灌胃,共8周。三组大鼠均给予正常饮食,在结束给药当天(即实验第56天)分别随机处死各组大鼠6只,留取相同部位肝组织待用。贝那普利剂量选定:既往学者在研究ACEI类药物贝那普利对心脏和肾脏影响的实验中,发现贝那普利10 mg/(kg·d)可有效降低胶原表达,改善动脉血管重塑[5-7],因此,我们也采用此实验剂量研究了贝那普利对肝脏纤维化的影响。
1.3 标本获取及处理
各组大鼠处死前禁食12 h,严格遵循无菌原则,用25%乌拉坦(4 ml/kg)麻醉,无菌手术刀打开腹腔(同时观察有无腹水和腹水量,做好记录),观察并记录肝脏大体特征(形态、颜色、大小、质地等),留取相同部位肝组织,0.9%氯化钠溶液冲洗后固定、脱水、透明、包埋,切片行HE及Masson染色。免疫组化法测定肝组织中NOX4和Nrf2水平:400倍光镜下随机选择3个视野,Image Pro Plus 6.0图像分析软件进行定量分析,计算NOX4和Nrf2阳性蛋白的平均光密度值。平均光密度值越高,说明阳性蛋白表达量越多。
1.4 统计学处理
2 结果
2.1 病理学表现
肉眼观察:对照组大鼠肝脏体积正常,红褐色,质软,表面和边缘光滑,组织弹性好。与对照组相比,模型组大鼠肝脏体积减小,呈土黄色,质较硬,表面可触及颗粒样改变。治疗组大鼠肝脏体积介于对照组和模型组之间,略呈土黄色,质较韧,表面颗粒样改变较模型组轻。
病理组织学:对照组大鼠肝脏结构正常,肝小叶结构完好。与对照组相比,模型组可见明显变性、坏死,肝小叶结构被破坏,有假小叶形成,大量炎性细胞浸润。与模型组相比,治疗组肝组织变性、坏死减轻,纤维条索较模型组窄(见图1)。
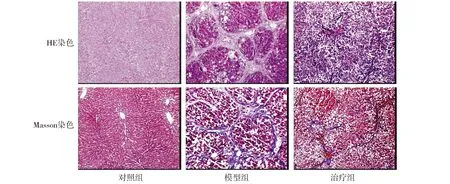
图1 三组大鼠第8周肝组织HE染色和Masson染色病理结果 (×40)Figure 1 Pathological changes of liver tissue by HE staining and Masson staining at the 8th week in the three groups (×40)
2.2 各组肝组织中NOX4和Nrf2阳性蛋白的表达
NOX4阳性蛋白和Nrf2阳性蛋白显色均为棕黄色,NOX4阳性蛋白定位于肝细胞胞浆、纤维间隔及部分血管内皮细胞;Nrf2阳性蛋白显色主要定位于肝细胞胞浆(见图2)。光学显微镜(×400)下观察,可见对照组无明显NOX4和Nrf2阳性蛋白。与对照组相比,模型组肝组织中NOX4和Nrf2阳性蛋白的平均光密度值升高,差异有统计学意义(P<0.05);与模型组相比,治疗组肝组织NOX4阳性蛋白平均光密度值降低,Nrf2阳性蛋白平均光密度值升高,差异均有统计学意义(P<0.05,见表1)。
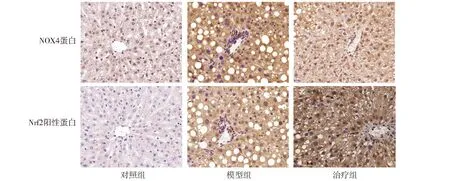
图2 三组大鼠第8周肝组织NOX4和Nrf2阳性蛋白苏木精染色结果 (×400)Figure 2 NOX4 and Nrf2 positive proteins in liver tissues at the 8th week in the three groups by HE staining (×400)

表1 各组大鼠肝组织NOX4和Nrf2阳性蛋白的平均光密度值比较Table 1 Comparison of mean optical density values of NOX4 and Nrf2 positive proteins in liver tissues of rats in each
3 讨论
肝纤维化是包括病毒、酒精、免疫等多种致病因素导致的肝内结缔组织异常增生的病理性过程,以细胞外基质(extracellular matrix,ECM)过多沉积为特征。氧化应激指机体内氧化和抗氧化系统失衡,偏向于氧化,导致以中性粒细胞为代表的炎症细胞浸润,大量的氧化产物堆积并损伤机体。越来越多的证据表明,氧化应激机制参与了肝纤维化的发生发展[8-11]。活性氧簇ROS是氧化损伤过程中产生的活性代谢产物,其产生和清除能力的不平衡导致了氧化应激的产生。生理条件下,ROS在机体内少量存在,发挥信号转导、调节细胞周期、抵御有害微生物的作用[12]。病理条件下,即发生氧化因素损伤时,机体产生大量ROS,导致氧化应激发生,损伤机体微环境[13]。ROS作为氧化敏感蛋白,可以激活氧化和抗氧化系统的分子表达,进一步调节肝纤维化[8]。血管紧张素Ⅱ作为RAS系统的核心促纤维化因子,可以通过多条信号通路介导ROS产生,参与肝纤维化的发生发展。
还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)是机体内氧化系统的一个多蛋白复合体,是目前已知的唯一一种专职产生ROS的酶类[1],NOX4是其中一种,其在肝枯否细胞(Kupffer cells,KCs)和肝星状细胞(hepatic stellate cells,HSCs)中高度表达。当机体受到氧化刺激损伤时,NOX4的调节亚基发生磷酸化,易位至细胞膜,激活下游氧化信号的转导,促使ROS的产生,介导氧化应激损伤。
在肝硬化患者的血清中,NOX4蛋白表达水平升高,但在敲除了NOX4基因的肝纤维化小鼠模型中,肝脏的炎症程度、氧化应激水平及肝纤维化的程度均有明显下降[2]。在小鼠原代肝细胞和一种人肝细胞系中,血管紧张素Ⅱ的活化增加了NOX4蛋白的表达量以及由H2O2活化介导的上皮间质转化[14]。在本实验中,与对照组相比,模型组大鼠肝细胞中NOX4平均光密度值升高,给予贝那普利治疗后,NOX4平均光密度值降低,因此我们猜测贝那普利可以通过抑制血管紧张素Ⅰ转换为血管紧张素Ⅱ,抑制NOX4的活化,减少ROS的产生,减轻肝纤维化。
核因子E2相关因子2(Nrf2)是抗氧化反应元件(ARE)介导的基因表达的中心调控因子[15],由红细胞衍生核因子2样蛋白2(NFE2L2)编码,属于碱性亮氨酸转录因子家族。Nrf2可以调节许多基因的表达,编码抗氧化酶、解读因子、抗凋亡蛋白和药物转运体[16]。生理状态下,大部分Nrf2与细胞质锚连分子Kelch样ECH关联蛋白1(KEAP1)结合而被蛋白酶降解,只有少部分用于维持还原型谷胱甘肽(GSH)的基础表达。Nrf2在所有类型的细胞中均有表达,正常情况下,其基础蛋白水平通常较低,这主要是由于KEAP1介导的蛋白酶体降解作用[17]。氧化应激条件下,Nrf2 基因被激活,与磷酸化的KEAP1解离,激活下游的抗氧化基因。Nrf2可以调节GSH的氧化还原状态,保护细胞免受氧化应激损伤,Nrf2的基因或药理激活可以抑制急性炎症性肝损伤[18]。Nrf2可以直接抑制促炎细胞因子的产生或抑制NF-κB的活性来抑制炎症[19]。另有研究表明,经基因或药理激活的Nrf2可以保护肝脏免受多种氧化应激诱导的损伤[20,21]。对人类肝脏切片的免疫组化分析显示慢性肝脏病患者Nrf2高表达[22]。因此人们认为Nrf2可以发挥抗氧化应激作用,使机体保持氧化还原稳态。本实验中,肝纤维化模型组Nrf2在细胞浆中的平均光密度值较对照组升高,治疗组较模型组进一步升高。因此我们推测,贝那普利可以通过升高Nrf2表达量来抑制氧化应激损伤。
综上所述,氧化应激条件下,NOX4和Nrf2均参与了肝纤维化的过程,我们推测,血管紧张素转换酶抑制剂贝那普利可以抑制NOX4的产生和促进Nrf2的产生,发挥抑制肝纤维化的作用,但其长期效用仍有待继续研究。

