七氟烷后处理对心肌缺血再灌注大鼠认知及海马炎症反应的影响
赵雪丽,杨文曲,韩冲芳*,常 鑫,陈 焱
(1 山西医科大学麻醉学院麻醉教研室,太原 030001;2 山西白求恩医院麻醉科;*通讯作者,E-mail:hanchongfang2003@foxmail.com)
心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)是心脏手术常见的病理生理过程,会诱发神经炎症反应导致术后认知功能障碍(postoperative cognitive dysfunction,POCD)[1]。海马是学习和记忆等认知功能的关键脑区,海马神经元发生炎症反应、凋亡与POCD的发生密切相关[2,3]。七氟烷的器官保护作用一直引起广泛关注,动物实验与临床研究发现七氟烷后处理具有心肌保护作用[4,5],因此临床上常用七氟烷后处理进行心肌保护。另有研究发现七氟烷后处理有抗炎和神经元保护作用[6,7],但其是否能改善心肌缺血再灌注损伤诱发的认知功能障碍鲜有报道。本研究拟探讨七氟烷后处理对心肌缺血再灌注大鼠认知及海马炎症反应的影响。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠36只,2~3月龄,体质量200~250 g,由山西医科大学实验动物中心提供,实验动物许可证号:SCXK(晋)2015-0001,本实验严格遵守国家动物福利伦理及保护规定。
1.2 仪器与试剂
动物呼吸机(上海奥尔特生物科技有限公司);多功能监护仪(成都泰盟科技有限公司);cTnI ELISA试剂盒(武汉博士德生物技术有限公司);七氟烷(上海恒瑞医药股份有限公司);TUNEL试剂盒(北京碧云天科技有限公司);IL-1β、IL-6、TNF-αELISA试剂盒(武汉云克隆科技股份有限公司);BCA蛋白定量试剂盒(北京碧云天科技有限公司);兔抗鼠GAPDH多克隆抗体、兔抗鼠IL-1β多克隆抗体、兔抗鼠IL-6多克隆抗体、兔抗鼠TNF-α多克隆抗体、HRP标记的羊抗兔IgG抗体(Proteintech公司)。
1.3 动物分组及模型建立
所有大鼠在通风良好的动物室内适应性饲养1周,维持温度(23 ±3)℃,相对湿度为40%~70%,并给与充足的水与食物。采用随机数字表法将36只大鼠分为3组(n=12):假手术组(sham组)、心肌缺血再灌注组(myocardial ischemia-reperfusion,MI/R组)、七氟烷后处理+心肌缺血再灌注组(SP组)。大鼠实验前禁食12 h,自由饮水。参照文献[4]制备心肌缺血再灌注大鼠模型,大鼠腹腔注射戊巴比妥钠40 mg/kg进行麻醉,待大鼠翻正反射消失,将大鼠取仰卧位固定于实验台上,用14G套管经口进行气管插管,连接动物呼吸机进行机械通气,潮气量2.5 ml/100 g,频率为60次/min,连接多功能监护仪进行心电监护,钝性分离股动脉,置入测压管监测血压。沿大鼠左侧4~5肋间进胸,暴露心脏,用6-0丝线在左心耳下方(左心耳与肺动脉圆锥间)结扎左冠脉前降支,收紧结扎线后心电图显示ST-T段抬高,T波高耸且结扎线远端心肌组织出现发绀,标志结扎成功。缺血30 min后放松结扎线,抬高的ST-T段降低1/2以上,缺血的心肌逐渐变红,标志心肌再灌注成功,再灌注120 min后,将大鼠胸部伤口缝合,等大鼠清醒后放回笼中继续饲养。sham组大鼠对左冠脉前降支仅穿线而不进行结扎;SP组大鼠参照文献[4]于再灌注前10 min时开始吸入2.4%的七氟烷,持续15 min。建模完成后在原有分组下对大鼠进行以下的后续实验操作。
1.4 ELISA法检测血清cTnI浓度
再灌注120 min时从大鼠股动脉采血2 ml,静置5 min,转速3 500 r/min,离心5 min后取上清液,按照使用说明,用ELISA试剂盒检测血清cTnI浓度。
1.5 Morris水迷宫评价大鼠的认知功能
再灌注后第1~5天采用Morris水迷宫实验评价大鼠认知功能。①再灌注后第1~4天进行定向航行实验:每次实验前先将大鼠放在平台上适应30 s,然后将大鼠从不同象限面向池壁放入水池,以入水起至找到平台的时间为潜伏期,记录潜伏期,如果在60 s内大鼠未找到平台,则引导其至平台上适应15 s,潜伏期记为60 s,每天3次,取平均值作为当天测试结果。②空间探索实验:再灌注后第5天将平台撤去,随机选一象限将大鼠面向池壁放入水池,记录60 s内大鼠在原平台象限停留时间以及穿越原平台次数。
1.6 TUNEL染色检测神经元凋亡程度
空间探索实验结束后,迅速将大鼠断头处死,分离出双侧海马组织。取出的海马组织一部分用于ELISA检测,一部分用于制备脑组织切片,另一部分用于Western blot检测。将海马组织用4%的多聚甲醛溶液固定24 h后进行石蜡包埋,制成3 μm厚的切片,将切片脱蜡与水化后,滴加适量蛋白酶K,室温孵育20 min,PBS洗涤5 min×3次,滴加3%过氧化氢,室温孵育10 min,PBS洗涤5 min×3次,滴加100 μl通透液,室温孵育5 min,PBS洗涤5 min×3次,滴加TUNEL工作液避光孵育30 min,PBS洗涤10 min×3次,滴加50 μl转化剂-POD,避光孵育30 min,PBS洗涤5 min×3次,滴加DAB显色液,显色5 min,用蒸馏水冲洗玻片终止反应,于高倍镜下观察海马神经元细胞的凋亡情况,随机选择5个互相不重叠的视野,计数凋亡细胞数和总细胞数,并计算凋亡指数,凋亡指数(%)=凋亡细胞数÷总细胞数×100%。
1.7 ELISA法测定海马组织中IL-1β、IL-6、TNF-α的水平
参照文献[8]的方法将海马组织制备成匀浆,转速3 000 r/min,离心15 min后取上清液,严格按照使用说明,用ELISA试剂盒检测海马组织中IL-1β、IL-6、TNF-α的含量。
1.8 Western blot检测大鼠海马组织IL-1β、IL-6、TNF-α蛋白表达量
取海马组织加适量细胞裂解液,置于冰上反应15 min,离心后取上清液,用BCA法测定蛋白浓度。加入上样缓冲液沸水煮10 min。上样,电泳分离蛋白,转移到PVDF膜,脱脂牛奶室温下封闭60 min,加一抗(IL-1β、IL-6、TNF-α抗体稀释度为1 ∶1 000,GAPDH抗体稀释度为1 ∶20 000),4 ℃孵育过夜,PBST清洗5 min×3次,加二抗(HRP标记的羊抗兔IgG抗体稀释度为1 ∶5 000),室温孵育60 min,PBST清洗5 min×3次,用发光液显色,曝光、显影、定影,Image J软件分析灰度值,计算目标蛋白表达量。
1.9 统计学处理

2 结果
2.1 大鼠血清cTnI浓度比较
与sham组相比,MI/R组和SP组大鼠血清cTnI浓度升高,差异有统计学意义(P<0.05);与MI/R组相比,SP组大鼠血清cTnI浓度降低,差异有统计学意义(P<0.05,见图1)。
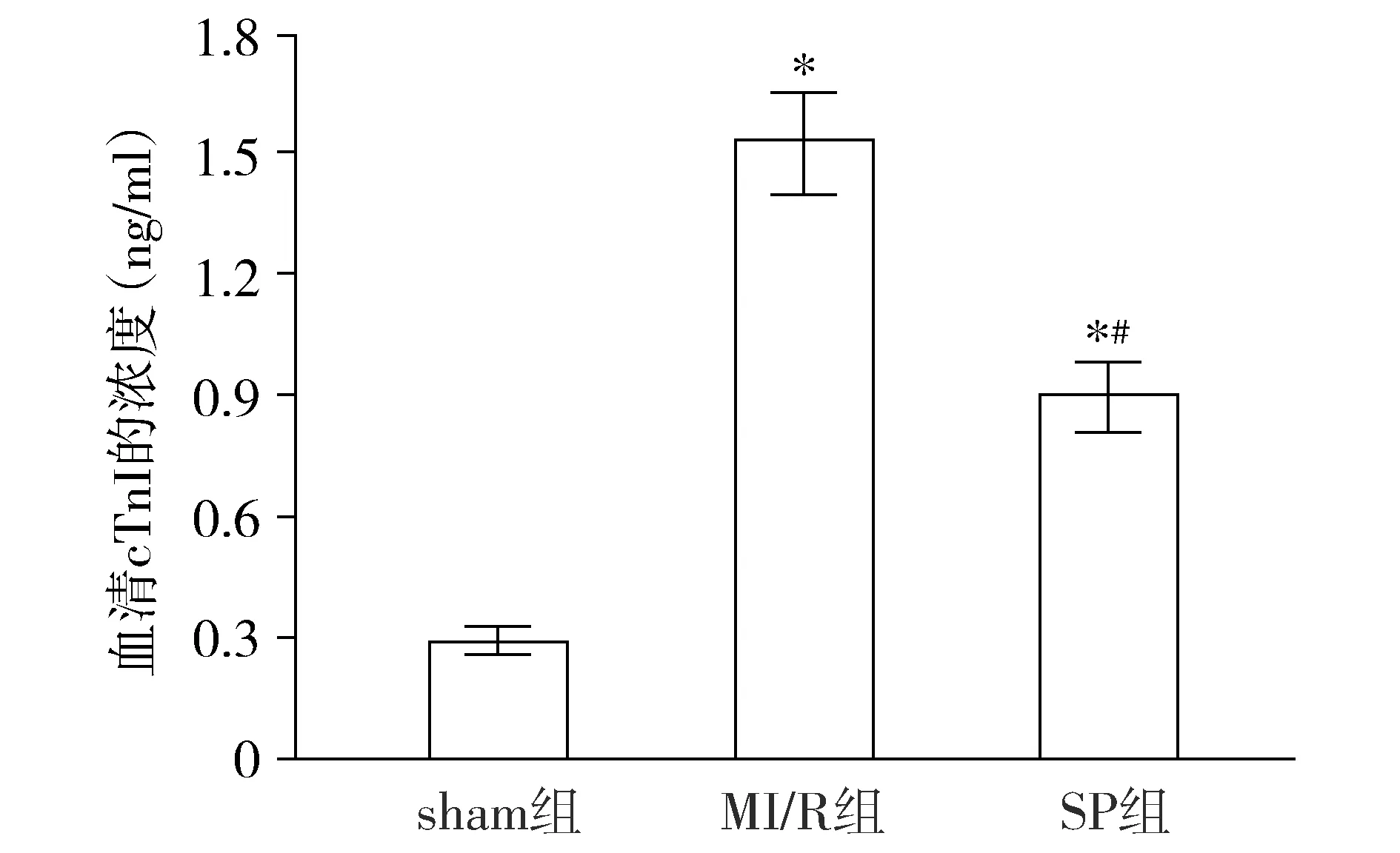
与sham组相比,* P <0.05;与MI/R组相比,#P <0.05图1 各组大鼠血清cTnI浓度的比较Figure 1 Comparison of serum cTnI concentration between groups
2.2 大鼠逃避潜伏期的比较
与sham组相比,MI/R组和SP组大鼠各时间点逃避潜伏期延长,差异有统计学意义(P<0.05);与MI/R组相比,SP组大鼠各时间点逃避潜伏期都缩短,差异有统计学意义(P<0.05,见图2)。
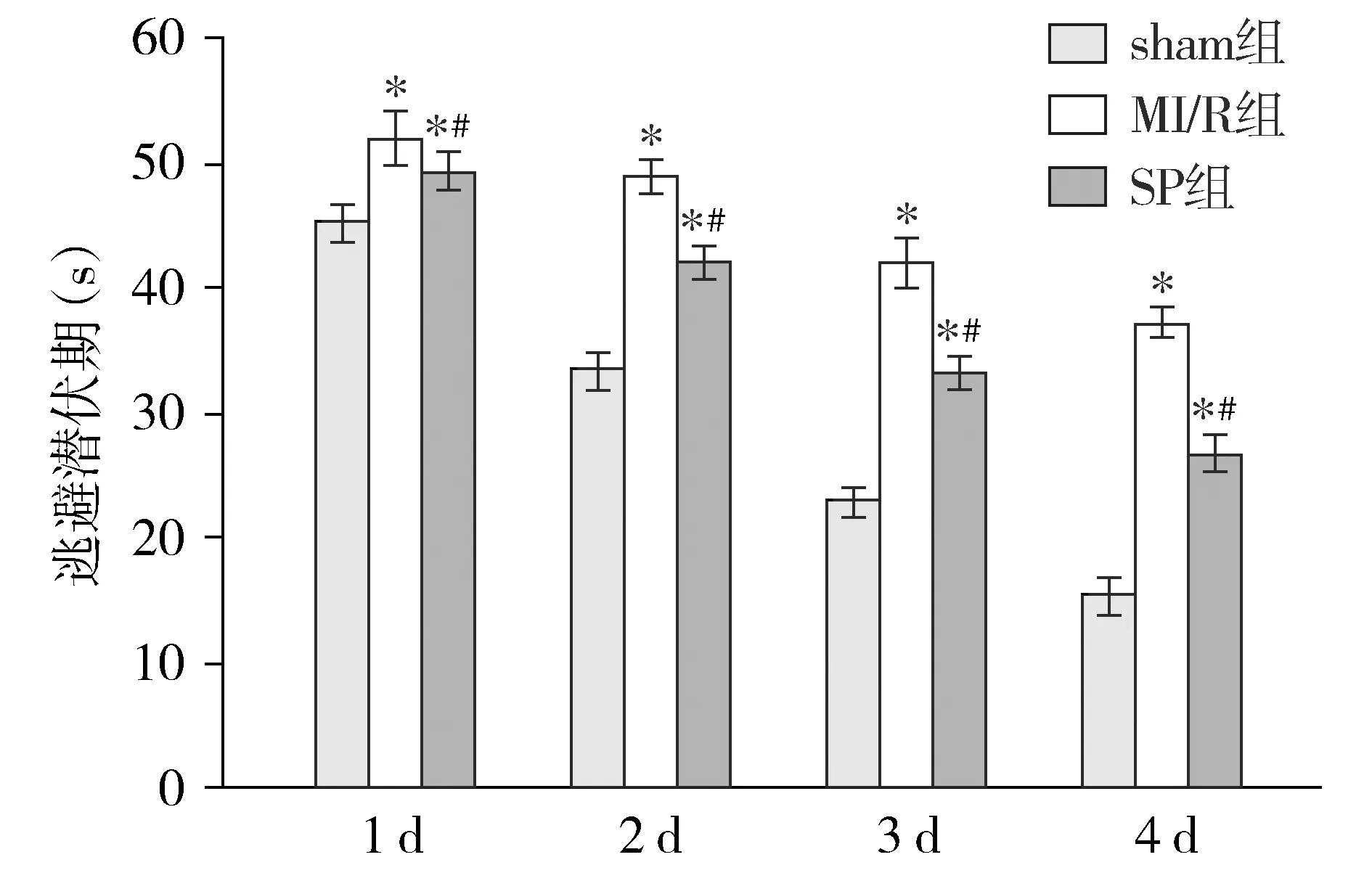
与sham组相比,* P <0.05;与MI/R组相比,#P <0.05图2 各组大鼠逃避潜伏期的比较Figure 2 Comparison of escape latency of rats between groups
2.3 大鼠原平台象限停留时间和穿过原平台次数比较
与sham组相比,MI/R组和SP组大鼠原平台象限停留时间缩短,穿过原平台次数减少,差异均有统计学意义(P<0.05);与MI/R组相比,SP组大鼠原平台象限停留时间延长,穿过原平台次数增多,差异均有统计学意义(P<0.05,见表1)。
表1 各组大鼠原平台象限停留时间和穿过原平台次数的比较Table 1 Comparison of quadrant stay time and times of crossing the original platform between
2.4 大鼠海马神经元凋亡程度比较
sham组大鼠海马区仅有个别凋亡细胞,MI/R组大鼠海马区可见大量凋亡细胞,SP组大鼠海马区有少量凋亡细胞(见图3)。与sham组相比,MI/R组和SP组大鼠海马神经元凋亡指数升高(P<0.05);与MI/R组相比,SP组大鼠海马神经元凋亡指数下降(P<0.05,见表2)。
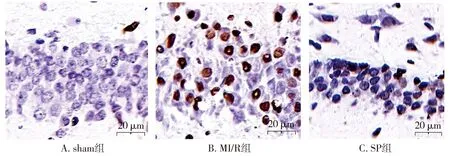
图3 大鼠海马组织TUNEL染色 (×400)Figure 3 TUNEL staining of the hippocampus in rats (×400)
表2 各组大鼠海马神经元凋亡指数的比较Table 2 Comparison of hippocampal neuron apoptosis index between
2.5 大鼠海马组织中IL-1β、IL-6、TNF-α含量比较
与sham组相比,MI/R组和SP组大鼠海马组织中IL-1β、IL-6、TNF-α含量升高(P<0.05);与MI/R组相比,SP组大鼠IL-1β、IL-6、TNF-α含量下降(P<0.05,见图4)。
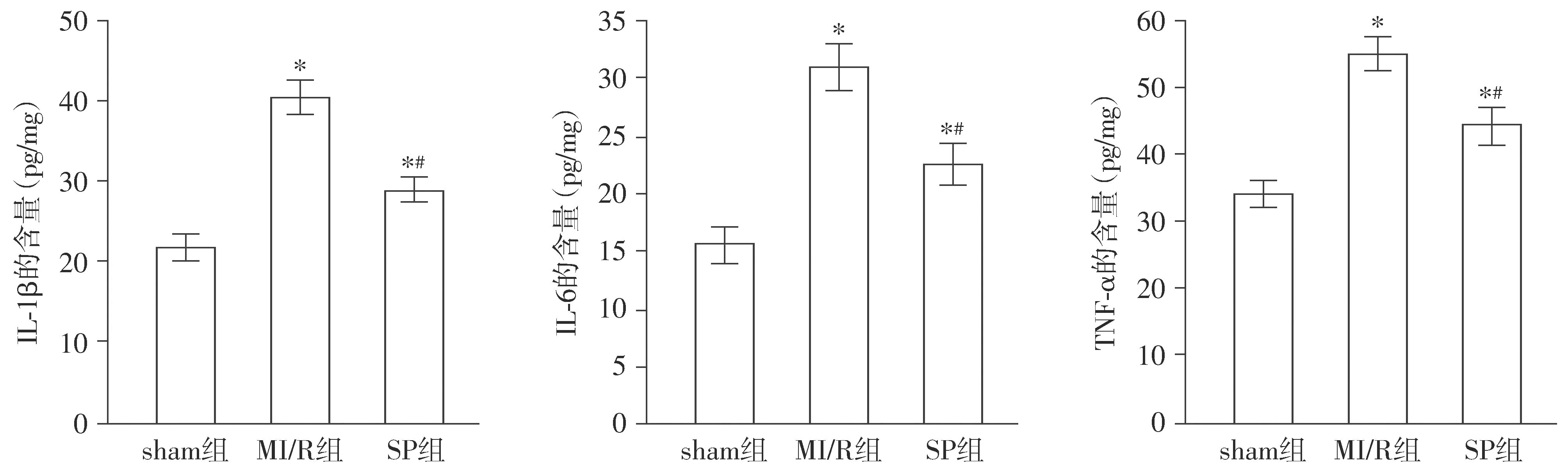
与sham组相比,* P <0.05;与MI/R组相比,#P <0.05图4 各组大鼠海马组织中IL-1β、IL-6、TNF-α含量的比较Figure 4 Comparison of the contents of IL-1β,IL-6 and TNF-αin hippocampus of rats in each group
2.6 大鼠海马组织中IL-1β、IL-6、TNF-α蛋白表达量比较
与sham组相比,MI/R组和SP组大鼠海马组织中IL-1β、IL-6、TNF-α蛋白表达量升高(P<0.05);与MI/R组相比,SP组大鼠海马组织中IL-1β、IL-6、TNF-α蛋白表达量下降(P<0.05,见图5)。
3 讨论
POCD是术后常见的中枢神经系统并发症,严重影响患者康复,延长住院时间,加重了医疗护理和社会经济负担,POCD的防治成为当前研究热点之一[1]。有研究表明七氟烷后处理抗炎和神经元保护作用[6,7],本研究通过建立心肌缺血再灌注模型,探究七氟烷后处理能否改善MIRI诱发的认知功能障碍,为POCD的防治提供新思路。
结扎左冠脉前降支是制备心肌缺血再灌注模型的经典方法,本研究参照文献[4]结扎左冠脉前降支30 min,再灌注120 min制备心肌缺血再灌注大鼠模型。cTnI存在于心肌细胞中,当心肌细胞受损时会穿透细胞膜释放入血,是判断心肌损伤的特异性标志物[9],研究结果显示,心肌缺血再灌注处理后,大鼠血清cTnI水平升高,证实大鼠出现心肌损伤;本课题组前期研究发现七氟烷后处理具有心肌保护作用,本研究显示七氟烷后处理使大鼠血清cTnI水平降低,与前期实验结果一致[4]。
Morris水迷宫是一种评估啮齿类动物认知功能的经典测试[10,11],本研究参照文献[12]进行定向航行实验和空间探索实验评价大鼠的记忆和空间学习能力。结果显示,心肌缺血再灌注处理后,大鼠逃避潜伏期延长,原平台象限停留时间缩短,穿越原平台次数减少,表明心肌缺血再灌注损伤会导致大鼠认知功能障碍,与Evonuk等[1]的结果一致;七氟烷干预后大鼠逃避潜伏期缩短,原平台象限停留时间延长,穿越原平台次数增多,提示七氟烷后处理可以改善心肌缺血再灌注大鼠的认知功能。
海马神经元在学习和记忆功能中发挥重要作用,海马神经元凋亡与认知功能障碍的发病机制直接相关[13]。本研究结果显示,心肌缺血再灌注导致大鼠海马区凋亡细胞增多,提示心肌缺血再灌注损伤引起的认知功能障碍与海马神经元凋亡增加有关;给予七氟烷后处理大鼠海马区凋亡细胞减少,提示七氟烷后处理可以通过抑制海马神经元凋亡改善心肌缺血再灌注大鼠的认知功能。
神经炎症已被确定为POCD发生和发展的重要环节[14]。缺血的心肌恢复灌注会引起炎症反应,释放大量的炎性介质,如IL-1β、IL-6、TNF-α等,这些炎性因子在造成心肌细胞损伤的同时,还可以破坏血脑屏障进入中枢,激活中枢免疫系统,活化胶质细胞,释放炎性因子,诱发神经炎症[15-17]。IL-1β、IL-6、TNF-α是神经炎症反应中的重要的促炎因子,这些炎症因子不仅能促进大量的炎性介质释放,还能与神经元膜上的受体结合,导致神经元凋亡,造成脑组织损伤和认知功能障碍[18-21]。本研究中,心肌缺血再灌注大鼠海马组织IL-1β、IL-6、TNF-α的含量及蛋白表达水平升高,提示心肌缺血再灌注损伤导致的认知功能与神经炎症反应有关,与Yuan等[17]的观点一致。七氟烷后处理使大鼠海马组织IL-1β、IL-6、TNF-α的含量及蛋白表达水平下调,提示七氟烷后处理可以通过抑制神经炎症反应改善心肌缺血再灌注大鼠的认知功能。
综上所述,七氟烷后处理可以改善心肌缺血再灌注大鼠的认知功能,与其抑制神经炎症反应,减少神经元凋亡有关。本实验的不足之处是未能阐明七氟烷后处理抑制神经炎症反应的具体机制,有待进一步探究。

