AIDS合并弓形虫脑病一例影像学分析*
余筱瑶 宋璐 余晓 徐海波
武汉大学中南医院放射科 (湖北 武汉 430071)
弓形虫脑病(toxoplasma encephalopathy)是一种全球范围内流行的人畜共患病,在健康人群中弓形虫多为隐形感染,难引起明显临床症状,但在免疫低下人群,尤其是获得性免疫缺陷综合征(AIDS)患者中,可使隐形感染的弓形虫活化引起急性症状。本研究回顾性分析1例母婴传播艾滋病合并感染弓形虫脑病的青少年患者的诊治过程及相关影像学特征分析,旨在增加临床医生对该病的治疗及预后评估的认知。
1 临床资料

图1 AIDS合并感染弓形虫脑病,高热伴癫痫发作。图1A:MRI T1WI平扫轴位,病灶呈低T1信号。图1B:MRI T2-FLAIR平扫轴位,累及双侧额叶、顶叶、颞叶灰白质交界区及右侧小脑半球的颅内多发占位性病变,病灶呈T2-Flair稍高信号。图C:MRI T1WI增强轴位,增强后病灶呈不均匀结节样、环形强化。
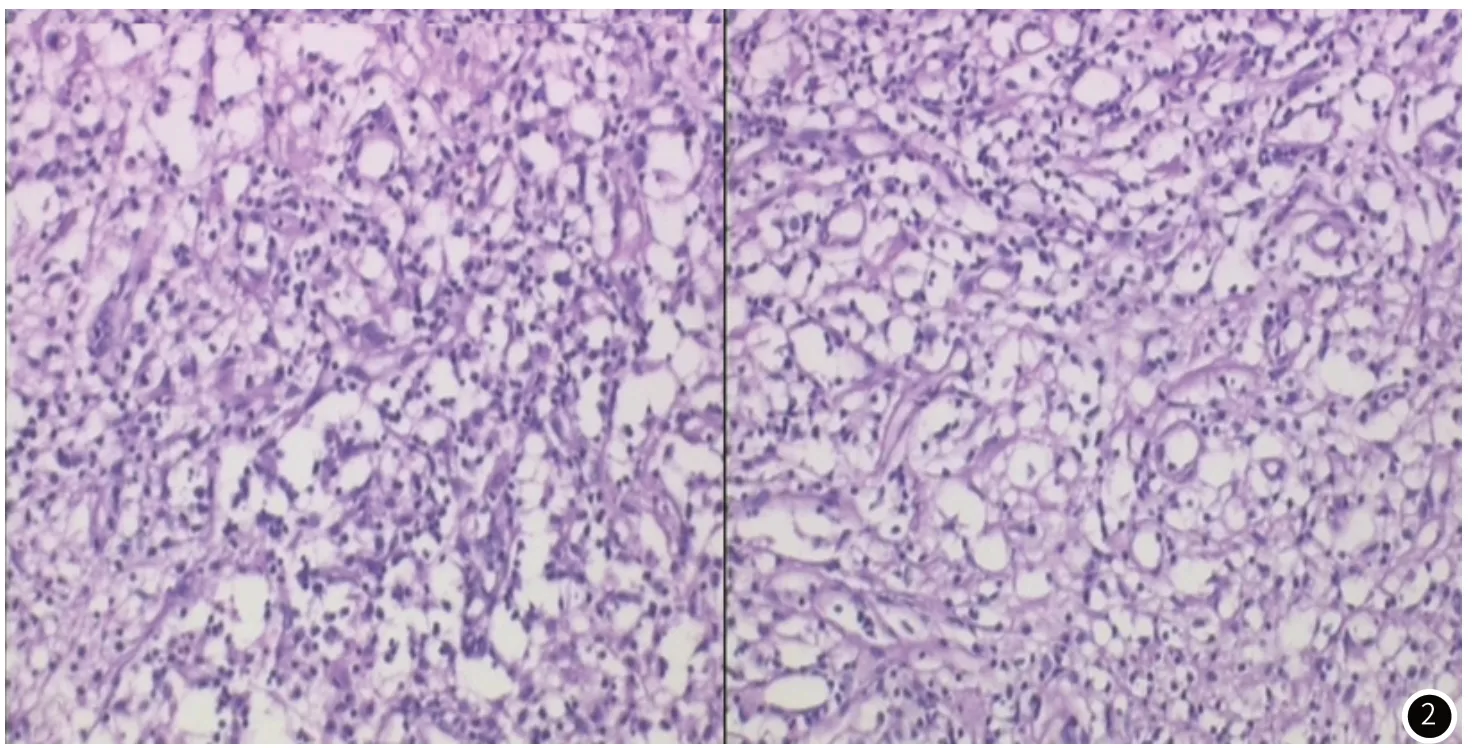
图2 PAS染色,泡沫样细胞内紧凑排列红染小颗粒,周围血管组织增生,小胶质细胞增生,淋巴细胞浸润。
患者,女,15岁,因“间断咳嗽1年,加重1月”就诊。患者于1年前开始间断咳嗽,咳黄绿色痰,近1月加重,无发热头痛等不适,查体左颌下可触及数枚肿大淋巴结。十余年前患者母亲确诊AIDS,患者随后体检发现HIV感染,并最终诊断为母婴传播的AIDS,当即进行抗HIV治疗(AZT/3TC/NVP)至今。入院抗感染治疗后10d突发高热畏寒伴全身肌肉酸痛,3d后癫痫发作。实验室检查提示血小板:251×109/L,血红蛋白:127.1G/L,红细胞:3.27×1012/L↓,白细胞:3.27×109/L↓,中性粒细胞百分比:37.8%↓;TORCH IgG/IgM:巨细胞病毒IgG:193.5AU/mL↑,弓形虫IgG:49.1IU/mL↑;艾滋病抗体252.95s/co↑,梅毒螺旋体抗体:16.83s/co↑,脑脊液糖定性阳性,蛋白定性阴性,脑脊液生化:氯(Cl-) 128.4mmol/L,脑脊液糖(GLU) 3.90mmol/L,乳酸脱氢酶(LDH)175U/L↑,蛋白(Pr):0.30g/L,脑脊液染色未检出细菌。
颅脑MRI提示脑部多发病灶,位于双侧额叶、顶叶、颞叶灰白质交界区及右侧小脑半球,呈T1低信号T2高信号T2抑脂高信号,周围伴有斑片样水肿灶。增强扫描,病灶呈不均匀结节样、环形强化,影像诊断考虑为颅内感染性病变。
临床上选择给予复方磺胺甲恶唑进行抗弓形体治疗。另针对该患者合并的艾滋病、梅毒进行相关的抗HIV(克力芝、替诺福伟、拉米夫定)、抗梅毒(苄星青霉素)治疗。与治疗前(图3所示)对比,治疗后1月、4月、6月后(图4-6所示)复查提示,颅内病灶较前明显减少,部分缩小,强化较前减弱。
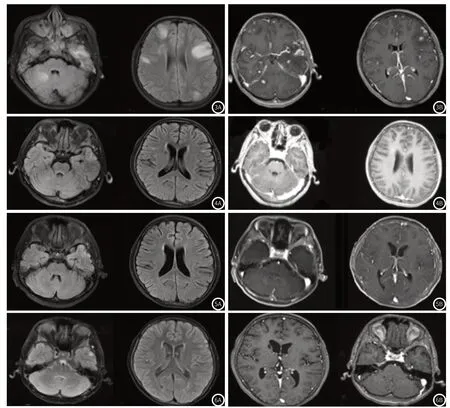
图3 AIDS合并感染弓形虫脑病治疗前;图3A:颅脑MRI T2-FLAIR平扫轴位;图3B:颅脑T1WI增强轴位。颅内多发病灶,累及双侧额颞顶叶及右侧小脑半球,呈不均匀结节样、环形强化。图4 AIDS合并感染弓形虫脑病治疗1月后;图4A:颅脑MRI T2-FLAIR平扫轴位;图4B:颅脑T1WI增强轴位。颅内病灶数量明显减少,异常强化灶较前减少;颅内水肿灶较前明显吸收。图5 AIDS合并感染弓形虫脑病治疗4月后;图5A:颅脑MRI T2-FLAIR平扫轴位;图5B:颅脑T1WI增强轴位。双侧额颞叶及右侧小脑半球病灶较前进一步吸收,左侧颞叶残余小片状稍高T2-FLAIR信号灶,余未见明显异常信号及异常强化灶。图6 AIDS合并感染弓形虫脑病治疗6月后;图6A:颅脑MRI T2-FLAIR平扫轴位;图6B:颅脑T1WI增强轴位。左侧颞叶高T2-FLAIR信号灶较前明显,未见明显强化。
脑部病灶活检术后病理检查:送检小块脑组织内见血管组织明显增生,小胶质细胞反应性增生伴淋巴细胞浸润,局部脑组织变性坏死。免疫组化染色提示:GFAP(+)、S100(+)、LCA(+)、CD31(+)、CD34(+)、D2-40(-)。PAS染色:泡沫样细胞内见小颗粒样红染物。病理诊断考虑为弓形虫感染。
2 讨论
2.1 弓形虫脑病的定义和病理机制弓形虫于100多年前被人们发现,普遍被认定是一种专性细胞内寄生虫,为广泛人畜共患病的病原体。有报道称世界人口对该病的感染率为25%~30%,但据调查显示,各国乃至各地区的患病率差异很大(10%~80%)[1-2]。在健康人群中,弓形虫在初次感染激活体内免疫应答反应后,大部分的虫体可被有效杀灭,而残余的少量虫体及卵囊可在体内潜伏,形成持续性隐形感染。其中,又由于弓形虫的嗜中枢神经系统的亲和性及血脑屏障对抗体的阻拦,使得血供丰富的脑组织成为虫体最易潜伏的部位之一[3]。当隐形感染的患者因各种原因导致的集体免疫力功能下降(如该案例的获得性免疫缺陷综合征),可诱发包囊破裂,其内抗原释放并大量增殖,引发局灶性的抗原抗体反应,多表现为细胞水肿及毛细血管周围炎症,虫体亦可继续侵入其他细胞,引起反复的脑组织损害,继而导致一系列中枢神经系统症状[3-4]。这就是AIDS合并感染弓形虫脑病发生的过程。
2.2 弓形虫脑病的临床表现分析除发热、畏寒等全身症状外,弓形虫脑病引起的中枢神经系统的损害主要为脑实质损害及脑占位效应。先天性的弓形虫脑病主要临床表现为智能低下、小头畸形以及脑积水等[5];获得性的弓形虫脑病主要临床表现为头痛、运动性癫痫发作及肢体障碍等[6]。
2.3 弓形虫脑病的影像表现分析颅脑MRI是诊断弓形虫脑病的重要手段,平扫表现为单发或多发的长T1WI、长T2WI信号颅内占位性病变,好发于大脑表面及灰白质交界区,病灶周围伴有明显水肿征象,增强多呈不均匀结节样或环形强化。若强化图像中发现“偏心性靶征”(即病灶外层为明显强化的环形边缘,中间层为弱强化的低信号灶,其内另可见偏心的明显强化的点状高信号中心),可为弓形虫脑病提供重要的的诊断依据[7-8]。
AIDS患者易合并多种颅内机会性感染,当血脑屏障破坏,加上反应性血管扩张、充血,病灶将会出现环形强化,本病需与该类疾病的影像表现进行鉴别诊断,包括脑结核、神经梅毒、细菌性脑脓肿等。脑结核多表现为簇状分布的粟粒状肉芽肿结节,当融合形成较大病变破溃入蛛网膜下腔时可诱发结核性脑膜炎,影像上表现为颅底环池、外侧裂池脑膜增厚并明显强化;神经梅毒形成的梅毒性肉芽肿可呈环形强化或分叶花环样强化,周围水肿不明显,表现为“大病变小水肿”的特点[9];细菌性脑脓肿病灶内弥散明显受限,在扩散加权成像(DWI)序列上呈明显高信号,脓肿灶内壁光滑,若局部囊壁较薄,可破溃形成脓肿子灶,二者相连,呈“子母”征[10];隐球菌脑病好发于基底节区,周围水肿不明显,在扩散加权成像(DWI)序列一般没有弥散受限表现。
2.4 弓形虫脑病的实验室检查弓形虫脑病多侵犯脑实质,较少侵犯脑膜,脑脊液生化表现理论上无特异性,但抗酸染色及墨汁染色有助于鉴别结核性、细菌性脑病。弓形虫脑病好发于CD4+T细胞计数低的患者,有研究显示77%弓形虫脑病患者的CD4+T细胞计数≤100个/μL。弓形虫IgG与IgM抗体检测可为诊断提供重要依据,但普遍阳性率低,其中IgG阳性检出率高于IgM,ELISA检测法阳性检出率高于快速金标法[11]。
2.5 弓形虫脑病的诊疗体会回顾本例的诊疗经过,患者既往诊断为HIV阳性,此次因间断咳嗽急性加重就诊,在治疗肺炎的过程中,突发急性感染症状(高热畏寒)及中枢神经系统症状(癫痫)。MRI上病灶位置典型,多发于脑灰白质交界区,形态较小,呈不均匀结节样、环形强化,周围水肿明显,虽未见明显“偏心性靶”征,但本案例影像表现基本符合弓形虫脑病的特征,实验室检查中脑脊液染色未检出细菌,弓形虫IgM抗体检测表现为阳性,进一步佐证了弓形虫感染。高度怀疑弓形虫脑病后临床对患者进行了脑组织活检术,术后病理确诊为弓形虫感染。本病例患者使用复方磺胺甲恶唑进行抗弓形体治疗,辅助给予抗HIV、抗梅毒等对合并症治疗,患者治疗后1月、4月、6月随访影像资料提示病灶较前明显减少,与临床表现相互印证。但治疗后4月、6月MRI图像上均提示有少数病灶残留,并隐约可见FLAIR信号的增高,仍需警惕复发可能。依据最新版艾滋病诊疗指南,对于AIDS合并弓形虫感染患者,首选乙胺嘧啶,其次建议方案为甲氧苄啶-磺胺甲恶唑联合阿奇霉素或克林霉素[12],并有报道称联合用药的方案治疗及预后效果要明显优于单独用药[7]。国内乙胺嘧啶药物未普及应用,多使用复发磺胺甲恶唑进行替代治疗。当原有治疗方案的成效及预后不如预期时,临床医生应及时调整用药方式。患者治疗后还需要做好二级预防措施防止复发,常规隔离家畜、家禽及可疑感染动物,对于AIDS患者如有必要需定期监测其CD4+T细胞计数值,并可给予复发磺胺甲恶唑进行预防性用药[13]。
综上所述,本文介绍了一例母婴传播艾滋病合并感染弓形虫脑病患者的诊治过程及影像学分析,并根据其影像学表现结合临床症状、实验室检查对病变进行详细解读,有助于临床医生加深对艾滋病合并弓形虫脑病的认识,提高诊断率。

