二氧化钛对Cu2+的吸附研究
吴莉莉 曹洪印
(南京科技职业学院,江苏 南京 210048)
重金属离子对环境体系的生物毒性及接收水域的其它不利影响,使重金属离子的污染问题受到人们的日益关注[1]。为了减少重金属离子对环境的危害,在其释放到水环境体系之前需要将其从废水中去除。去除废水中重金属离子的方法有多种,比如:共沉淀法、电化学法、氧化还原法、离子交换法、吸附法等。在这些处理方法中吸附法是最经济、最简单和应用最广泛的方法。Cu2+是生物生长必备的元素之一,微量Cu2+元素可以促进生物的生长。但是,过量的Cu2+则会导致生物毒性,对环境产生污染[2]。
腐殖酸是水环境体系中广泛存在的一种天然有机大分子,其表面含有大量的羧基、酚羟基、羰基及含氧基团,使其能和金属离子发生络合反应,因此对水环境体系中的金属离子的迁移、富集等行为存在较大的影响。因此,研究腐殖酸和矿物材料共存体系对金属离子环境行为的影响具有重要的作用[3]。
TiO2难溶于水及其接近中性的零点电荷的特性,使其可以在较宽的pH及离子强度范围内吸附金属离子,因此成为一种典型的金属离子吸附剂。TiO2对金属离子的吸附相关研究已经较多,但TiO2对重金属离子吸附的相关研究还鲜有报道,尤其是在腐殖酸存在的多元体系的相关研究更少[4]。
1 实验部分
1.1 实验材料
TiO2、腐殖酸、硝酸铜等样品均购自阿拉丁化学试剂有限公司,所有试剂如不特殊说明均为分析纯。
1.2 实验条件及过程
除了温度对吸附过程的影响实验分别在T=293.15、313.15和333.15 K条件下进行,其他实验均在T=293.15 K的室温下进行。实验中用微量的NaOH和HNO3对体系pH值进行调节。实验体系中的离子强度则通过不同浓度的NaNO3进行调节。
实验数据通过Langmuir和Freundlich模型进行模拟,两种模型如下所示。
Langmuir模型:
(1)
Freundlich模型:
lgq=lgkF+nlgCe
(2)
式中Ceq(mol/L)为平衡浓度,q(mol/g)为单位质量吸附剂对金属离子的吸附量,qmax和b为Langmuir模型相关系数。kF和n为Freundlich模型相关系数[5]。
2 结果与讨论
2.1 吸附动力学研究
在pH=4.8,T=298.15 K,吸附剂浓度为0.5 g/L,离子强度为0.001 M NaNO3,Cu2+初始浓度10 mg/L反应体系中,接触时间对吸附过程的影响如图1所示。其中吸附率由公式(3)计算而得。

(3)
式中Co(mg/L)为Cu2+初始浓度,Ce(mg/L)为Cu2+平衡浓度。
从图1可知,TiO2对Cu2+的吸附是一个较快的过程,4 h即可达到平衡。较快的吸附速率说明Cu2+在TiO2上的吸附过程为化学吸附,而不是物理吸附。因此在后续的实验中,选择4 h作为吸附的平衡时间。为了研究Cu2+在TiO2表面的吸附动力学过程,选择假二级速率方程对实验数据进行模拟:
(4)
式中qt是时间t(h)时TiO2对Cu2+的吸附量,qe则是平衡状态时的吸附量,k2(g·mol-1·h-1)为伪二级速率常数。将相关数据带入模型,计算结果如图1所示。从直线的斜率和截距可计算出公式中的k2和qe值分别为7.46 mg/g和0.128 g/(mg·h)。假二级速率方程的相关系数R2为0.999 4,说明吸附过程的动力学数据符合假二级速率方程[6]。
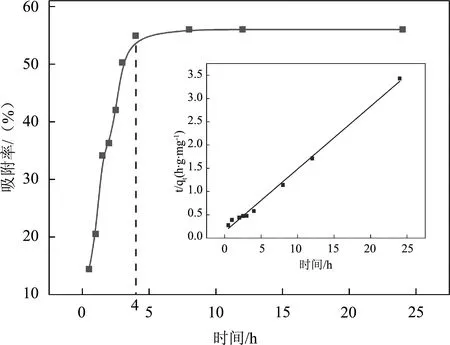
图1 接触时间对吸附过程的影响
2.2 吸附剂浓度的影响
体系中吸附剂浓度变化对吸附率及分配系数Kd的影响如图2所示。分配系数Kd由公式(5)计算而得。
(5)
TiO2对Cu2+的吸附速率随着体系中TiO2浓度的增加而增加,这主要是因为体系中TiO2浓度的增加导致可以和Cu2+结合的表面电位大大增加,从而导致大量的Cu2+被吸附在TiO2表面。另外从图2中还可以发现,随着反应体系中TiO2浓度的增加,分配系数Kd几乎保持不变,这和分配系数的物理化学性质一致,即在较低吸附剂浓度的反应体系中Kd值独立于吸附剂浓度的变化[7]。
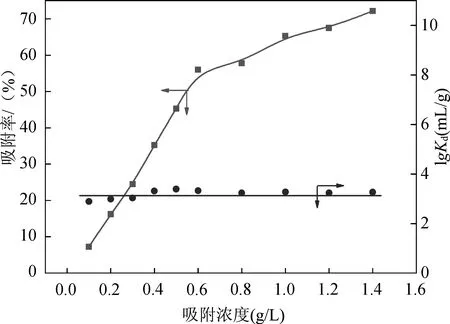
图2 吸附剂浓度对吸附过程的影响
2.3 体系pH值和离子强度对吸附过程的影响
体系pH值变化对吸附过程的影响如图3所示。从图中可以看出体系pH值对Cu2+在TiO2上的吸附过程产生较大的影响。在pH=2~4范围内,TiO2对Cu2+的吸附率较低,缓慢增长。而在pH=4~6范围内吸附率快速增长,且在pH>6反应体系中保持较高的吸附率不变,这主要是因为TiO2的零点电位在pH=6.15附近,在pH>6的反应体系中,TiO2表面带有较强的负电荷,而Cu2+离子主要以Cu(OH)20、Cu(OH)+和Cu(OH)22+等形式存在,以不同形式存在带有正电的Cu2+极易吸附在TiO2的表面,从而可保持较高的吸附率。
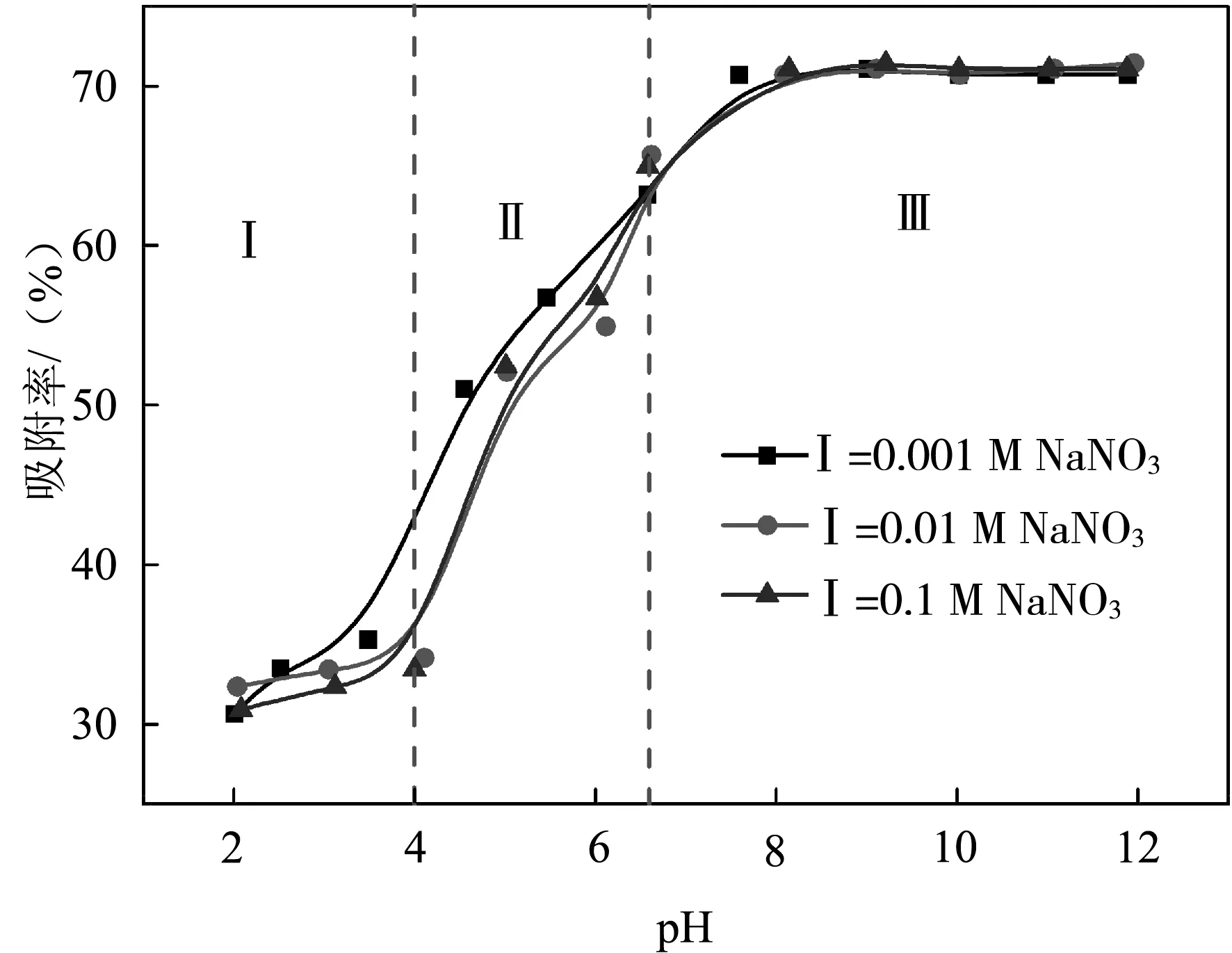
图3 体系pH值和离子强度对吸附过程的影响
另外从图3中还可以发现,体系中离子强度的变化对pH=2~12范围内的吸附过程几乎无影响。这主要是因为NO3-并不能和Cu2+形成复合物,体系中只可能存在Na+和Cu2+的竞争吸附。而体系中Na+的存在对吸附过程几乎无影响,说明TiO2对Cu2+的吸附机理主要是较强的内层络合,而不是外层络合或者离子交换。
2.4 体系中腐殖酸浓度对吸附过程的影响
在腐殖酸存在体系中,TiO2对Cu2+的吸附率变化如图4所示。从图中可以发现,体系中腐殖酸的存在大大促进了TiO2对Cu2+的吸附。这主要是因为在pH=4.8反应体系中,TiO2表面带有正电荷,带有永久负电荷的腐殖酸非常容易吸附在TiO2表面,腐殖酸表面丰富的羧基、羰基、酚羟基等基团则很容易和Cu2+发生络合反应,从而促进Cu2+在TiO2表面的吸附。

图4 体系中腐殖酸浓度对吸附过程的影响
2.5 吸附热力学研究
不同温度下TiO2对Cu2+吸附热力学曲线如图5A所示,从图中可以发现,体系温度越高,TiO2对Cu2+的吸附率越高,说明较高的温度促进TiO2对Cu2+的吸附。不同温度下的热力学数据分别用Langmuir和Freundlich模型进行模拟,相关数据及参数计算结果如图5B、图5C及表1所示。

表1 不同温度下TiO2吸附Cu2+热力学模型参数
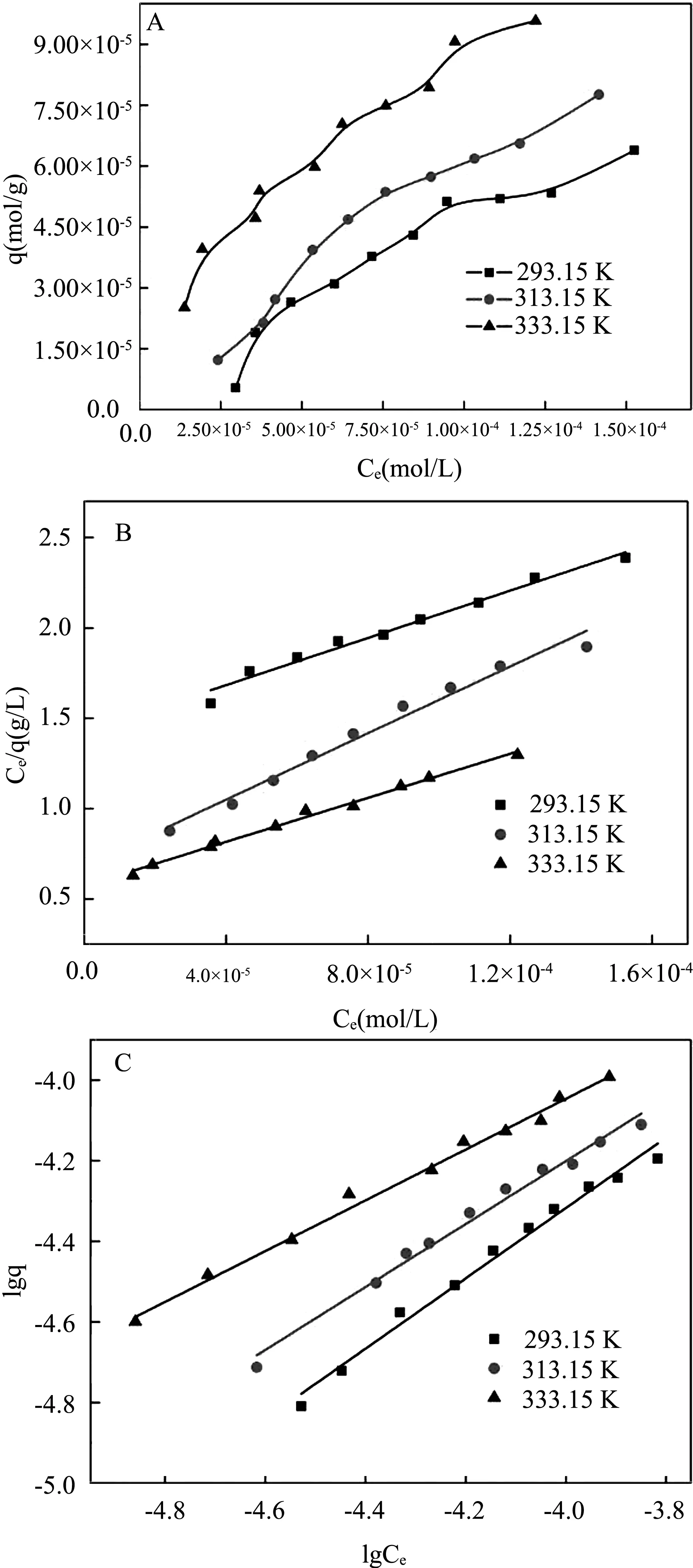
图5 不同温度下的热力学曲线(A)、Langmuir模型(B)和Freundlich模型(C)
从两个不同模型的相关系数结果可以发现,相对于Langmuir模型,Freundlich模型可以更好地对实验数据进行模拟[8],且0 环境体系的pH值,离子强度、吸附剂浓度及温度等因素对吸附过程均具有较大的影响。TiO2对Cu2+较快的吸附速率说明该吸附过程是化学吸附,假二级速率方程可以较好的模拟动力学数据。吸附速率随着体系吸附剂浓度的增加而增大,分配系数Kd随吸附剂浓度的改变而保持不变。较高的体系pH值促进吸附过程的进行,而体系中离子强度的大小对吸附过程影响甚微。腐殖酸表面丰富的基团可以和金属离子络合,促进吸附过程的进行。热力学数据则证明较高的温度可以促进TiO2对Cu2+的吸附,Freundlich模型可以更好的模拟热力学数据则证明TiO2对Cu2+的吸附是多层吸附。TiO2是一种良好的重金属离子吸附剂。3 结论

