β-族溶血性链球菌感染与胎膜早破及母婴预后
陈芳芳 黄 颖 谭铭波
(化州市人民医院产科,广东 化州 525100)
β-族溶血性链球菌具有较强的穿透能力,能够对生殖道产生直接的侵袭作用,从而导致胎膜张力在较大程度上降低,进而在较大程度上使胎膜早破的发生率显著增加。若孕妇生殖道发生β-族溶血性链球菌感染的不良情况,则会刺激其子宫,使子宫产生收缩情况,从而引起早产,甚至引起上行感染,导致胎儿出现发育不良、晚期流产、子宫内膜炎、绒毛膜炎、败血症、新生儿感染等严重感染性疾病,对孕妇及胎儿产生严重的不良影[1]。本研究旨在探讨β-族溶血性链球菌感染与胎膜早破及母婴预后情况。
1 资料与方法
1.1 一般资料 选择2019年1月至2021年1月我院收治的60例胎膜早破孕妇,将其作为胎膜早破组,同时选择同时期60名未发生胎膜早破的健康孕妇,将其作为对照组。胎膜早破组年龄为26~37岁,平均年龄为(30.50±0.90)岁;其中孕周<37周(未足月)孕妇共25例,孕周≥37周(足月)孕妇共35例;产次为0~3 次,平均产次(1.50±0.10)次;破膜至分娩时间为6~40 h,平均破膜至分娩时间为(23.10±0.10)h。对照组年龄为26~38岁,平均年龄为(30.90±1.10)岁;其中孕周<37周(未足月)孕妇共24名,孕周≥37周(足月)孕妇共36名;产次为0~3次,平均产次为(1.60±0.40)次。所有患者均知情同意并签署知情同意书,本研究已获得我院伦理委员会的批准。
1.2 纳入与排除标准 纳入标准:①胎膜早破组产妇均符合胎膜早破的临床诊断标准。②家属对于研究使用的方案表示同意知情。排除标准:①无法积极配合完成检测过程。②患有妊娠期合并症。
1.3 方法 ①采集标本。由采集人员使用碘伏对孕妇的外阴部进行常规消毒,干燥后将窥阴器置入阴道内,使用无菌棉拭子分别收集阴道与宫颈分泌物,及时将其置入培养器中。②羊水采集。使孕妇的宫颈完全显露,采集人员用一只手对宫底进行按压,之后使用5 mL的无针头注射器抽取5 mL的羊水。③β-族溶血性链球菌培养方式。在获取无菌拭子后及时将其插入盛有3 mL的TH液体培养基的培养管中,将培养箱内的温度设定为37 ℃,温育时间为18~24 h。β-族溶血性链球菌在液体培养基内沉淀生长,呈絮状。若存在细菌生长的情况,则将其转种于血平板内 将培养温度设定为37 ℃,培育时间为18~24 h。β-族溶血性链球菌菌落在血平板内进行生化鉴定;β-族溶血性链球菌触酶试验阴性,环磷酸腺苷试验阳性,马尿酸试验阳性者为β-族溶血性链球菌阳性,采用血清学凝集法明确。最后选择VItTEK2-ComPac机GP卡上机进行细菌鉴定[2]。④白细胞介素-6(interleukin-6,IL-6)水平的测定。选择LD25-2型自动离心平衡离心机与HTⅡ型自动扫描酶标仪,对样本进行离心处理后将其放置于-86 ℃的环境中保存。在检测前需在室温下进行溶解,之后严格依据酶联免疫吸附试验(ELISA)要求及其配套试剂对IL-6水平进行测定。
1.4 观察指标 ①比较胎膜早破组与对照组的母婴预后情况,包括胎儿窘迫、新生儿呼吸窘迫、绒毛膜羊膜炎、产褥病、新生儿体质量、新生儿Apgar评分、新生儿感染。Apgar评分标准如下:10分表示正常,≤7分表示存在轻度窒息,≤3分表示存在重度窒息[3]。②评估胎膜早破组与对照组生殖道β-族溶血性链球菌检验结果情况。③比较β-族溶血性链球菌阳性组与β-族溶血性链球菌阴性组之间的母婴预后情况,包括胎儿窘迫、新生儿呼吸窘迫、绒毛膜羊膜炎、产褥病。④比较β-族溶血性链球菌阳性胎膜早破组与β-族溶血性链球菌阴性胎膜早破组羊水IL-6水平情况。⑤统计胎膜早破组与对照组的新生儿感染发生率情况,包括眼炎、脐炎、肺炎等[4]。
1.5 统计学方法 采用SPSS 22.0统计学软件对数据进行分析。计量资料采用()表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 胎膜早破组与对照组孕妇的母婴预后情况比较 胎膜早破组的胎儿窘迫发生率、绒毛膜羊膜炎发生率明显高于对照组,新生儿体质量与Apgar评分明显低于对照组,新生儿感染发生率明显高于对照组,两组比较差异有统计学意义(P<0.05);胎膜早破组与对照组的新生儿呼吸窘迫发生率、产褥病发生率比较,差异无统计学意义(P>0.05)。见表1。
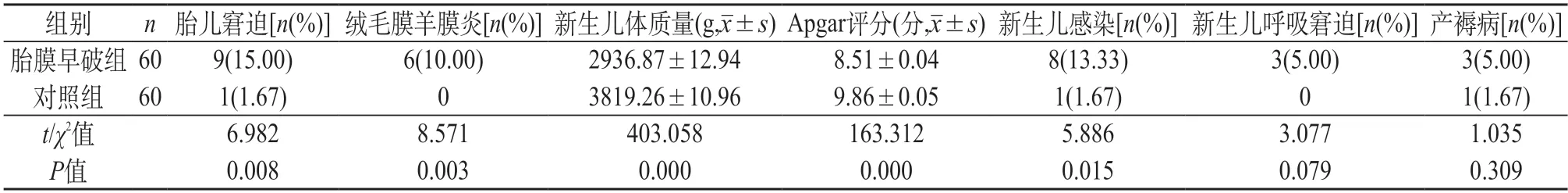
表1 胎膜早破组与对照组孕妇的母婴预后情况比较
2.2 胎膜早破组与对照组生殖道β-族溶血性链球菌检验结果比较 胎膜早破组的β-族溶血性链球菌阳性率明显高于对照组(P<0.05)。见表2。
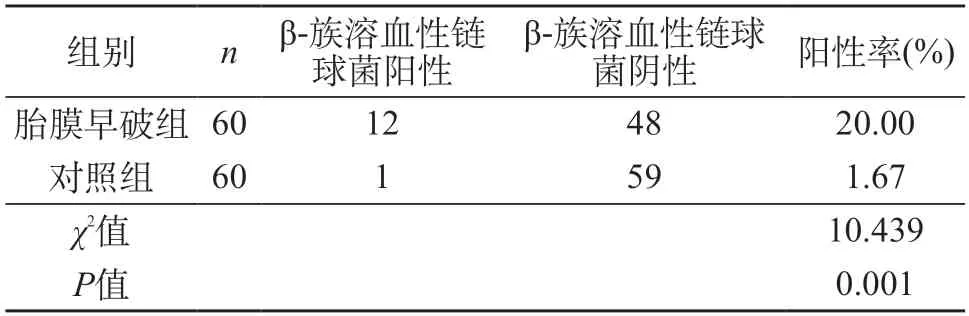
表2 胎膜早破组与对照组生殖道β-族溶血性链球菌检验结果比较
2.3 β-族溶血性链球菌阳性组与β-族溶血性链球菌阴性组之间的母婴预后情况比较 β-族溶血性链球菌阳性组的胎儿窘迫发生率、绒毛膜羊膜炎发生率、产褥病发生率明显高于β-族溶血性链球菌阴性组(P<0.05);但β-族溶血性链球菌阳性组与β-族溶血性链球菌阴性组的新生儿呼吸窘迫发生率比较,差异无统计学意义(P>0.05)。见表3。

表3 β-族溶血性链球菌阳性组与β-族溶血性链球菌阴性组之间的母婴预后情况比较[n(%)]
2.4 β-族溶血性链球菌阳性胎膜早破组与β-族溶血性链球菌阴性胎膜早破组羊水IL-6水平比较 β-族溶血性链球菌阳性组的IL-6水平为(176.58±82.39)ng/L,明显高于β-族溶血性链球菌阴性组的(122.67±59.27)ng/L,两组比较差异有统计学意义(t=2.960,P=0.004)。
2.5 胎膜早破组与对照组的新生儿感染发生率比较 胎膜早破组新生儿感染发生率明显高于对照组,两组比较差异有统计学意义(P<0.05)。见表4。
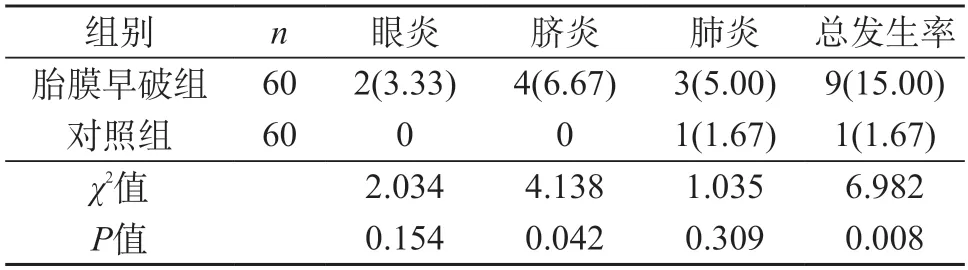
表4 胎膜早破组与对照组的新生儿感染发生率比较[n(%)]
3 讨 论
近年来的相关临床研究发现,生殖道感染是导致胎膜早破的重要因素。细菌感染特别是发生β-族溶血性链球菌感染的产妇,其胎膜早破的发生率明显高于健康孕妇。相关研究结果显示,胎膜早破组孕妇的β-族溶血性链球菌的阳性率明显高于健康孕妇,健康孕妇阳性孕妇胎膜早破发生率明显高于不带菌孕妇,并可使得孕妇出现早产的不良情况[5]。经临床分析可知,导致孕妇出现早产的机制可能在于因免疫力低下或β-族溶血性链球菌的数量多、具有较强的毒力,下泌尿生殖道感染逆行发展可导致胎膜出现早破的不良情况,进而能够使得磷脂酶A2对羊膜等组织受到刺激而产生前列腺素与细胞因子,刺激子宫收缩而出现早产。胎膜早破是一种较为常见的妊娠并发症,一旦出现该种不良情况,会发生逆行感染,进而会提升孕妇出现早产、宫内感染、产褥病、新生儿感染等的发生率。本研究结果显示,胎膜早破组的胎儿窘迫发生率、绒毛膜羊膜炎发生率明显高于对照组,新生儿体质量与Apgar评分明显低于对照组,新生儿感染发生率明显高于对照组,与上述论述基本一致,因此临床医师需采取积极有效的措施对β-族溶血性链球菌进行预防,从而能够加强对孕妇的保护,并提升产科质量[6]。
由于妊娠期β-族溶血性链球菌感染会导致母亲与新生儿发生感染的不良情况,因此临床医师需采取积极有效的措施进行预防与治疗,以便能够有效的使围生期感染发生率得以降低。美国疾病预防控制中心(Carters For Disease Control,CDC)认为,对于妊娠35~37周的孕妇实施β-族溶血性链球菌培养,若筛查结果呈阳性,则需对其实施积极有效的预防性治疗[7-9]。β-族溶血性链球菌感染多见于新生儿。近年来,β-族溶血性链球菌感染成为导致新生儿出现感染情况的首位因素。若母亲为β-族溶血性链球菌阳性者,则在分娩时需要为其使用针对性的抗生素进行治疗;对于新生儿而言,可为其预防性的使用青霉素或氨苄青霉素,若新生儿对于上述存在过敏情况,也可为其使用克林霉素与红霉素等药物,也能够获得良好的效果[10]。
综上所述,β-族溶血性链球菌感染会导致孕妇发生胎膜早破的不良情况,且会对母婴预后造成不良影响,具有较大的相关性。但仍需进行进一步的深入研究,以便获得更加准确的结果。

