俯卧位通气在主动脉夹层术后低氧血症中的应用
李 颖,阿曼古丽·莫明,王正凯,宋云林
主动脉夹层(aortic dissection,AD)是因血管内膜破裂,血流进入中膜层,使内膜与外膜分离,形成真假两腔的大血管疾病。其发病率和病死率均较高,每10万名患者中有15例发生AD的风险,65~75岁患者中,发病率可高达每年每10万人中35例[1]。目前,对于Stanford A型夹层推荐进行紧急手术治疗[2],而因手术过程复杂、耗时较长、需深低温停循环辅助和输血量大等因素的影响,术后容易出现低氧血症,增加患者的治疗难度进而影响患者的预后[3-4]。低氧血症作为急性A型主动脉夹层(type A aortic dissection,TAAD)术后最常见的并发症,与患者机械通气(mechanical ventilation,MV)时间、ICU住院时间、死亡率和住院费用增加有关。
20世纪70年代,俯卧位通气(prone position ventilation,PPV)作为一种改善急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者严重低氧血症的方法首次被提出,随后逐渐被证实为改善严重低氧血症的简单且安全的方法。PPV能快速改善氧合,副作用较少,降低患者病死率、MV时间以及呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)发生率等[4-5]。因此,本文对AD术后出现低氧血症的原因、相关危险因素、PPV改善低氧血症的作用机制以及其在夹层术后低氧血症患者中的应用进行综述。
1 AD术后低氧血症
1.1 AD术后出现低氧血症的原因低氧血症是指动脉血氧分压(PaO2)低于正常值范围,PaO2的正常范围:13.3-(0.04×年龄)±0.67(kPa)或100-0.3×年龄±5(mmHg),而术后低氧血症是指在进入ICU后6 h内评估氧合指数(PaO2/FiO2)<200[4]。目前对TAAD术后出现低氧血症的机制尚不清楚,但考虑心肺转流(cardiopulmonary bypass,CPB)是最主要的因素,因患者血液与多种合成材料直接接触而引起全身的炎症反应和急性肺损伤[6]。随着炎性因子的释放,肺泡上皮和肺毛细血管内皮的通透性增加,形成肺水肿,出现严重的肺通气血流比值(V/Q)失调,导致顽固性的低氧血症。CPB还引起内皮细胞的通透性增高与血管生成素-2(angiopioetin-2,Ang-2)水平升高,引起微循环灌注紊乱[7],同时因缺血再灌注损伤心肌和肺及造成肺泡和内皮的损伤而导致气体交换障碍和肺水肿,增加低氧血症发生的风险[8]。此外,其发生也可能与其他心功能不全、全身麻醉、手术创伤、气管插管及手术引起的应激等诸多因素相关。
1.2 AD术后出现低氧血症的危险因素目前,TAAD与低氧血症之间的联系尚未充分研究。因此,对TAAD术后发生低氧血症的危险因素进行分析,早期针对危险因素进行及时的干预和治疗,以提高手术治疗效果和降低围手术期死亡率是非常有必要的。慢性阻塞性肺病、肥胖、吸烟史、血流动力学不稳定、急诊手术、复杂心脏手术、术后肺部感染等都是危险因素[9];体重指数>25 kg/m2、深低温停循环、术前PaO2/FiO2≤300、术后的24 h内输血量>6 U是独立危险因素[10];吸烟和CPB时间可作为独立预测因素,但也有研究提出吸烟可能不是术后发生低氧血症显著的独立预测因素[11]。其中肥胖患者是因肺的顺应性下降,呼吸阻力以及呼吸功增加而引起低氧血症;而且大多数肥胖患者都会有慢性过度炎症和氧化应激,直接破坏细胞膜,释放趋化因子和血管活性物质。输血可诱发各种微血栓的形成,进而直接影响肺功能而导致低氧;同时,储存血液中的红细胞携带氧气的能力差并且具有免疫抑制的作用,大大增加了感染的风险。
2 PPV改善低氧的原理
低氧血症的治疗重点是以纠正低氧血症为目标,近年来主要推行肺保护性通气策略,但对于一些顽固性的低氧血症患者效果不佳。而PPV对这种严重顽固性的低氧血症患者效果明显,且没有明显的副作用,被认为是治疗严重低氧血症简单有效的辅助方法[3]。
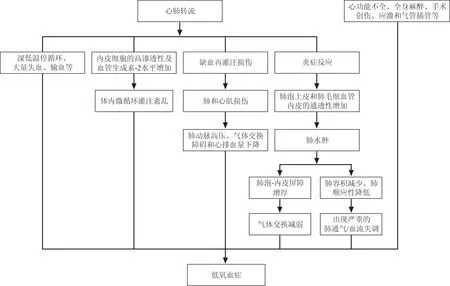
图1 A型主动脉夹层术后低氧血症的原因
当患者处于仰卧位时,由于肺腹侧、心脏和腹部脏器的重量,背侧的胸膜压力会增加,这会降低肺背侧区域的跨肺压,进而减少背侧区域的局部通气;而血管压力又是因重力作用会优先灌注这些区域,出现低通气高灌注的V/Q比失调的现象,临床上表现为低氧血症。然而,当患者处于俯卧位时,可以减少纵膈和心脏对肺部的压迫,使腹腔内压降低,改善局部膈肌的运动,增加功能残气量;肺血流也重新分布,改善重力依赖区的通气血流比,还促进分泌物的引流,从而达到改善患者氧合的目的。
一般普遍认为,俯卧位改善氧合主要是通过减少肺内分流(Qs/Qt)、肺通气血流的重新分布以及改善V/Q比,但有研究显示俯卧位和仰卧位时的灌注分布是相似的,翻为俯卧位时,肺血流的重力分布变化是很小的[12]。由此可见,V/Q比的改善可能主要由于俯卧位与仰卧位相比,改善肺的顺应性,促进背侧肺泡的复张,增加处于开放状态的肺泡数量,使得通气更加均匀,以此来抵消因重力依赖而通气不足,使得肺泡的通气量与血液灌注量相互匹配[13]。肺在解剖学上类似于锥形,当患者俯卧位时,刚好与圆柱形胸廓相适应,扭曲度较小,进而可以减少分布在肺背部肺不张区域的分流。据资料显示[14],俯卧位能显著改善低氧的原因,可能是以下几点:①在呼吸周期中能重新复张进行通气和灌注的肺泡数。如果肺背侧的复张肺泡的数量超过腹侧的塌陷肺泡的数量,基于灌注分布基本不变,患者氧合情况就能得到明显改善;②肺泡扩张的同质化程度。因为若不同肺泡扩张程度不同,则会引起各个肺泡的通气量不均匀,又基于肺泡灌注是几乎保持不变的,最终导致V/Q比失调,反之,若能保证各肺泡的扩张程度均匀,则有利于改善V/Q比失调,减少死腔量;③胸壁顺应性的局部改变。由于前胸壁的顺应性较低和横膈膜的弯曲,吸入气体向肺后腹旁区移动,而在仰卧位通气时不存在这种情况。见图2。

图2 体位变化对肺部的影响
3 PPV在夹层术后低氧患者中的应用
3.1 PPV与呼气末正压(positive end-expiratory pressure,PEEP)联合应用PEEP是在呼气末为了维持气道压力高于大气压而给予的正压,能防止肺泡因完全呼出气体而导致的塌陷,减少肺泡间的剪切伤,改善肺的顺应性,减少肺内分流,增加气体弥散进而提高PaO2。研究表明,相比单纯给予PEEP,将其与PPV联合应用能让患者PaO2明显升高且不影响血流动力,说明了二者联合应用的安全性[15-16]。
然而对PEEP水平以及PPV时间的合理控制是二者联合应用起到更好作用的基础。PPV时间应至少维持24 h,若24 h后患者PaO2/FiO2仍低于150时,则应延长且推荐尽早使用。较高水平的PEEP有利于肺复张,但也会促进炎性因子的释放[17],故选择适合的PEEP水平仍然是一个难题。有研究表明,PEEP水平比标准水平降低29%,能显著增加呼吸系统顺应性、减少死腔通气和降低高碳酸血症,同时可减少血管活性药物的剂量;而相对较高水平的PEEP可能会因显著增加胸内压,减少静脉回流而对血流动力学产生不利影响[18]。一个多中心的大型随机临床试验证实,在中度至重度ARDS患者中,与低PEEP相比,肺复张和滴定PEEP的策略增加了28 d死亡率[19]。因此,总的来说,明确认为较低水平的PEEP可能更加有益,同时临床上可以通过观察潮气量的变化、平台压大小以及氧饱和度数值来进行合理的调整。
3.2 PPV与无创联合治疗的效果早期使用无创通气(noninvasive ventilation,NIV)或高流量鼻导管(high flow nasal catheter,HFNC)主要目的是改善氧合,避免气管插管。其中接受HFNC的低氧血症患者插管率低于接受NIV或标准氧疗的患者,因为HFNC提供较低的跨肺压通气(transpulmonary pressure ventilation,TPPV),有利于减少呼吸机相关性肺损伤(ventilatory-induced lung injury,VILI)[20]。早期PPV联合HFNC/NIV可避免多数患者进行气管插管,患者清醒并接受HFNC或NIV治疗时,对PPV的耐受性普遍较好,痰液引流也较顺畅[21]。但这些早期PPV联合HFNC或NIV方法,适用于非插管的患者,可避免插管。然而,夹层患者术后已是气管插管状态,因此PPV联合NIV/HFNC的方法可以用于术前改善患者术前的氧合状态,尽力避免或降低术后出现低氧血症的可能性。
3.3 PPV的疗效尽管PPV有许多益处,但仍没被广泛应用,对于AD术后低氧血症患者中的应用相关文献报道也少之又少。这可能是由于目前的一些研究结果存在相互矛盾的观点以及对于可能出现的并发症过度担忧等。比如,一项系统综述[22]提出,PPV不应该常规用于所有急性低氧性呼吸衰竭患者,但可考虑用于严重低氧性呼吸衰竭患者。虽然类似荟萃分析有助于明确PPV在心外术后顽固性低氧血症中应用的有效性和安全性,但因研究人群的异质性使得结果难以推广。许多方面,包括决策和技术等仍然存在争议,将需要进行更多的研究,提高现有证据的质量。
然而已有的大部分研究表明,对夹层术后的低氧血症患者实施PPV,可快速改善患者氧合状况、缩短MV时间及住院时间,且不影响血流动力学稳定,临床上可推广[3,23]。比如,冠状动脉旁路移植术后的急性呼吸衰竭患者,观察常规机械通气的基础上实施仰卧位和俯卧位的效果,发现两组患者血流动力学参数并无差异,但PPV组明显改善了气体交换和氧合情况,并若能仔细定位并定期检查,可避免压疮和气道阻塞等不良事件的发生[24];Moller等[25]回顾性分析TAAD术并术后出现低氧血症患者的资料,提出PPV对TAAD术后低氧血症患者有显著益处,并即使在严重的血流动力学不稳定的患者中也具有良好的耐受性,对于重度低氧血症患者推荐采用PPV;von Wardenburg等[26]回顾性分析了心脏术后低氧患者实施PPV的情况,发现PPV若尽早实施,则是一种安全有效的辅助治疗措施,且并发症发生率较低;Saha等[27]回顾性分析了心脏术后接受PPV治疗的低氧血症患者,发现患者氧合水平显著改善且尽早使用可减少VILI;Kim等[28]给肺移植术后的顽固性低氧血症患者实施PPV,成功逆转了超大肺移植术后的肺不张,改善了患者的难治性低氧血症;一项随机对照研究比较心脏术后出现肺不张而导致低氧血症的患者分别给予仰卧位或俯卧位联合进行肺复张后的疗效,结果显示心脏术后早期,与仰卧位相比,俯卧位联合肺复张可纠正肺不张并改善肺氧合[29];一项Meta分析也显示了PPV与常规仰卧位通气相比能够降低低氧患者的病死率、MV时间及VAP发生率,但两者ICU住院时间并无差异[30]。
因此,PPV可推广于心脏手术后(或夹层术后)出现严重低氧血症的患者,并且尽早实施改善患者预后。此外,功能残气量(function residual capacity,FRC)和肺部超声评分具有明显的相关性[31],FRC与PPV时间呈负相关,在临床上对AD术后低氧血症患者除了观察氧饱和度之外,也可以以此作为参考来评估PPV疗效。
3.4 实施PPV后并发症的预防虽然PPV能显著改善顽固性低氧,但也会引起一些并发症,如眼面部水肿、压疮、气道相关的并发症、胃内容物反流误吸及血流动力学紊乱等[32]。胸部是PPV时极易被挤压的部位,随着俯卧位时间延长,会因持续受到心脏和肺部等脏器的挤压,手术切口的愈合会受到影响并且存在裂开的风险。因此,在临床上除了需要严格按照《急性呼吸窘迫综合征患者俯卧位通气治疗规范化流程》实施之外[33],还需对AD术后患者提前进行使用敷贴与胸带对胸部进行固定,这样可避免术区因挤压而裂开等的并发症;也可使用特制的俯卧位垫(设有胸、腹集于一体的方形结构,其主要材料为慢回弹的记忆棉,通过均匀分布身体重量对胸部产生的压力,能有效避免胸部受压迫而减小术区挤压的程度),防止这些不良事件的发生[34]。此外也要控制好俯卧位时长,当时间超过12 h后不仅不利于切口愈合,还会增加发生压疮的风险,若处理不当会引起感染,严重时会导致患者死亡[35-36]。
4 总 结
AD作为进展迅速、死亡率极高的大血管疾病,尤其是TAAD,一旦发现就需要立即进行手术治疗。但由于手术时间长,并需要在全麻和CPB辅助下进行,极大程度上增加了患者术后发生低氧血症的风险,而PPV则能快速有效地改善低氧血症,且实施难度相对较小,也不会增加患者经济负担,完全可以作为一种心脏术后低氧血症患者早期快速康复的有效方法。

