臭氧水与生防菌剂组合应用对番茄根结线虫及根际微生物群落的影响
魏艳丽 李红梅 扈进冬 隋丽娜 刘宝军 赵忠娟 李纪顺
摘要:为了明确臭氧水与菌剂组合应用对番茄根结线虫的防治效果,采用定量接种法探究臭氧水与不同菌剂组合处理对沙培和土培番茄生长、南方根结线虫防治效果及根际土壤微生物群落的影响。结果表明,单独臭氧水处理对番茄生长无影响,8 mg/L的臭氧水可显著减少番茄根系根结的形成,使盆栽番茄根际土中南方根结线虫群体密度降低90.79%。臭氧水与哈茨木霉T11-W和伯克氏菌B418组合处理,番茄株高和鲜质量与对照相比分别增加61.64%、90.90%,对根结线虫的相对防效为69.95%。臭氧水与B418组合处理,番茄株高和鲜质量分别增加59.10%、68.86%,对根结线虫的相对防效为64.39%。臭氧水与哈茨木霉T11-W和伯克氏菌B418组合处理可降低细菌的丰富度,增加真菌群落多样性和丰富度,显著降低链格孢属(Alternaria)、镰刀菌属(Fusarium)等潜在植物病原真菌的相对丰度。该研究为臭氧水与菌剂组合防治番茄根结线虫病提供了理论依据。
关键词:臭氧水;番茄根结线虫;哈茨木霉;越南伯克霍尔德氏菌;微生物群落
中圖分类号:S436.412;S154.3 文献标志码: A
文章编号:1002-1302(2022)12-0121-06
收稿日期:2021-08-04
基金项目:2018年山东省农业重大应用技术创新项目;齐鲁工业大学(山东省科学院)科教产融合项目(编号:2020KJC-GH07);山东省科学院院(校)地产学研协同创新基金 (编号:2020-CXY11);山东省重点研发计划(重大科技创新工程)项目(编号:2020CXGC010803)。
作者简介:魏艳丽(1978—),女,山东东阿人,硕士,研究员,主要从事植病生防和土壤微生物研究。E-mail:407978851@qq.com。
通信作者:李纪顺,研究员,主要从事植病生防和微生物肥料研发等工作。E-mail:yewu2@sdas.org。
根结线虫(Meloidogyne spp.)是世界上分布最广、危害最重的植物病原线虫,每年对全世界作物造成严重的经济损失,它能侵染几乎所有的蔬菜作物,对保护地蔬菜的危害尤其严重[1-3],已经成为我国设施蔬菜生产的最重要限制因子之一。
目前对根结线虫的防治主要是以化学药剂为主,分为熏蒸类和非熏蒸类两大类,杀线剂对人畜普遍呈现高毒性,用量大易产生抗药性,长期使用会带来非靶标生物毒害和环境污染等问题[4-5],不少高毒性的杀线剂已被禁止使用。利用寄生或捕食性食线虫菌物、拮抗性根际微生物或致病性病原等进行生物防治是线虫病害防治研究的主流趋势,已报道的植物寄生线虫生防微生物资源有淡紫拟青霉(Purpureocillium lilacinum)菌株 51[6]、坚强芽孢杆菌(Bacillius firmus)菌株 I-1582[7]、厚垣孢普可尼亚菌(Pochonia chlamydosporia)菌株 ZK7[8]、长枝木霉(Trichoderma longibrachiatum)菌株 T6[9]、橘绿木霉(T. citrinoviride)菌株 Snef 1910[10]、越南伯克霍尔德氏菌(Burkholderia vietnamiensi)菌株 B418[11]等,其中多株优良生防菌株已被开发为生物杀线剂产品。
臭氧是一种具有强氧化性的气体,在水中分解产生的二级氧化剂——氢氧自由基(·OH),是一种非选择性的强氧化剂,可破坏微生物膜结构[12],且极易分解,施用后40 min左右就会分解为氧气和水,不会对环境造成二次污染,是一种安全、高效、环保的杀虫灭菌剂[13]。Veronico 等研究发现,浇灌臭氧水可调控番茄的基本防御系统,降低线虫侵染率[14];Guo等研究发现,0.5 mg/L的臭氧水可在体外抑制芸薹属植物病原菌欧文氏菌(Erwinia carotovora)的生长[15];Kobayashi等研究证实,臭氧可使尖镰孢菌(Fusarium oxysporum)和果胶杆菌(Pectobacterium carotovorum)失去活性[16]。
越南伯克霍尔德氏菌B418和哈茨木霉(T. harzianum) T11-W是笔者所在研究室保存的多功能生防菌株,其中哈茨木霉T11-W对南方根结线虫分散卵具有寄生作用,是一种潜在的寄生植物线虫真菌资源[17],越南伯克霍尔德氏菌B418对番茄和茄子根结线虫病的防治效果分别为63.42%、75.6%[11]。在以往的试验中由于土壤中根结线虫含量较高,单独使用菌剂对线虫的防治效果还不甚理想。关于臭氧水与生防菌剂组合使用防治根结线虫是否会出现叠加或协同的效果尚未见报道。本研究在温室条件下,研究了沙培和土壤栽培模式下,臭氧水与哈茨木霉T11-W和越南伯克霍尔德氏菌B418菌剂联合应用对番茄植株生长的影响和对根结线虫的抑制作用,同时研究了联合应用对番茄根际土壤微生物菌落的影响,以期为根结线虫的防治提供安全有效的防控新技术。
1 材料与方法
1.1 试验材料
供试线虫和植物:南方根结线虫(Meloidogyne incognita)由笔者所在实验室自感病番茄根部分离并鉴定;供试番茄为金冠八号,购自济南伟丽种业有限公司。
供试微生物菌剂为哈茨木霉T11-W 和越南伯克霍尔德氏菌B418,为笔者所在实验室发酵制备的草炭制剂,有效活菌数均为2×108 CFU/g。
1.2 臭氧发生仪器
试验所用臭氧水发生器为山东泽恩农业科技股份有限公司生产的土壤消毒灭菌机,臭氧浓度检测仪为启立DOZ-30(广州启立环保设备有限公司)。
1.3 番茄南方根结线虫卵(虫)悬浮液的制备
从根结线虫发病严重地块挖取感病番茄植株,流动自来水冲洗干净根部,带回实验室。参考Hussey等的线虫悬浮液制备方法[18],将洗净的番茄根用5% NaClO溶液消毒10 min,无菌水冲洗3遍后用灭菌剪刀将根部剪成0.5 cm的小段,然后加入适量无菌水,充分搅拌均匀。将根及溶液依次倒入200目和500目的套筛上,收集500目筛上的卵及少量2龄幼虫,制成每毫升500个卵(幼虫)的悬浮液备用。
1.4 土壤中根结线虫qPCR定量检测
根据已发布的南方根结线虫ITS区的保守序列(NCBI:KF418368.1、FJ534516.1)设计特异性引物,预期扩增片段大小为139 bp。引物由生工生物工程(上海)股份有限公司合成,引物序列为MIITS7-F(5′-CCAATTTAATCGCAGTGGCTTG),MIITS127-R(5′-CGACAGCCGTTTCACAACAATA)。
qPCR标准曲线中根结线虫DNA的提取参考Gorny等的方法[19],于显微镜下挑取1 000条2龄幼虫,利用MOBIO的土壤DNA提取试剂盒(Power Soil DNA Isolation Kit)提取DNA作为标准品,以其梯度稀释液作为模板进行实时荧光定量PCR反应,每个标准品重复3次,得到各自循环阈值Cq,通过Cq值与2龄幼虫的对数值之间的线性关系,建立标准曲线。
qPCR反应参考Zhao等的方法[20],使用TaKaRa公司的SYBR Premix Ex Taq試剂盒(Perfect Real time)和Bio-Rad公司的iQ5实时荧光定量PCR仪。25 μL 体系如下:SYBR Green 预混液 12.5 μL,20 μmol/L 正向和反向引物各1 μL,模板DNA 1 μL,添加无菌水至终体积25 μL。qPCR反应采用三步法:在95 ℃预变性10 min;95 ℃ 变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共40个循环;循环结束后,样品加热到95 ℃,立刻降至60 ℃ 保持5 s,然后每5 s提高0.5 ℃递增到95 ℃。
1.5 番茄沙培试验设计
试验设无菌水对照和臭氧水浇灌2个处理,每个处理20个重复。将长有4张真叶且长势一致的供试番茄苗种植在装有灭菌河沙的50 mL塑料离心管中(底部有直径约2 mm的洞),每管种植1株苗。定植后,在距离番茄根周围0.5 cm处滴入1 mL的卵(幼虫)悬浮液,使每株番茄苗接种的卵(幼虫)数目为2 000个。接种72 h后,向管中加入过量的浓度为8 mg/L臭氧水(以底部刚刚有水流出为准)。根据番茄长势,每3 d浇1次Hogland溶液[21],置于光照培养箱(光暗比14 h—10 h,25 ℃)中培养6周后,小心取出整株根系,用自来水冲洗干净后,采用EPSON扫描仪记录根系形态,获取根系图像,分别测量植株根系及地上部干质量等指标。同时统计番茄根系上的根结数量,并计算根结减退率[9]。
根结减退率=(对照根结数-处理根结数)/对照根结数×100%。
1.6 番茄土壤盆栽试验
盆栽试验于2020年9—11月在山东省科学院生态研究所试验基地(117°15.87′E,36°39.68′N)进行,盆栽土来自于基地连续种植番茄且根结线虫发病严重地块。除去表层土后,采集0~20 cm土样,多点采样混匀后过50目筛。土壤理化性质为:有机质含量22.14 g/kg、全氮含量1.02 g/kg、速效磷含量8.37 mg/kg、速效钾含量219.16 mg/kg,pH 值6.70,参考刘维志的方法[22]测定根际土壤中根结线虫数量(以密度计,g/头)。
试验用盆为深21 cm、直径23 cm 的圆形花盆,装土2 kg/盆。所用臭氧水浓度为8 mg/L。共设5个处理,每个处理6个重复,分别为SO臭氧处理组,浇2 L臭氧水;SOB处理组:浇2 L臭氧水,48 h后加入B418菌剂5 g/盆;SOT处理组:浇2 L臭氧水,48 h后加入T11-W菌剂5 g/盆;SOBT处理组,浇2 L臭氧水,48 h后加入T11-W菌剂5 g/盆和B418菌剂5 g/盆;SCK对照处理组浇等量蒸馏水。定植5株/盆具有4张真叶、长势一致的番茄苗。依据土壤干湿情况,每间隔3~4 d浇水1次,6周后剪取植株地上部用于测量植株高度和地上部鲜质量。然后取出全部根系,调查所有植株的根系根结数量。
1.7 番茄根际土壤微生物DNA提取及高通量测序
土壤盆栽番茄收获后,将整株挖出,轻轻抖落根系外围的大土块,只收集附着在根系上的土壤作为根际土,5株/盆根际土混合作为1个样品。称取0.5 g土壤样品,利用DNeasy Power Soil DNA Isolation Kit(Qiagen,Valencia,CA)试剂盒,按照说明书提取土壤DNA,最终洗脱体积为70 μL,0.8%琼脂糖凝胶电泳检测DNA质量和浓度,一部分用于根际土壤中根结线虫qPCR定量测定,另一部分用于高通量测序。
土壤微生物DNA高通量测序方法[23]:利用通用引物341F(5′-CCTACGGGNGGCWGCAG)和805R(5′-GACTACHVGGGTATCTAATCC)对DNA中的细菌基因组16S rRNA的V3~V4区域进行扩增,利用通用引物 ITS3F(5′-GCATCGATGAAGAACGCAGC)和ITS4R(5′-TCCTCCGCTTATTGATATGC)对真菌ITS2区进行扩增。30 μL扩增体系如下:Phusion Master Mix(2×)15 μL,2 μmol/L引物 3 μL,1 ng/μL模板DNA 10 μL,超纯水2 μL。PCR反应程序为:98 ℃预变性1 min;98 ℃变性10 s,50 ℃ 退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。高通量测序采用Illumina Miseq平台,由生工生物工程(上海)股份有限公司完成。
1.8 数据处理
番茄根结指数按照0~5级划分,以根结数量和根受害程度为分级标准[4],具体如下:0级,根系健壮,无根结;1级,根系上只有极少数根结,且直径大小在2 mm以内;2级,25%及以内的根系上有根结,未连接成串,且直径大小在2 mm以内;3级,26%~50%根系有根结,部分根结相连成直径大于3 mm的不规则根结;4级,51%~75%的根系有根结,多数相连成直径大于3 mm的不规则根结;5级,76%及以上的根系上有根结,且相连直径大于3 mm,主、侧根呈畸形或腐烂。根结病情指数计算公式如下:
根结病情指数=[∑(各级植株数量×相应的级数)/(调查植株总株数×5)]×100;
相对防效=[(对照根结病情指数-处理根结病情指数)/对照根结病情指数]×100%;
试验数据采用Excel 010软件整理、SPSS 1.0软件统计分析,同一处理样品数据的差异显著性采用t检验分析。
高通量测序后对各样本优化序列提取非重复序列,去冗余序列后按照97%相似性对非重复序列 (不含单序列) 进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。16S扩增片段使用RDP Classifier比对RDP数据库;ITS使用Blast比对UNITE数据库,最终分别在域(domain)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species)等各个分类水平上统计各样本的群落组成,应用mothur软件计算Shannon、Chao等多样性指数[24]。
2 结果与分析
2.1 根结线虫qPCR标准曲线的建立
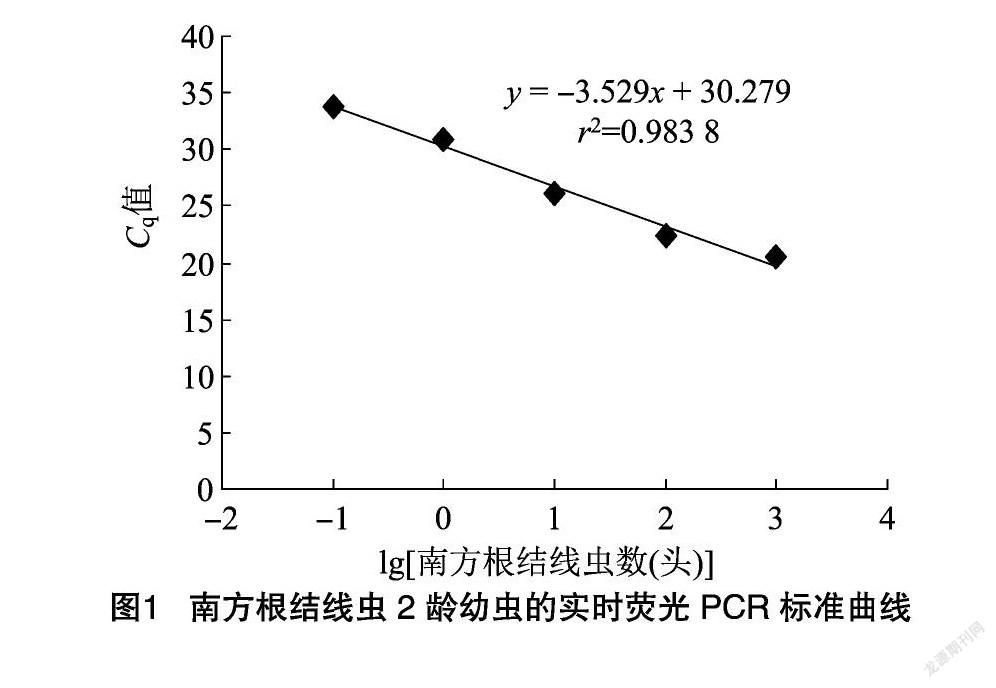
利用引物MIITS7-F/MIITS127-R建立根结线虫的标准曲线,Cq值与根结线虫2龄幼虫量的对数值之间呈显著负相关性,标准曲线方程为y=-3.529x+30.297,决定系数r2=0.983 8,表明建立的实时荧光PCR标准曲线具有良好的线性关系。
2.2 臭氧水对沙培番茄生长的影响及根结线虫的作用
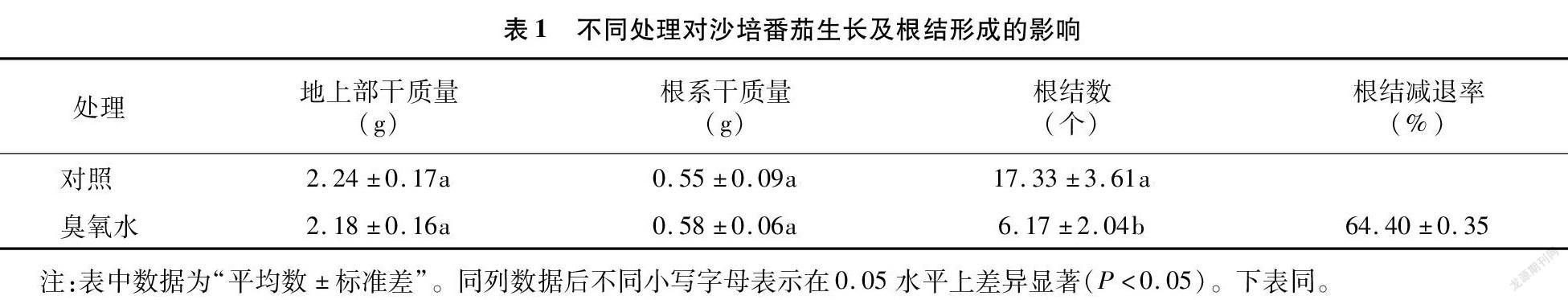
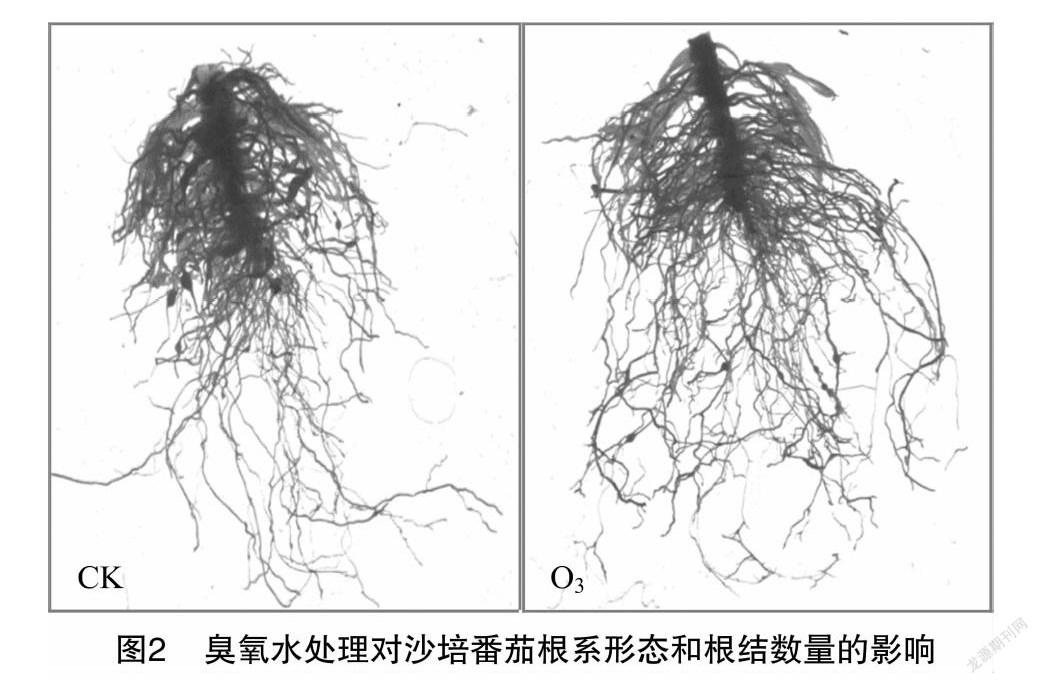
番茄沙培6周后,各处理间植株的地上部和根系干质量并无显著性差异(表1),但植株根系形态和根结发生现象差异明显(图2),对照处理组须根较少,在近主根的位置形成多个根结,且部分互连形成5 mm以上的大根结;而臭氧水处理的番茄植株须根较多,根结个体直径多在2 mm以内,主要分布在须根末端,且数量较少,平均根结减退率为64.40%,与对照相比差异显著(P<0.05)。
2.3 不同处理对土培番茄生长和根结线虫的防治效果
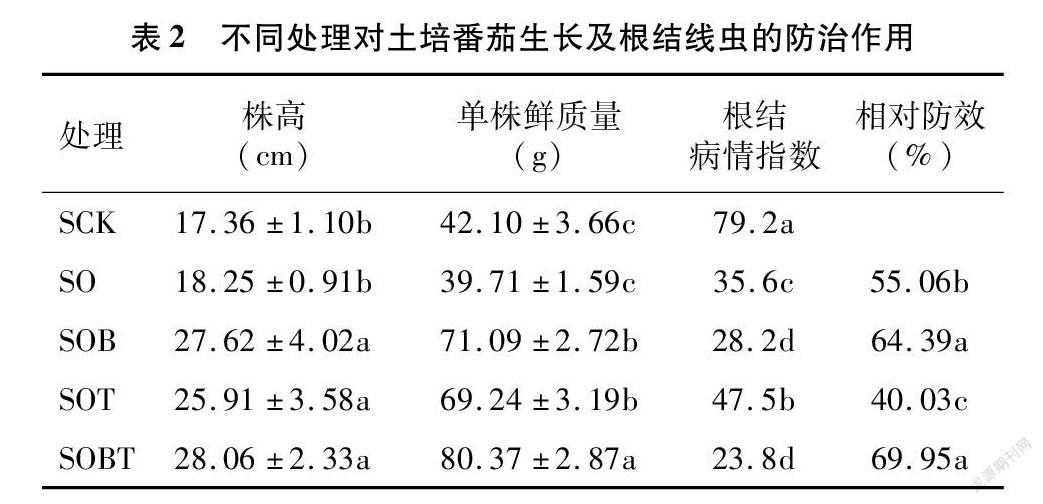
番茄土壤盆栽6周后,臭氧水单独处理组(SO)株高和单株鲜质量与对照相比无显著差异。臭氧水与菌剂组合的2个处理均可促进番茄株高和单株鲜质量增加(表2),其中与T11-W和B418组合处理组(SOBT)增加最显著(P<0.05),对株高和鲜质量的增加率分别为61.64%、90.90%;其次是臭氧水与B418组合处理组(SOB),对株高和鲜质量的增加率分别为59.10%、68.86%。
对照处理组番茄植株根结线虫病害发生严重,其根结病情指数达79.2,而臭氧水单独或与菌剂组合处理都可抑制根结的产生,与对照相比根结病情指数显著降低(P<0.05)。SOBT和SOB处理组对根结线虫病的相对防效分别为69.95%、64.39%,二者之间无显著差异;SO处理组相对防效为55.06%。
2.4 不同处理对根际土壤根结线虫数量的影响
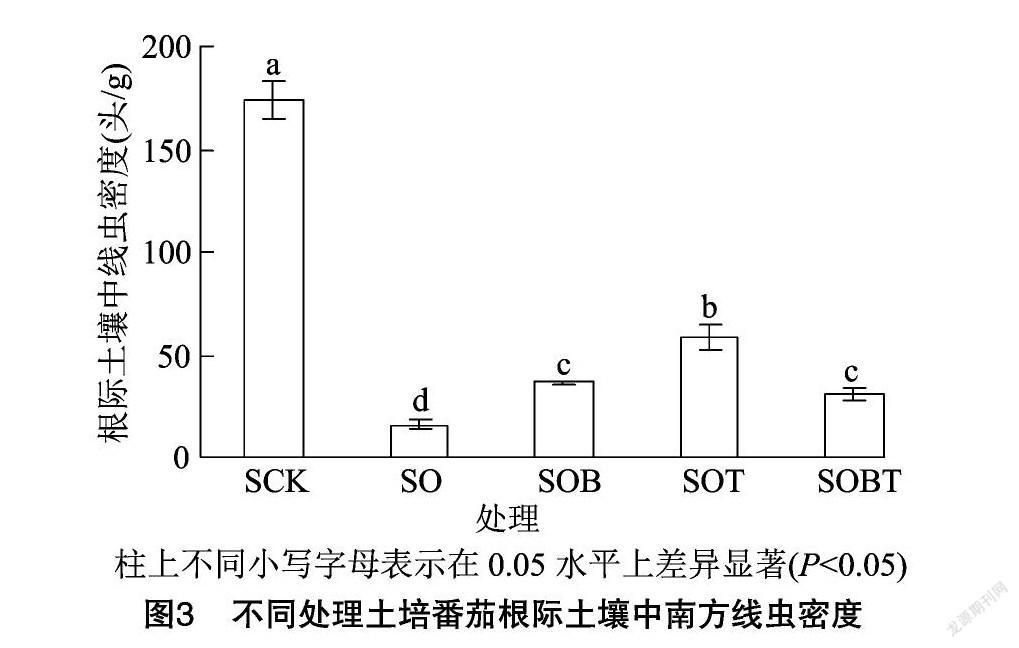
利用qPCR检测根际土壤中南方根结线虫虫口密度结果见图3,各处理根际土壤中南方根结线虫密度存在着显著差异(P<0.05), 对照处理组(SCK)密度最大,为174.41头/g。臭氧水及其菌剂联合处理组检测出的南方根结线虫密度显著减少,其中单独臭氧处理组SO密度最小,為16.07头/g;臭氧+B418组合处理组SOB和臭氧+B418+T11-W 组合处理组SOBT之间差异不显著,分别为36.24、30.49头/g。
2.5 不同处理对盆栽番茄根际微生物群落多样性和丰富度的影响
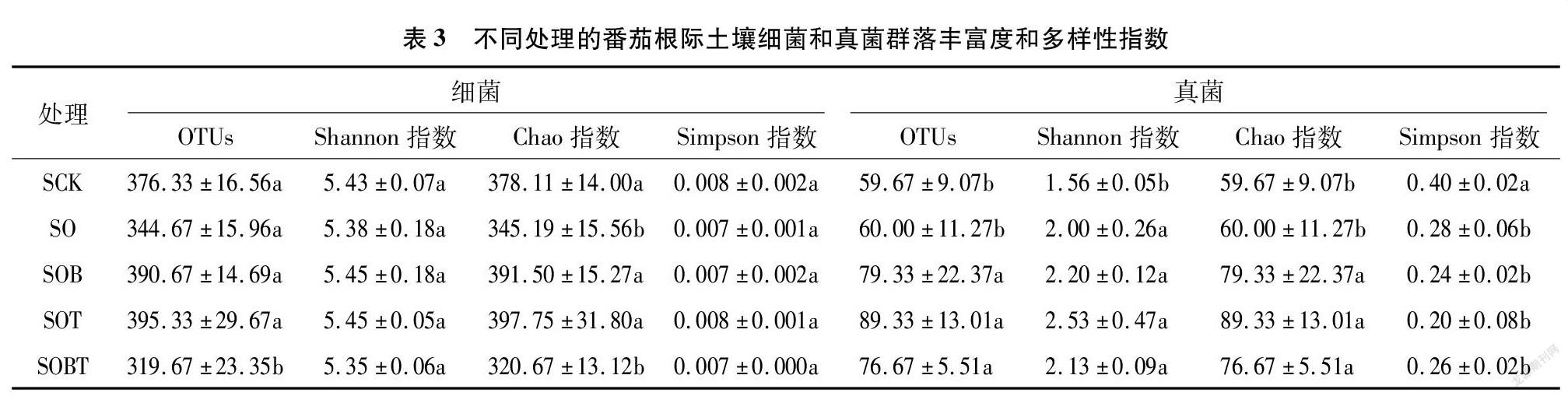
Chao指数可反映群落物种丰富度,其值越大,表明样品中生物群落丰富度越高。由表3可以看出,单独臭氧水处理组SO与对照SCK相比细菌Chao指数降低,真菌Chao指数无显著变化;臭氧水与菌剂组合处理组与对照相比细菌Chao指数无显著差异,真菌Chao指数显著增加(P<0.05)。 臭氧水与2个菌剂联合处理组SOBT降低了细菌Chao指数,增加了真菌Chao指数。臭氧水与菌剂联合可以增加根际土壤中真菌的丰富度,降低细菌的丰富度。
Shannon指数和Simpson指数反映了样品中微生物群落的多样性,Shannon指数值越大说明群落多样性越高;Simpson指数则相反,值越大说明群落多样性越低。由表3可知,所有处理间细菌的Shannon指数和Simpson指数没有显著变化。在真菌方面,臭氧水单独处理或与菌剂联合处理都可显著增加真菌的Shannon指数(P<0.05),且臭氧水参与的3个处理之间没有显著差异。表明臭氧水或与菌剂联合处理不会影响细菌群落多样性,但可以增加真菌群落多样性。
2.6 不同处理对盆栽番茄根际微生物群落结构的影响
在门分类水平上,各处理番茄根际土壤中鉴定得到的细菌归属于23个门,主要分布在变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)等。其中Proteobacteria为优势菌,占比44.15%~47.04%。不同处理之间没有显著差异。
各处理番茄根际土壤中鉴定得到的真菌主要来自8个门,其中子囊菌门(Ascomycota)、油壶菌门(Olpidiomycota)、担子菌门(Basidiomycota)为优势菌。各处理中根际土壤真菌群落结构构成相近,但臭氧水处理番茄根际土壤各真菌类群所占比例发生了明显的变化,如臭氧水与菌剂组合可显著增加子囊菌门和油壶菌门的相对丰度。
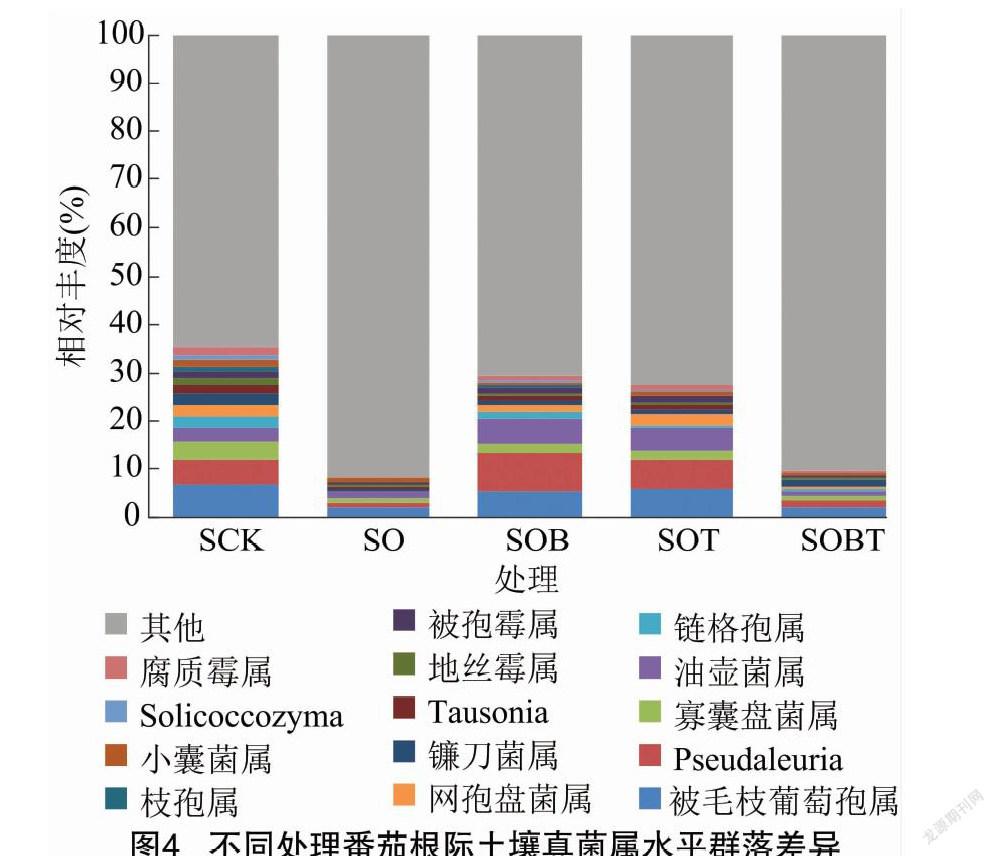
根据物种注释结果,选取每个样品在各分类属水平上最大丰度排名前14的物种,生成物种相对丰度柱形累加图(图4)。分析表明,臭氧水处理可使番茄根际土壤真菌群落组成发生显著改变,被毛枝葡萄孢属(Botryotrichum)、链格孢属(Alternaria)、镰刀菌属(Fusarium)、被孢霉属(Mortierella)等相对丰度减少。其中臭氧水与T11-W和B418联合处理组SOBT的链格孢属相对丰度降低97.61%,镰刀菌属相对丰度降低42.27%。
3 讨论与结论
土壤中根结线虫群体密度与作物的受害程度关系密切[25],准确检测和定量根结线虫群体密度对病害防治至关重要。实时荧光PCR技术已广泛应用于植物病原菌和线虫的定量检测中,本研究利用SYBR Green Ⅰ染料,采用南方根结线虫特异性引物MIITS7-F/MIITS127-R和循环阈值(Cq)(r2=0.983 8),建立了不同线虫数量的高质量标准曲线,可用于定量检测土壤样品中南方根结线虫的数量。
在根结线虫群体密度低的情况下,生防菌可通过产生代谢物或者提高植物抗逆性来实现根结线虫病的防治作用,但若群体密度过高,生防效果将大打折扣。本研究在定植前浇灌8 mg/L臭氧水,可降低根结线虫群体密度,再接种哈茨木霉、越南伯克霍尔德氏菌,植入大量的有益微生物,不仅可以通过竞争抑制根结线虫,同时还可诱导植物抗性,促进植物生长,呈现增效作用,对番茄株高和鲜质量分别增加61.64%和90.90%,对根结线虫病的相对防效达到69.95%。
臭氧极强的灭生性氧化作用,不仅能抑制线虫的存活,对土壤中有益微生物也会产生影响。在臭氧处理对土壤微生物群落结构的影响方面尚存在争议,如王永强等研究认为,臭氧水喷洒对设施植物根际微生物群落多样性影响不大[26],而陈展等的试验则表明,高浓度臭氧水可抑制小麦土壤微生物总量,降低微生物多样性指数[27]。本研究发现 8 mg/L 臭氧水浇灌处理6周后,细菌和真菌的群落结构并未发生显著变化。但臭氧水与菌剂联合处理可降低细菌的丰富度,增加真菌群落多样性和丰富度,进一步分析发现,臭氧水及菌剂组合可显著降低链格孢属、镰刀菌属等潜在植物病原真菌的相对丰度。扈进冬等研究发现,哈茨木霉LTR-2拌种可以增加小麦根际真菌群落的丰富度[28],说明臭氧水与菌剂组合处理对番茄根际土壤微生物群落的影响主要是由于菌剂的作用引起的。
综上所述,臭氧水与哈茨木霉T11-W和越南伯克霍尔德氏菌B418制剂联合,具有协同增效作用,能够有效防治番茄根结线虫病害,增加植株鲜质量,显示出较好的防病和增产效果,二者联用可替代部分化学农药。臭氧水与菌剂联用还增加了根际土壤真菌群落多样性和丰富度,降低镰刀菌等潜在植物病原真菌的相对丰度,促进了植物根系发育和作物生长。
参考文献:
[1]段玉玺,吴 刚. 植物线虫病害防治[M]. 北京:中国农业科学技术出版社,2002.
[2]彭德良. 蔬菜病虫害的综合治理(十):蔬菜线虫病害的发生和防治[J]. 中国蔬菜,1998(4):57-58.
[3]王宏宝,李 茹,付佑胜,等. 保护地蔬菜根结线虫的发生规律及病害防治研究进展[J]. 现代农业科技,2010(1):205-206.
[4]Yang L L,Huang Y,Liu J,et al. Lysinibacillus mangiferahumi sp.nov.,a new bacterium producing nematicidal volatiles[J]. Antonie Van Leeuwenhoek,2012,102(1):53-59.
[5]胡安東,梁 晨,于维霞,等. 臭氧水对番茄根结线虫病的防治效果[J]. 蔬菜,2019(11):55-59.
[6]Dahlin P,Eder R,Consoli E,et al. Integrated control of Meloidogyne incognita in tomatoes using fluopyram and Purpureocillium lilacinum strain 51[J]. Crop Protection,2019,124:104874.
[7]Ghahremani Z,Escudero N,Beltrán-Anadón D,et al. Bacillus firmus strain I-1582,a nematode antagonist by itself and through the plant[J]. Frontiers in Plant Science,2020,11:796.
[8]Manzanilla-López R H,Esteves I,Finetti-Sialer M M,et al. Pochonia chlamydosporia:advances and challenges to improve its performance as a biological control agent of sedentary endo-parasitic Nematodes[J]. Journal of Nematology,2013,45(1):1-7.
[9]李 瑞,李惠霞,谢丙炎,等. 长枝木霉菌株TL16防治南方根结线虫的作用机理[J]. 植物保护学报,2020,47(2):384-393.
[10]Fan H Y,Yao M L,Wang H M,et al. Isolation and effect of Trichoderma citrinoviride Snef1910 for the biological control of root-knot nematode,Meloidogyne incognita[J]. BMC Microbiology,2020,20(1):299.
[11]李善梅,李纪顺,徐维生,等. 生防菌剂YKT41及B418防治茄子根结线虫病的田间试验[J]. 山东科学,201 4(5):10-13.
[12]赵 鑫,董立新,安立娜,等. 臭氧对韭菜迟眼蕈蚊的室内毒力及其安全性评价[J]. 植物保护学报,2016,43(6):1001-1006.
[13]徐冬颖,史君彦,郑秋丽,等. 臭氧处理对菠菜采后保鲜效果的影响[J]. 北方园艺,2018(12):125-130.
[14]Veronico P,Paciolla C,Sasanelli N,et al. Ozonated water reduces susceptibility in tomato plants to Meloidogyne incognita by the modulation of the antioxidant system[J]. Molecular Plant Pathology,2017,18(4):529-539.
[15]Guo Z H,Wang Q X.Efficacy of ozonated water against Erwinia carotovora subsp. carotovora in Brassica campestris ssp. chinensis[J]. Ozone(Science & Engineering),2017,39(2):127-136.
[16]Kobayashi F,Ikeura H,Ohsato S,et al. Disinfection using ozone microbubbles to inactivate Fusarium oxysporum f. sp. melonis and Pectobacterium carotovorum subsp. carotovorum[J]. Crop Protection,201 30(11):1514-1518.
[17]王贻莲,李纪顺,杨合同. 木霉菌株T11-W的鉴定及其对南方根结线虫卵的寄生性研究[J]. 山东科学,2014,27(6):38-42.
[18]Hussey R S,Barker K R. A comparison of methods of collecting inocula of Meloidogyne spp.,including a new technique[J]. Plant Disease Reporter,1973,57:1025-1028.
[19]Gorny A M,Wang X H,Hay F S,et al. Development of a species-specific PCR for detection and quantification of Meloidogyne hapla in soil using the 16D10 root-knot nematode effector gene[J]. Plant Disease,2019,103(8):1902-1909.
[20]Zhao Y L,Ruan W B,Yu L,et al. Combining maxRatio analysis with real-time PCR and its potential application for the prediction of Meloidogyne incognita in field samples[J]. Journal of Nematology,2010,42(2):166-172.
[21]张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 4版.北京:高等教育出版社,2009.
[22]刘维志. 植物病原线虫学[M]. 北京:中国农业出版社,2000.
[23]Li J H,Philp J,Li J S,et al. Trichoderma harzianum inoculation reduces the incidence of clubroot disease in Chinese cabbage by regulating the rhizosphere microbial community[J]. Microorganisms,2020,8(9):1325.
[24]Caporaso J G,Lauber C L,Walters W A,et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. PNAS,201 108(S1):4516-4522.
[25]葛俊杰,王延红,刘长仲. 南方根结线虫初始接种量对番茄生长的影响及防治指标研究[J]. 甘肃农业大学学报,2016,51(5):57-61.
[26]王永強,李英东,郭正红,等. 臭氧水对土壤微生物群落的影响[J]. 上海师范大学学报(自然科学版),2018,47(6):688-696.
[27]陈 展,王效科,段晓男,等. 臭氧浓度升高对盆栽小麦根系和土壤微生物功能的影响[J]. 生态学报,2007,27(5):1803-1808.
[28]扈进冬,吴远征,魏艳丽,等. 木霉拌种剂对小麦根际土壤真菌群落多样性的影响[J]. 山东科学,2019,32(1):46-51.

