30%氟乐灵微囊悬浮剂的制备与性能研究
鲁陈琳 秦敦忠


















摘要:氟乐灵是一种广泛适用于一年生禾本科杂草的芽前除草剂,为改善氟乐灵在使用过程中易光解、易挥发引起的利用率低、持效期短等问题,通过界面聚合法以氟乐灵为原药,制备了30%氟乐灵微囊悬浮剂,研究了乳化剂、芯材溶剂、保护胶体和其他助剂在微囊制备中的影响,并通过添加表面活性剂来改善微囊悬浮剂界面性能以调控微囊释放速率。结果表明,以150#芳烃溶剂油为芯材溶剂、SP-27001为乳化剂、质量分数3% XG为保护胶体、SP-2206为分散剂,最后加入硅酸镁铝、丙三醇、黄原胶、凯松,可得到达标的氟乐灵微囊悬浮剂。性能表征结果表明,所得悬浮剂性能指标达标,微囊形貌良好且分布均匀,D为6.260 μm,有效含量30.7%,悬浮率98%,物理稳定性良好,加入助剂SP-4028的微囊释放速率可达乳油剂释放水平,对早熟禾防效显著,与乳油剂基本处于同一水平。
关键词:氟乐灵;微囊悬浮剂;界面性能;释放速率
中图分类号:TQ450.6 文献标志码:A
文章编号:1002-1302(2022)11-0108-11
收稿日期:2021-12-30
基金项目:江苏精禾界面科技有限公司基金。
作者简介:鲁陈琳(1997—),女,安徽马鞍山人,硕士研究生,主要从事农药制剂研究。E-mail:819605404@qq.com。
通信作者:秦敦忠,博士,研究员,主要从事高分子表面活性剂研究。E-mail:qindz@126.com。
氟乐灵是一种毒性低的除草剂,属于二硝基苯胺类,在澳大利亚被广泛应用于农田杂草防治中。现阶段氟乐灵的主流制剂是48%氟乐灵乳油剂,但氟乐灵光解性强,存在持效期短、药效低等问题。乳油制剂中含有大量有机溶剂,对环境不友好,也会影响施药者的健康。微囊是具有核壳结构的微米级颗粒,农药微囊剂包括囊壁、囊芯2个部分,囊芯是农药的有效成分,囊壁是成膜的高分子材料。将氟乐灵制成微囊剂可以有效减少光解,提高农药实际药效,减少施药频次,且水溶性的微囊制剂可以降低由氟乐灵本身颜色导致的对施药设备和加工设备的清洗难度。
界面聚合法简便,对聚合单体的纯度要求不高,反应速度快。本研究壁材使用聚脲,结合界面聚合法,制备了30%氟乐灵微囊悬浮剂。考察了芯材溶剂、乳化剂、保护胶体等因素对微囊粒径分布和动力学不稳定性的影响。通过光学显微镜、红外光谱、多重光散射稳定性分析仪、场发射扫描电镜、热重分析仪等仪器对所制备的氟乐灵微囊悬浮剂进行性能表征,确定最佳配方。由于微囊的缓慢释放特性,其药效与乳油剂的相比,相差甚远。本研究通过添加表面活性剂以调控氟乐灵微囊剂的界面性能,达到调控微囊释放的目的。通过载玻片干燥法、動态透析法结合高效液相色谱分析对制剂的释放性能进行表征,筛选合适的表面活性剂,以期达到与氟乐灵乳油剂同等药效,通过室内生测试验检测对早熟禾的防效。
1 材料与方法
1.1 试验材料和仪器
96%氟乐灵原药,购自江苏丰山集团有限公司;二苯基甲烷二异氰酸酯(MDI),购自信科(山东)化学科技有限公司;四亚乙基五胺,购自山东佰斯特新材料有限公司;640#醚类溶剂油、620#醚类溶剂油、600#醚类溶剂油、300#酯类溶剂油、150#芳烃溶剂油,购自艾特(山东)新材料有限公司;乳化剂 SP-27001(苯乙烯丙烯酸酯共聚物钠盐)、乳化剂YL-T08(脂肪胺聚氧乙烯醚)、乳化剂SP-7123(马来酸酐共聚水解物)、乳化剂BY-125(蓖麻油聚氧乙烯醚)、分散剂SP-2206(木质素磺酸盐),购自江苏擎宇化工科技有限公司;有机硅消泡剂,购自济南浚海化工有限公司;硅酸镁铝(工业级),购自江苏润丰合成科技有限公司;黄原胶(工业级)、明胶(工业级),购自济南明宁生物工程有限公司;聚乙烯醇(2099),购自山东开普勒生物科技有限公司;丙三醇(工业级),购自济南创世化工有限公司;凯松(工业级),购自南京古田化工有限公司;SP-6535(植物油聚氧乙烯醚)、SP-4028(聚硅氧烷聚氧乙烯醚),购自江苏擎宇化工科技有限公司。
高剪切分散乳化机(QWL750CY),购自上海全简机电有限公司;精密增力电动搅拌器(98-2),购自上海霓玥仪器有限公司;数显恒温水浴锅,购自无锡玛瑞特科技有限公司;光学显微镜(N-300M),购自浙江纳德科学仪器有限公司;激光粒度分布仪(HL2020-L),购自北京海鑫瑞科技有限公司;场发射扫描电子显微镜(Regulus8100),购自日本日立公司;红外光谱仪(Nicolet iS10),购自美国赛默飞公司;液相色谱仪(Agilent 1260),购自美国安捷伦公司;全自动表面张力计(JYW-200A),购自承德金和仪器制造有限公司;热重分析仪(TG 209 F3 Tarsus),购自德国耐驰机械仪器有限公司;多重光散射稳定性分析仪(Turbiscan TOWER),购自法国Formulation公司。
1.2 氟乐灵微囊悬浮剂的制备
1.2.1 微囊合成原理 本试验使用对苯基甲烷二异氰酸酯为油性壁材单体、四亚乙基五胺为水性壁材单体。由于体系中有大量水,异氰酸酯在水中反应生成氨基甲酸并迅速分解成胺和二氧化碳,反应方程如式(1)所示:
。(1)
生成的胺和加入的四亚乙基五胺进一步和异氰酸酯反应,生成聚脲。异氰酸酯和胺的反应速率很快,反应方程如式(2)所示:
。(2)
异氰酸酯和胺在乳滴表面迅速反应生成聚脲囊壳,如图1所示。
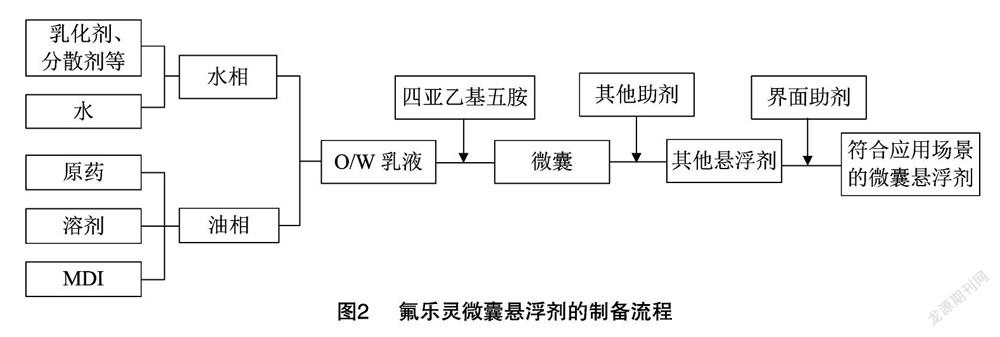
1.2.2 微囊悬浮剂制备方法 制备过程见图2。
(1)制备水相:在烧杯中加入一定量的乳化剂、消泡剂、分散剂、水,加热至65℃,分散均匀得到水相。(2)制备油相:在另一烧杯中按比例加入氟乐灵原药溶解于溶剂,加热至65℃,添加油相单体 MDI,使之充分混合以获得油相。(3)剪切乳化:在水相中加入油相,同时高速剪切进行乳化,得到水包油(O/W)乳液。(4)聚合成囊:转移至四口烧瓶中继续搅拌,同时缓慢滴加水性单体。(5)保温固化:保持低速搅拌,保温固化一定时间。(6)调悬浮:按比例加入悬浮分散剂、防冻剂、增稠剂、防腐剂等助剂,并补加适量水,加以混合得到悬浮剂。(7)界面性能调控:按照使用浓度稀释,并加入一定比例的表面活性剂调控界面性能,以得到符合应用场景释放速率的微囊悬浮剂。
1.3 性能表征
1.3.1 微囊形态观察及粒径测定 显微镜观察:分别在剪切乳化、保温固化后,取少量氟乐灵微囊用清水稀释10倍,用400倍放大的光学显微镜观看和拍摄。扫描电子显微镜观察:将制备好的氟乐灵微囊干燥后均匀地粘贴到导电胶上,通过离子溅射仪镀金,观察微囊的表面形貌。
1.3.2 微囊红外分析 红外光谱分析采用溴化钾压片法,采用Nicolet iS10型红外光谱仪对氟乐灵原药、MDI、氟乐灵微囊进行表征分析。红外光谱仪扫描范围为4 000~5 000 cm,分辨率为4.0 cm。
1.3.3 载玻片干燥试验 取适量微囊悬浮剂,用去离子水稀释150倍后,用移液枪将20 μL稀释液滴在载玻片上,25℃下自然晾干。通过光学显微镜观察载玻片晾干不同时间后囊型的变化,定性判断释放速率。
1.3.4 动态透析释放试验 称取一定量的氟乐灵微囊加去离子水制成稀释150倍的悬浮液,加入一定量的表面活性剂,装入透析袋中,将透析袋两端夹紧置于盛有250 mL甲醇的具塞蒸馏瓶内,25℃下以200 r/min搅拌,定时取出1 mL的透析介质,并以相同量的甲醇補足。将30%氟乐灵乳油剂加蒸馏水稀释150倍置于半透膜中,同样条件下搅拌取样,测其释放量。通过 HLPC检测释放出的有效成分量。
1.3.5 动力学不稳定性分析 采用法国Formulaction公司的Turbiscan TOWER型多重光散射稳定性分析仪分析氟乐灵乳液的动力学不稳定性(TSI)。通过测定反射和反射的光强度,可以求出特定的剖面密度或粒子尺寸的改变。将样品摇晃均匀,装入适量样品至样品瓶中,保证顶部半月面不产生气泡且半月面以上的样品瓶干净无样品沾壁。缓慢将样品瓶放入检测室,检测温度为25℃。检测结果TSI数值越小,表示动力学稳定性越好。
1.3.6 微囊热重分析 采用德国Netzsch公司的TG 209 F3 Tarsus型热重分析仪分析氟乐灵微囊的热稳定性,以氮气作为吹扫气和保护气。称取微量微囊产品放入坩埚,压片封口,放入热重分析仪中,升温速率20℃/min,氮气流速20 mL/min,升温范围30~800℃。
1.3.7 其他制剂控制项目指标检测 按照《ManualOn development and useOf FAO and WHO specifications for pesticides》(2010)中关于微囊悬浮剂的各项性能指标,研究所制备的氟乐灵微囊悬浮剂的特性。
1.3.8 室内生测试验
1.3.8.1 试验地点 试验地点在江苏省仪征市,在温室内对一年生冬季杂草早熟禾进行靶标试验。
1.3.8.2 试验条件 温度:10~30℃(短期夜晚达到过0℃),相对湿度75%~90%,试材管理同温室栽培管理条件一致。
1.3.8.3 试验依据 根据《农药室内生物活性测定试验准 除草剂 第三部分:活性测定试验 土壤喷雾法》(NY/T 1155.3—2006)对氟乐灵微囊悬浮剂进行室内生测试验。
1.3.8.4 试验设计 试验土壤采用腐殖土50%、黄土25%、黄沙25%,试验前进行高温灭菌处理。试验土壤定量装至盆钵3/5处,每盆播种早熟禾种子1 g,每盆计1个重复,重复5次。用镊子将种子均匀混拌在表层1~2 cm土层内,然后根据种子大小覆土0.5~2.0 cm;用盆底渗透法灌溉,充分保持土壤水分,静置24 h后进行移液枪均匀滴灌处理。然后土壤表面再覆土0.5~2.0 cm,缓解氟乐灵见光分解特性。
1.3.8.5 调查内容和统计方法 施药后对杂草的萌发状况进行观察和跟踪,分别在药后20、34、60 d 调查早熟禾株数,最后1次同时调查鲜质量。利用SPSS分析软件对调查数据进行显著性对比,以评估不同的处理方式对早熟禾的防治作用。
根据调查结果,按照公式(3)(4)计算早熟禾株防效和鲜质量防效。
株防效=空白对照区杂草株数-处理区杂草株数空白对照区杂草株数×100%;(3)
鲜质量防效=空白对照区杂草鲜质量-处理区杂草鲜质量空白对照区杂草鲜质量×100%。(4)
2 结果与分析
2.1 芯材溶剂的筛选
氟乐灵原药在室温下为橘黄色晶体,加热融化后为液体,直接制备的微囊悬浮剂黏度过大、流动性差,且易破囊析晶,需要加入适当溶剂调节成黏度合适的油相,才能将其均匀包覆。制备氟乐灵微囊悬浮剂要求芯材溶剂对原药有较高的溶解度,性质稳定,不与囊壁材料发生反应。640#、620#、600#、200#、150#属于绿色环保型溶剂,且满足以上条件,选其作为考察的芯材溶剂,制备氟乐灵微囊悬浮剂。通过光学显微镜观察微囊形貌,结合冷贮热贮稳定性试验结果确定芯材溶剂种类,试验结果见表1。150#制备的氟乐灵微囊形貌圆整,冷热贮流动性好,选其作为芯材溶剂。
2.2 乳化剂的筛选
乳化是指旧的水油界面被打破形成新的两相界面的过程,通常情况下,两亲表面活性剂都是有亲水性和亲油性的,在水油界面降低界面张力从而稳定液滴抑制聚集。乳化剂的性质是影响分散相液滴大小和乳液稳定性的关键因素。本试验选择了4种乳化剂,从乳化结果来看,使用SP-27001制备的乳滴形状圆整,大小均一,流动性好,效果最好(表3)。因此选择SP-27001作为本研究的乳化剂。
表3 乳化剂种类对微囊制备的影响
乳化剂乳化现象 SP-27001囊形圆整,流动性好
YL-T08粒径太大,结底膏化
SP-7123粒径太小,固化粘连
BY-125粒径均匀,但乳化不均,游离偏多
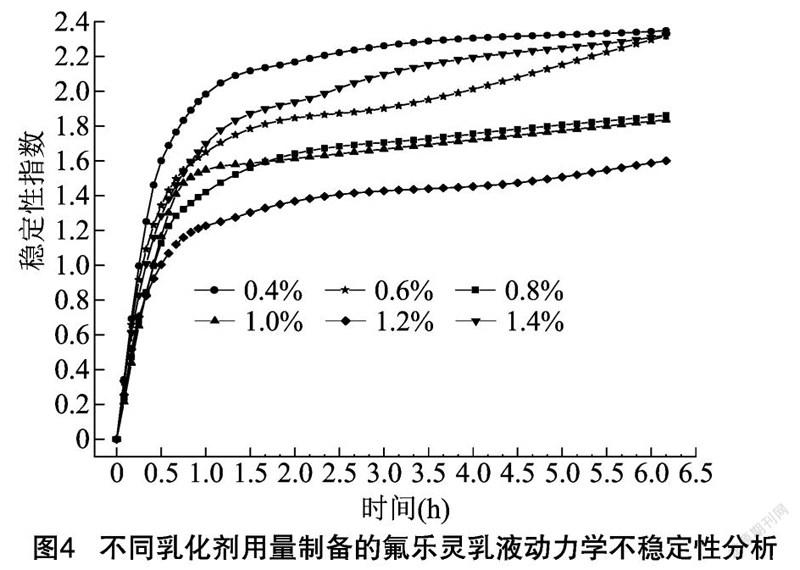
乳化剂用量对粒径分布、乳滴形态和乳液稳定性都有影响(表4)。选用SP-27001作为乳化剂,在65℃、10 000 r/min下剪切2 min,考察不同添加量下乳液的粒径分布、静态表面张力、乳化状态和乳液稳定性。SP-27001用量小于0.6%时,由于体系中表面活性剂分子少,亲水亲油基团分别吸附在水油界面,形成的新水油界面的面积较小 ,因此乳滴粒径较大,由光学显微镜图(图3-a、图3-b)可以看到有大颗粒不规则乳滴。SP-27001用量达到1.2%后,结合光学显微镜图(图3-e、图3-f)可见,乳滴粒径基本不变,形状圆整,大小均一。结合多重光散射的动力学不稳定性结果可见,SP-27001用量1.2%时,TSI指数最小,表明乳液稳定性最好(图4)。
2.3 保护胶体对乳化的影响
胶体的保护作用指的是,把亲水胶体溶液加入到疏水胶体溶液中时,会有一层亲水胶体附着在胶粒表面,阻止了胶体之间的接触而提高其稳定性。保护胶体可以降低连续相的界面张力使其具有相对较高的黏度,同时在分散相油滴表面形成双电层起到暂时的稳定作用,可在剪切乳化阶段得到粒径较小的微囊。本研究选取明胶、壳聚糖、聚乙烯醇、黄原胶4种保护胶体,考察不同保护胶体对乳化剪切的影响,最终选出一种最适合制备氟乐灵微囊的保护胶体,结果如表5所示。
从乳化现象来看,以黄原胶作为保护胶体得到的乳滴形态圆整,大小均一,是本研究中最合适的保护胶体。在制备微囊过程中,黄原胶其主要功能有2个方面:乳化分散性和带电效应。表现为减少油相在水相中的表面张力,通过将电荷供给到分散的油滴的表面,或形成一种空间的位阻作用,以防止油滴间的结合。在油水2种界面之间可以形成一种防护膜,可以有效阻止油滴相互聚合,防止颗粒尺寸增大,从而达到保护胶体的目的,避免加热固化阶段微囊粘连。
保护胶体的用量也会影响微囊的稳定性、粒度大小和粒度分布。研究质量分数3% XG水溶液的不同添加量对氟乐灵微囊乳化粒径的影响以及乳液的动力学不稳定性,结果见表6。未添加质量分数3% XG时,氟乐灵微囊的D为7.58 μm,随着黄原胶水溶液添加量的增多,粒径减小。当质量分数3% XG添加量为0.50%时,氟乐灵微囊的D达到最小值6.23 μm;继续添加黄原胶,粒径增大。这是因为在体系中加入保护胶体后,其中一定量的保护性胶质附着于芯材表面,在芯材表面形成一层水化膜,起到阻止颗粒碰撞和凝结的作用。而在水相中溶解的保护性胶体会使乳液连续相中黏度增大,颗粒聚集的概率降低,颗粒尺寸减小,颗粒尺寸均匀,颗粒表面更加平滑。但添加过量的保护性胶体,会使微胶囊的平均尺寸增大,且颗粒尺寸分布更宽。这是由于保护胶质含量过高而导致乳剂的黏性过高。在乳化时,因其他因素一致,乳剂的黏度过高使其乳化性能变差,难以在较高的保护性胶质浓度下生成尺寸颗粒均匀,粒径分布较窄的微胶囊。同时结合乳液的动力学不稳定性分析结果,确定质量分数3% XG用量为0.5%时,乳液TSI数值最小,乳液的稳定性最好(图5)。
2.4 氟乐灵微囊悬浮剂优化配方的确定
为制得稳定的微囊悬浮剂产品,制备工艺也非常重要。通过对剪切时间、温度、速率、固化时间、温度的考察,最终确定在65℃,10 000 r/min下剪切2 min,65℃下固化5 h可制備得稳定的微囊。为了在固液体系中使微囊保持一定的物理稳定性,本研究还筛选了分散剂及悬浮助剂。通过筛选,最终确定30%氟乐灵微囊悬浮剂配方:分散剂选用 SP-2206,用量为2.4%;SP-27001作乳化剂,用量为1.2%;保护胶体选用质量分数3% XG,用量为0.5%;芯材溶剂选用150#芳烃溶剂油,油相中占比30%;硅酸镁铝作增稠剂,用量为8%;丙三醇作抗冻剂,用量为3%;防腐剂选用凯松(异噻唑啉酮),用量为0.2%。
3 微囊悬浮剂的检测表征
3.1 氟乐灵微囊形貌分析
将氟乐灵微囊悬浮剂稀释10倍,在光学显微镜下察看微囊形态;通过扫描电子显微镜察看微囊的表观样貌。结合氟乐灵微囊的光学显微镜图和扫描电镜图,可看到微囊粒径均一,形貌圆整,分散均匀,且聚脲壁材表面光滑(图6)。
3.2 氟乐灵微囊粒度分析
通过Bettersize2600 型激光粒度分布仪测定氟乐灵微囊固化前后的粒径分布,计算粒径分散度δ值。将仪器误差考虑在内,可见固化前后的微囊D、D变化很小,粒径分布曲线均接近正态分布,说明配方稳定,固化条件合适(图7)。粒径分散数δ值与粒径分布呈正相关,粒径分散数越小表示粒径分布越窄,分散性越好。固化前的δ为1.751,固化后的δ为1.626,固化之后δ更小了,粒径分布曲线也更窄,说明分散性更好。
3.3 氟乐灵微囊结构分析
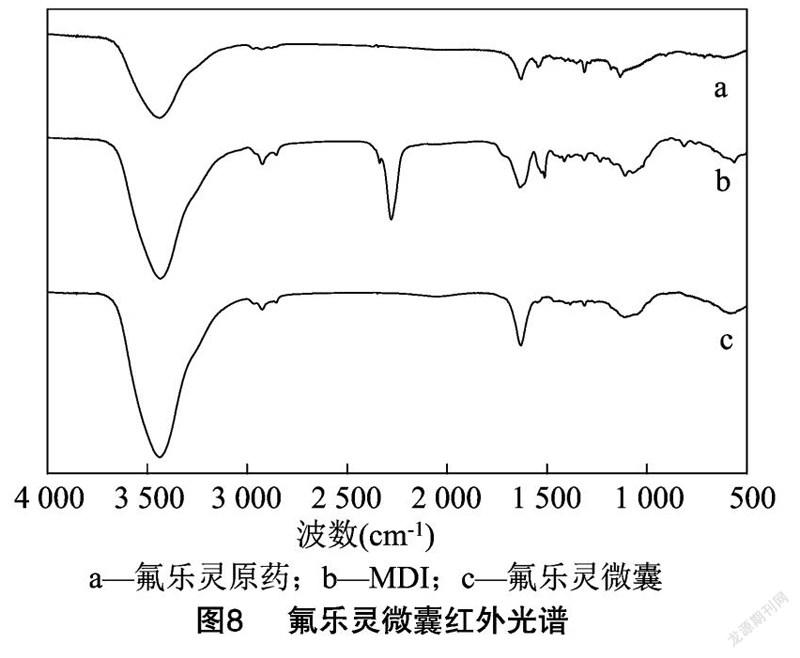
采用傅里叶转换红外光谱(FTIR)对原药、壁材单体 MDI、氟乐灵微胶囊进行了IR分析,从而可以对壁材单体进行检测。如图8所示,在壁材单体MDI图谱中,在 2 270 cm 处具有明显的异氰酸酯基(—NCO)的吸收峰,与氟乐灵的微囊相比较,这里的吸收峰已经消失,说明 MDI在系统中已反应完全且无残留基团。
3.4 微囊热重分析
由氟乐灵原药的TGA谱图(图9)可知,氟乐灵原药的质量损失只有一个阶段,开始于140℃,结束于260℃,质量损失约97%。氟乐灵微囊有3个失质量阶段,第1个阶段是在100℃,微囊表面水分失质量约1%;第2阶段是囊芯原药的失质量初始于140℃,与纯原药的初始分解温度一致;但是终止分解温度(300℃)大于纯原药的终止分解温度(260℃)。且从曲线的斜率可以看到,从140℃到 260℃,微囊的失质量速率明显小于纯原药的失质量速率,说明聚脲壁材对囊芯原药起到了一定的隔热保护作用,一定程度上提高了氟乐灵原药的热稳定性。
3.5 制剂控制项目指标检测
氟乐灵微囊悬浮剂的其他制剂指标测定方法均参照微囊悬浮剂质量标准及检测方法进行,结果表明该制剂达标。氟乐灵微囊悬浮剂性能表征结果见表7。
3.6 表面活性剂调控氟乐灵微囊悬浮剂的释放性能
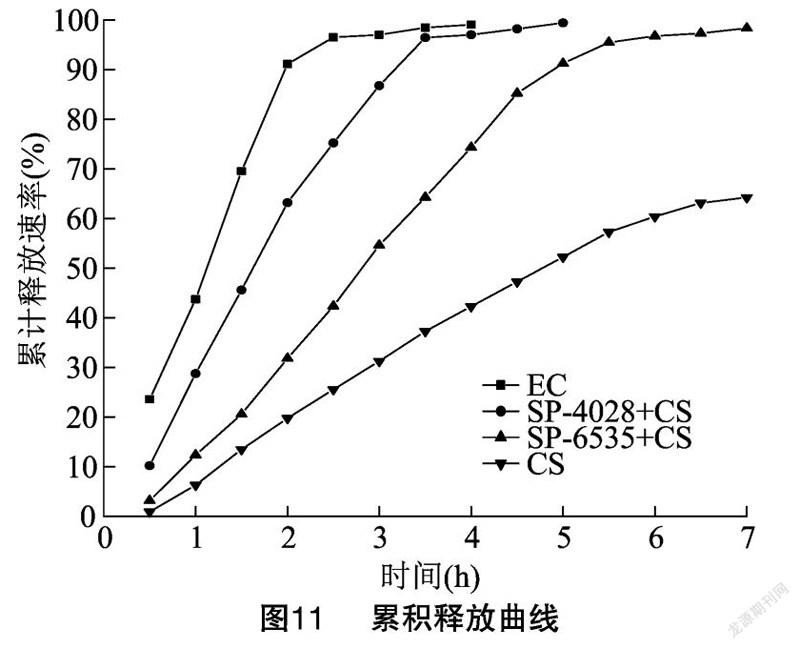
农药微囊的界面特性主要受囊壁高分子材料的影响。农药微囊的界面性能不同,微囊的释放速率和释放方式差别很大,直接影响最终使用药效。为了能充分发挥氟乐灵微囊悬浮剂的优点,本研究使用载玻片干燥法先定性分析释放,再结合动态透析释放试验定量考察了SP-6535、SP-4028这2种表面活性剂(添加量0.05%)对氟乐灵微囊释放速率的影响,并与30%氟乐灵乳油剂做了对比。
由图10-a、图10-b可见,CS干燥1 h囊形基本完好,干燥5 h小囊先破裂,大部分微囊仍呈圆整形态,说明CS是缓慢释放型。由于EC没有囊壳,在干燥1 h时大量析晶,5 h时晶体已经溶解为液斑,液斑比晶体更方便在土壤中淋溶发挥药效,属于瞬时速释型,如图10-c、图10-d所示。而加了SP-6535、SP-4028的CS聚集减少,分散性更好。由图10-e、图10-f可看出,加入SP-6535的CS干燥 1 h 时部分小囊已破裂,干燥5 h时大囊开始破裂,与未加表面活性剂的CS的释放情况相比,加入 SP-6535 一定程度上加速了CS的释放。加入 SP-4028 的干燥释放如图10-g、图10-h所示,1 h 时CS大量破囊形成大片液斑,只有少量大囊还保持囊形,5 h时囊已全部破裂,视野内全是液斑,接近EC的释放速率。
通过动态透析释放试验定量判断释放的速率,结果如图11所示。因为乳油本是速释型剂型,为了方便与微囊对比,本试验把缓释介质中能检测到的有效成分含量作为乳油的释放量,实际中乳油剂是瞬时释放,释放速率更快。由图11可知,在1 h时,EC有43%的累计释放量,在实际使用时是速释型;在3 h时达到97%,可见乳油剂的释放速率非常快。未加任何表面活性剂的CS的累积释放率相对较慢,在1 h时释放6%,5 h释放仅52%,相对EC是一种缓慢释放型。加入SP-4028的CS在1.5 h累计释放45%,而加入SP-6535的CS在1.5 h仅释放20%,可见SP-4028对微囊释放的促进效果更明显,释放速率更加接近乳油剂,这与载玻片干燥法观察到的释放现象一致。SP-6535是植物油表面活性剂,绿色环保安全,有一定的促进释放作用,SP-4028是有机硅类表面活性剂,有优异的润湿性能并且可明显提高释放速率,但若使用不当易造成药害,应根据实际应用场景和需求选择适合的表面活性剂。
3.7 室内生测试验
采用30%氟樂灵乳油、30%氟乐灵CS与加了SP-4028的30%氟乐灵CS以960 g/hm的处理量防除早熟禾,选择药后20、34、60 d分别调查出苗数,计算株防效和鲜质量防效,结果见表8。结果显示,CS防效最低,加了SP-4028的CS与EC之间差异不显著,结合5%水平的差异显著性分析,防效基本处于同一水平。未加任何表面活性剂的CS对早熟禾的封闭除草防效较低,达不到预期防治效果,表明囊壳对氟乐灵确实有效包裹。在施药20 d时,加了SP-4028的CS的防效接近EC,这主要是因为加了SP-4028的CS在施药初始有速释效果,从34、60 d的结果可见有一定的持效性。
4 讨论与结论
据相关统计,全球每年约施用7 000 t二硝基苯胺类农药,约占全球除草剂使用总量的1%,其中氟乐灵约有4 400 t,主要用于棉花、苜蓿和大豆。在一些地区氟乐灵的使用量占比远高于全球数据,比如在澳大利亚,氟乐灵的使用量位居所有除草剂种类的第2位,仅次于草甘膦。但是,氟乐灵的毒性作用并不限于杂草,对作物和天然植物也有防除作用。近年来有研究表明氟乐灵可能影响线粒体功能,对微型动物和大型动物均有毒性作用。目前氟乐灵已有的登记剂型只有乳油剂,乳油剂使用浓度大,易产生药害,且使用时需混土处理,劳动量大。在追求环保、绿色、高效的今天,氟乐灵乳油剂已无法满足使用需求,只有改变现有剂型。农药微囊化作为一种高技术含量的新型农药剂型,在保持现有剂型的优点的同时,可满足更安全更经济且可持续发展的要求。
有关氟乐灵制备成微囊剂的研究已有诸多报道。董红强等通过原位聚合法,以脲醛树脂为壁材制备了含量10%、粒径20 μm的氟乐灵微囊悬浮剂,但用二甲苯作为溶剂,且会用到有毒物质甲醛,不符合安全绿色的要求。刘亚静等使用的壁材是甲基丙烯酸甲酯(MMA)和壳聚糖(CS),通过原位聚合法制备了氟乐灵微囊。王宁等以聚羟基烷酸酯为壁材,采用溶剂挥发法制备氟乐灵微囊,所得氟乐灵微囊呈球形,平均粒径为7 μm。Cao等以可生物降解的聚(3-羟基丁酸-co-4-羟基丁酸酯)(PHB)聚合物为壁材,使用溶剂挥发法开发了PHB-氟乐灵微囊。
本研究通過界面聚合法以氟乐灵为原药,制备了30%氟乐灵微囊悬浮剂,并通过表面活性剂调控微囊界面性能达到乳油释放速率。确定了最佳配方为芯材溶剂用150#芳烃溶剂油;SP-27001作乳化剂,用量为1.2%;胶体保护剂选用质量分数3% XG,用量为0.5%;分散剂用SP-2206,用量为2.4%;芯壁比为100∶4,油性壁材选用MDI;硅酸镁铝作增稠剂,用量为8%;丙三醇作抗冻剂,用量为3%;凯松作防腐剂,用量为0.2%。用此方法制成的悬浮微胶囊剂,其理化性能达到要求,且具有较好的稳定性。所制粒径D为3.184 μm ,D为6.260 μm,粒径分布曲线接近正态分布,无拖尾,有效成分含量30.7%,悬浮率98%。微囊粒径均一,形貌圆整,表面光滑,IR结果表明无残留异氰酸酯基。加入表面活性剂SP-4028、SP-6535的微囊释放速率明显高于不加表面活性剂的微囊悬浮剂,而SP-4028可显著提高微囊的释放速率更接近氟乐灵乳油剂。室内生测结果显示,加了SP-4028的CS有速释效果和一定的持效性,与乳油剂防效相当。本研究结果为氟乐灵微囊化提供了一种新的稳定配方,并且为实际应用中的氟乐灵微囊增效使用提供了一定的理论依据。
参考文献:
[1]Donald T,Baruch S S,William M D. ReleaseOf trifluralin from starch xanthide encapsulated formulations[J]. JournalOf Agricultural and Food Chemistry,1981,29(3):637-640.
[2]Flynn A,Jackson W R,Lichti G,et al. An evaluationOf several matrices for the controlled release applicationOf trifluralin[J]. JournalOf Controlled Release,1992,18(2):101-112.
[3]路 伟,李 琳,李世奎,等. 水溶性氟乐灵纳米制剂对向日葵列当的毒力及田间药效[J]. 植物保护,2019,45(3):237-240,248.
[4]安 琼. 氟乐灵在土壤中的降解及其影响因素的研究[J]. 应用生态学报,1993(4):418-422.
[5]徐 进,陆贻通. 氟乐灵在土壤中的残留与降解[J]. 环境污染与防治,1989(3):9-10,47.
[6]魏 燚,陈佳杰,刘 建,等. 27种除草剂对荆芥安全性的初步研究[J]. 中国植保导刊,2019,39(12):64-69,63.
[7]Tsuji K,MicroencapsulationOf pesticides and their improved handling safety[J]. JournalOf Microencapsulation,2001,18(2):137-147.
[8]李北兴,张大侠,张灿光,等. 微囊化技术研究进展及其在农药领域的应用[J]. 农药学学报,2014,16(5):483-496.
[9]Li B X,Ren Y P,Zhang D X,et al. Modifying the formulationOf abamectin to promote its efficacyOn southern root-knot nematode(Meloidogyne incognita) under blending-of-soil and root-irrigation conditions[J]. JournalOf Agricultural and Food Chemistry,2018,66(4):799-805.
[10]郝 红,梁国正. 微胶囊技术及其应用[J]. 现代化工,2002(3):60-62,67.
[11]罗善国,谭惠民,张建国,等. NMR研究HDI与水的加成产物 N-100 结构[J]. 高等学校化学学报,1997,18(1):134-139.
[12]Fan C J,Zhou X D. EffectOf emulsifierOn poly(urea-formaldehyde) microencapsulationOf tetrachloroethylene[J]. Polymer Bulletin,2011,67(1):15-27.
[13]秦少雄,王 娟,张心亚,等. 乳液聚合中保护胶体的研究进展[J]. 中国胶粘剂,2005(10):47-50.
[14]巩晶晶. 氧漂稳定剂硅溶胶的制备及其性能研究[D]. 无锡:江南大学,2007.
[15]Mao C F. Self-and cross-associations in two-component mixed polymer gels[J]. JournalOf Polymer Science(Part B:Polymer Physics),2008,46(1):80-91.
[16]Higiro J,Herald T J,Alavi S,et al. Rheological studyOf xanthan and locust bean gum interaction in dilute solution:effectOf salt[J]. Food Research International,2006,40(4):165-175.
[17]Masakuni T,Takeshi T,Yukihiro T,et al. Co-gelation mechanismOf xanthan and galactomannan[J]. Colloid and Polymer Science,2010,288(10/11):1161-1166.
[18]王 璐. 原位聚合法制备脲醛树脂微囊的处方工艺和筛选[D]. 青岛:青岛科技大学,2014.
[19]安朴英,路 爽. 保护胶体对聚甲基丙烯酸甲酯热敏型微胶囊性能的影响[J]. 河北大学学报(自然科学版),2009,29(3):295-300.
[20]Maggi F,Tang F H M,La C D,et al. PEST CHEMGRIDS,global gridded mapsOf the top 20 crop-specific pesticide application rates from 2015 to 2025[J]. Scientific Data,2019,6(1):20.
[21]van Zwieten L,Rose M,Zhang P,et al. Herbicide residues in soils-Are they an issue?[C]. Grains Research & Development Corporation,2016.
[22]de BárbaraO,Lilian C P,Murilo P,et al. Do trifluralin and tebuthiuron impair isolated rat liver mitochondria?[J]. Pesticide Biochemistry and Physiology,2020,163:175-184.
[23]Vanessa V M,Larissa R N,Maria A M M,et al. ToxicityOf trifluralin herbicide in a representativeOf the edaphic fauna:histopathologyOf the midgutOf Rhinocricus padbergi(Diplopoda)[J]. Microscopy Research and Technique,2012,75(10):1361-1369.
[24]董紅强,徐好学,胡克德,等. 分散乳化条件对氟乐灵微囊悬浮剂形成状态的影响[J]. 农药,2010,49(6):416-418.
[25]刘亚静,曹立冬,张嘉坤,等. 氟乐灵微囊的制备、表征及其光稳定性研究[J]. 农药学学报,2015,17(3):341-347.
[26]王 宁,王 娅,李晓刚. 溶剂挥发法制备氟乐灵微胶囊工艺条件[J]. 塑料,2016,45(4):58-60,121.
[27]Cao L D,Liu Y J,Xu C L,et al. Biodegradable poly(3-hydroxybutyrate-co-4-hydroxybutyrate) microcapsules for controlled releaseOf trifluralin with improved photostability and herbicidal activity[J]. Materials Science & Engineering C,2019,102:134-141.

