玉米浆化学成分的分离纯化与结构鉴定
王金兰, 于彩碟, 张树军, 李 军, 时志春
(齐齐哈尔大学化学与化学工程学院,齐齐哈尔 161006)
玉米浆是玉米淀粉湿法生产工艺中的副产物之一[1]。制造玉米淀粉时,为破坏蛋白质中的—S—S—键,打破玉米粒中蛋白质网,使其包裹的淀粉释放出来,需先将玉米粒用亚硫酸氢钠水溶液浸泡,浸泡液经浓缩得到的黏稠液体即为玉米浆,其中富含糖类、可溶性蛋白质、多种氨基酸、多肽、脂肪酸、维生素、肌醇以及其他有机化合物[2],但因其中含有亚硫酸盐等因素,使得其应用受到较大限制。我国是玉米淀粉生产大国,市面上80%以上的玉米淀粉采用湿法工艺生产,玉米浆的处理问题不仅增加玉米淀粉生产成本,也给玉米产业发展带来很大影响,开发玉米浆综合利用途径对低廉、高效地回收利用玉米淀粉废水、提高玉米产业的附加值和环境保护具有重要的意义[3]。如何扩大玉米浆的应用范围,提高其附加价值,明确其中所含化学成分具有重要指导意义。关于玉米浆的化学成分,已报道的更多是以水溶性成分为主,鲜有关于其中脂溶性成分的研究报道。本研究通过醇沉、萃取等分离方法对玉米浆中脂溶性成分进行分离、纯化,并通过理化性质及波谱数据分析鉴定了其结构,为进一步扩大玉米浆应用领域提供参考。
1 材料与方法
1.1 材料与仪器
玉米浆。
X-6 显微熔点测定仪,AUTOPOL V 型旋光仪,Xevo QTOF 质谱仪,Bruker AV-600核磁共振波谱仪,SHIMADZU高效液相色谱仪:LC-20AR泵,RID-20A视差折光检测器,SunfireTMPrep C18OBDTM(19×100 mm,5 μm)不锈钢柱;Agela Technologies中压制备液相,紫外检测器,C18(120 g,40~60 μm)色谱柱;柱色谱用硅胶(200~300目);薄层色谱硅胶板。
1.2 方法
1.2.1 萃取物的制备
取玉米浆5 L,加入4倍体积的甲醇(20.0 L)充分搅拌,放置过夜后过滤,重复3次,合并滤液减压浓缩至小体积,用等体积乙酸乙酯萃取3次,合并萃取液减压蒸馏至恒重,得乙酸乙酯萃取物47.0 g。
1.2.2 萃取物的分离
取乙酸乙酯萃取物40.0 g,经硅胶柱色谱分离,依次用正己烷-乙酸乙酯(4/6, 7.0 L)、乙酸乙酯(4.0 L)、乙酸乙酯-甲醇(5/5, 6.0 L)、甲醇(4.0 L)梯度洗脱,经TLC检测合并相近流分,减压浓缩至恒重,得到4个组分(Fr. A~D)。
Fr. B (3.5 g)经硅胶柱色谱分离,依次用正己烷-乙酸乙酯(6/4, 2.0 L)、乙酸乙酯(1.0 L)、甲醇(1.0 L)梯度洗脱,经TLC检测合并相近流分,减压浓缩至恒重,得到6个组分(Fr. B-1~Fr. B-6)。Fr. B-2(543.4 mg)在流动相为甲醇-水(6/4, 体积流量4mL/min)条件下进行HPLC分离,得到5个组分(Fr. B-2-1~Fr. B-2-5);其中 Fr. B-2-2(34.5 mg)在流动相为甲醇-水(35/65, 体积流量4 mL/min)条件下进行HPLC 分离,得到化合物1(1.2 mg,tR=10.1 min)。Fr. B-2-3(17.6 mg) 在流动相为甲醇-水(6/4, 体积流量4 mL/min)条件下进行HPLC分离,得到化合物2(1.5 mg,tR=17.8 min)。Fr.B-2-4(16.8 mg)在流动相为甲醇-水(4/6, 体积流量4 mL/min)条件下进行 HPLC分离,得到化合物3(2.5 mg,tR=20.6 min)。Fr. B-2-5(8.0 mg)在流动相为甲醇-水(6/4, 体积流量4 mL/min) 条件下进行HPLC分离,得到化合物4(4.2 mg,tR=7.9 min)。Fr. B-3(288.7 mg) 在流动相为甲醇-水(6 / 4, 体积流量4 mL/min) 条件下进行 HPLC 分离,得到 2 个组分(Fr. B-3-1~Fr. B-3-2),Fr. B-3-1(28.0 mg) 在流动相为甲醇-水(2/8, 体积流量4 mL/min) 条件下进行HPLC分离,得到化合物5(2.5 mg,tR=8.0 min) 和化合物6(3.8 mg,tR=16.1 min)。Fr. B-3-2(30.0 mg)在流动相为甲醇-乙腈-水(16/9/75, 体积流量4mL/min)条件下进行HPLC分离,得到化合物7(3.1 mg,tR=20.5 min)。Fr. B-4(295.7 mg) 在流动相为甲醇-乙腈-水(22/13/65, 体积流量4 mL/min) 条件下进行 HPLC分离,得到化合物8(2.4 mg,tR=23.8 min)。Fr. B-5(398.6 mg) 在流动相为甲醇-乙腈-水(28/17/55, 体积流量4 mL/min) 条件下进行 HPLC 分离,得到 3 个组分(Fr. B-5-1~Fr. B-5-3),Fr. B-5-2(49.1 mg) 在流动相为甲醇-乙腈-水(22/13/65, 体积流量 4 mL/min) 条件下进行HPLC分离,得到化合物9(1.2 mg,tR=18.0 min)和组分Fr. B-5-2-2。Fr. B-5-2-2(13.5 mg) 在流动相为甲醇-乙腈-水(10/5/85, 体积流量4 mL/min) 条件下进行HPLC分离,得到化合物10(1.9 mg,tR=22.5 min)。
Fr. C(8.0 g) 经硅胶柱色谱分离,依次用乙酸乙酯-甲醇(9/1, 3.0 L)、乙酸乙酯-甲醇(7/3, 1.0 L)、甲醇(2.0 L) 梯度洗脱,经TLC检测合并相近流分,减压浓缩至恒重,得到6个组分(Fr. C-1~Fr. C-6);Fr. C-2(92.6 mg) 在流动相为甲醇-乙腈-水-冰乙酸(33/22/45/0.3%, 体积流量4 mL/min) 条件下进行HPLC分离,得到化合物11(5.7 mg,tR=8.5 min)。Fr. C-3(329.0 mg) 在流动相为甲醇-水-冰乙酸(40/60/0.3%, 体积流量 4 mL/min) 条件下进行 HPLC 分离,得到 3 个组分(Fr. C-3-1 ~ Fr. C-3-3),其中 Fr. C-3-2(34.7 mg) 在流动相为甲醇-乙腈-水-冰乙酸(16/9/75/0.3%, 体积流量 4 mL/min) 条件下进行 HPLC 分离,得到化合物12(5.2 mg,tR=20.4 min)。Fr. C-4(294.1 mg) 在流动相为甲醇-水-冰乙酸(40/60/0.3%, 体积流量 4 mL/min) 条件下进行 HPLC 分离,得到化合物13(2.9 mg,tR=39.5 min);其中 Fr. C-4-2(10.8 mg) 在流动相为甲醇-乙腈-水-冰乙酸(16/9/75/0.3%, 体积流量 4mL/min)条件下进行HPLC分离,得到化合物14(1.5 mg,tR=36.7 min)。Fr. C-5(715.1 mg) 在流动相为甲醇-水-冰乙酸(40/60/0.3%, 体积流量 4 mL/min) 条件下进行HPLC 离,得到化合物15(5.3 mg,tR=12.0 min)、化合物16(3.1 mg,tR=24.2 min)、化合物 17(4.9 mg,tR=35.5 min)、化合物 18(2.5 mg,tR=64.5 min);其中Fr. C-5-2在流动相为甲醇-乙腈-水-冰乙酸(10/5/85/0.3%, 体积流量4 mL/min) 条件下进行HPLC分离,得到化合物 19(15.5 mg,tR=31.3 min)。Fr. C-6(1.3 g) 经硅胶柱色谱分离,依次用正己烷-乙酸乙酯(1/9, 1.5 L)、乙酸乙酯(1.0 L)、乙酸乙酯-甲醇(8/2, 1.0 L)、甲醇(0.5 L) 梯度洗脱,经 TLC 检测合并相近流分,减压浓缩至恒重,得到化合物 20(25.2 mg);Fr. C-6-2(107.9 mg) 在流动相为甲醇-乙腈-水-冰乙酸(16/9/75/0.3%, 体积流量 4 mL/min) 条件下进行 HPLC 分离,得到化合物21(1.7 mg,tR=6.7 min) 和化合物22(2.4 mg,tR=10.7 min)。Fr. C-6-3(470.8 mg) 在流动相为甲醇-乙腈-水-冰乙酸(10/5/85/0.3%, 体积流量 4 mL/min) 条件下进行HPLC分离,得到化合物23(8.6 mg,tR=10.7 min)。
2 结果与分析
2.1 醇沉条件的选择
玉米浆中含有 30%~50%的固形物,黏度很大,直接加入有机溶剂萃取会有大量沉淀析出,使萃取操作无法正常进行。为完成萃取操作,获得其中脂溶性物质,须先采取醇沉的方式去除玉米浆中大量无机盐等强极性成分,100 mL玉米浆中加入不同体积比甲醇所得沉淀质量如表1。玉米浆与甲醇体积比为1∶4 时,所得沉淀物的质量最大,强极性成分分离相对充分,有利于后续萃取操作顺利进行,因此选择加入4倍体积甲醇进行醇沉。

表1 100 mL玉米浆中加入不同体积甲醇所得沉淀物的质量
2.2 结构鉴定
为进一步了解玉米浆的物质组成基础,对所得的23个单体化合物均通过理化性质与波谱数据分析并结合已有文献报道,鉴定其化学结构,具体过程为:
化合物1:白色粉末;mp 130~131 ℃;1H-NMR(600 MHz, CDCl3) δ: 7.08(2H, d, J = 8.4 Hz, H-2,6), 6.76(2H, d, J=8.4 Hz, H-3,5), 2.88(2H, t, J=7.8 Hz, H-2′), 2.64(2H, t, J=7.8 Hz, H-1′);13C-NMR(150 MHz, CDCl3) δ: 154.0(C-4), 132.4(C-1), 129.5(C-2, 6), 115.4(C-3,5),35.3(C-2′), 29.8(C-1′)。数据与文献报道一致[6],故鉴定为对羟基苯丙酸。
化合物2: 黄色油状液体;1H-NMR(600 MHz, CD3OD) δ: 6.80(1H, d, J = 7.8 Hz, H-2), 6.66(1H, d, H-6), 2.87(2H, t, J = 7.8 Hz, H-1′), 2.63(2H, t, J = 7.8 Hz, H-2′), 3.87(3H, s,-COOCH3), 3.65(3H, s,-OCH3);13C-NMR(150 MHz, CD3OD) δ: 173.9(-COO-), 148.0(C-5), 141.5(C-3), 131.8(C-1), 125.7(C-6), 122.7(C-4), 110.4(C-2), 55.2(-COOCH3), 50.6(-OCH3), 35.6(C-1′), 27.7(C-2′)。结合文献[5],鉴定为 3,4-二羟基-5-甲氧基苯丙酸甲酯。
化合物 4: 白色粉末;mp 50~52 ℃;1H-NMR(600 MHz, CDCl3) δ: 8.07(1H, s,-NH), 7.62(1H, d, J = 7.8 Hz, H-5), 7.36(1H, d, J=7.8 Hz, H-8), 7.26(1H, s, H-2), 7.20(1H, t, J = 7.2Hz, H-7), 7.13(1H, t, J = 7.2 Hz, H-6), 3.79(2H, s, H-1′), 3.70(3H, s,-COOCH3);13C-NMR(150 MHz, CDCl3) δ: 172.5(-COO-), 136.1(C-9), 127.3(C-2), 123.0(C-7), 122.3(C-6), 119.7(C-5), 118.9(C-4), 111.2(C-8), 108.6(C-3), 52.0(-OCH3), 31.2(C-1′)。数据与文献[7]一致,故鉴定为吲哚-3-乙酸甲酯。
化合物 7: 浅黄色脂状物;1H-NMR(600 MHz, DMSO-d6)δ: 6.78(1H, s, H-2), 6.65(1H, d, J=7.2 Hz, H-5), 6.58(1H, d, J=7.2 Hz, H-6), 3.74(3H, s,-OCH3), 2.71(2H, s, H-2′), 2.44(2H, m, H-1′);13C-NMR(150 MHz, DMSO-d6) δ: 174.4(-COO-), 147.8(C-4), 145.1(C-3), 132.5(C-1), 120.7(C-6), 115.7(C-2), 112.9(C-5), 56.0(-OCH3), 36.1(C-2′), 30.5(C-1′)。数据与文献[9]一致,故鉴定为 3,4-二羟基-苯丙酸甲酯。
化合物8: 淡黄色脂状体;1H-NMR(600 MHz, CDCl3) δ: 6.83(1H, d, J = 7.8 Hz, H-2), 6.71(1H, m, H-5), 6.68(1H, m, H-6), 3.88(3H, s,-OCH3), 3.67(3H, s,-OCH3), 2.88(2H, t, J = 7.8 Hz, H-2′), 2.60(2H, t, J = 7.8 Hz, H-1′);13C-NMR(150 MHz, CDCl3) δ: 173.2(-COO-), 146.4(C-3), 144.0(C-4), 132.4(C-1), 120.8(C-6), 114.2(C-5), 110.6(C-2), 55.8(-COOCH3), 51.6(-OCH3), 36.1(C-2′), 30.7(C-1′)。数据与文献[10]一致,故鉴定为二氢阿魏酸甲酯。
化合物9: 油状液体;1H-NMR(600 MHz, CDCl3) δ: 5.34(2H, m, H-9, 10), 2.02(4H, m, H-8, 11), 1.63(2H, m, H-3), 1.25-1.33(20H, m, H-4 ~ H-7, H-12 ~ H-17), 0.88(3H, t, J=7.2 Hz, H-18);13C-NMR(150 MHz, CDCl3) δ: 180.4(C-1), 130.0(C-10), 128.1(C-9), 34.1(C-2), 31.9(C-3), 29.1-29.8(C4-7, C12-15), 27.2(C-8, 11), 24.7(C-16), 22.7(C-17), 14.1(C-18)。数据与文献[11]一致,且经不同的薄层展开剂展开,与油酸标准品 Rf 值一致,故鉴定为油酸。
化合物10: 白色粉末;mp 148~150 ℃;1H-NMR(600 MHz, DMSO-d6) δ: 7.03(2H, d,J=7.8 Hz, H-2, 6), 6.68(2H, d, J=7.8 Hz, H-3,5), 3.39(2H, s, H-1′);13C-NMR(150 MHz, DMSO-d6)δ:173.7(-COOH), 156.4(C-4),130.7(C-2, 6),125.9(C-1),115.4(C-3, 5), 40.6(C-1′)。数据与文献[12]一致,故鉴定为对羟基苯乙酸。
化合物11: 无色油状物;1H-NMR(600 MHz, CDCl3) δ: 5.35(6H, m), 5.26(1H, m), 4.30(2H, m), 4.14(2H, m), 0.88(9H, t, J=6.0 Hz);数据与文献[13]一致,经不同的薄层展开剂展开,与三油酸甘油酯标准品 Rf 值一致。故鉴定为三油酸甘油酯。
化合物20: 白色粉末;mp 111~112 ℃;1H-NMR(600 MHz, DMSO-d6) δ: 11.02(1H, s,-NH), 10.82(1H, s,-NH), 7.39(1H, d, J=7.6 Hz, H-5), 5.44(1H, d, J=7.6 Hz, H-6)。数据与文献[22]一致,故鉴定为尿嘧啶。
2.3 玉米浆乙酸乙酯萃取物的化学成分
利用硅胶柱色谱、重结晶及 HPLC 等分离方法对玉米浆乙酸乙酯萃取物进行分离,从中分离得到了 23 个化合物,依据理化性质及波谱数据分析并结合文献,鉴定了它们的结构。这些化合物除油酸以外,其余均为首次从玉米浆中分离得到,特别是其中有10个为环二肽类化合物,结构见图1。
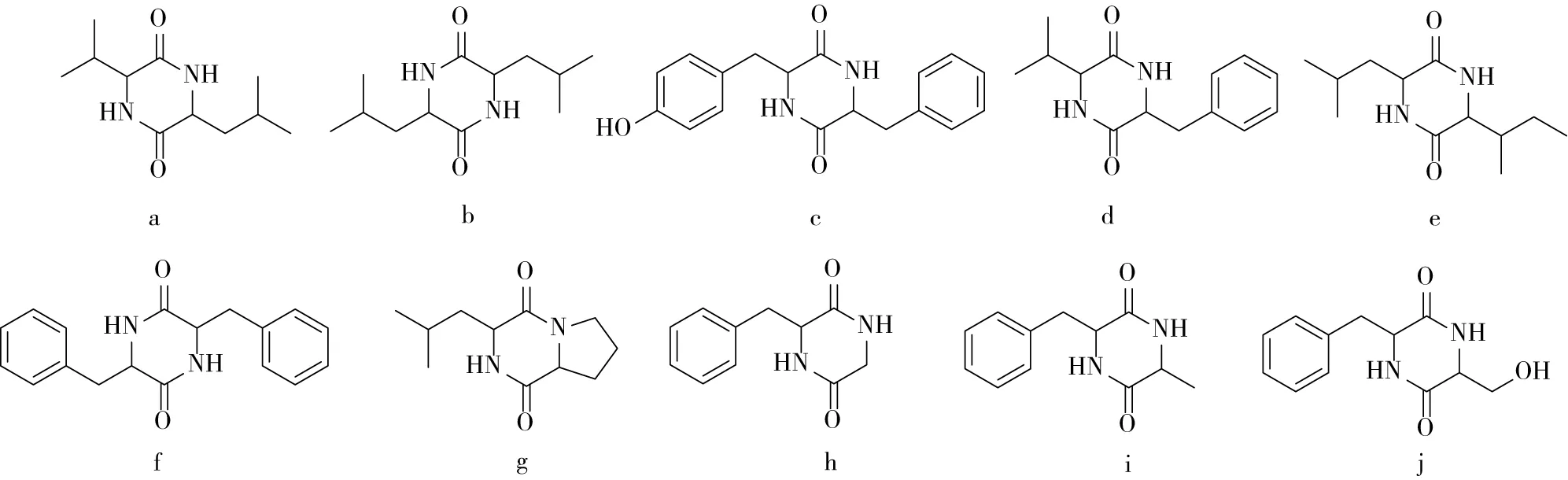
注:a为环(缬-亮)二肽;b为环(亮-亮)二肽;c为环(苯丙酪)二肽;d为环(苯丙-缬)二肽;e为环(亮-异亮)二肽;f为环(苯丙-苯丙)二肽;g为环(脯-亮)二肽;h为环(苯丙-苷)二肽;i为环(苯丙-丙)二肽;j为环(苯丙-丝)二肽。图1 环二肽类化合物的结构
由于环二肽具有十分稳定的结构,从而表现出广泛的生理活性,具有抗肿瘤、抗病毒、镇痛、抗氧化、降血糖等功能。由于这些成分均来自玉米粒,天然无毒,可以广泛地应用于化妆品、药品、食品等行业中,具有广阔的开发前景。
3 结论
玉米浆用4倍体积的甲醇进行醇沉,去除无机盐等强极性物质后,浓缩至小体积,用乙酸乙酯萃取,制得乙酸乙酯萃取物。将该萃取物用硅胶柱色谱、HPLC等分离方法进行分离纯化,共得到23个次生代谢产物,并通过理化性质及波谱数据分析鉴定了它们的结构,其中环二肽类单体化合物10个,苯丙素及其脂类单体化合物 6个,生物碱类成分2个,脂肪酸及其脂类成分2个,其他成分3个。所得的单体化合物都具有较强的生物活性。本研究为进一步扩大玉米浆应用领域提供了参考。

