荷花NnWRKY22 基因的克隆与表达分析
王婉茹,刘 莹,刘红利,2,贺 丹,2,刘艺平,2 ,孔德政,2
(1.河南农业大学风景园林与艺术学院,河南 郑州 450002;2.河南省优质花卉蔬菜种苗工程研究中心,河南 郑州 450002)
0 引言
【研究意义】荷花(Nelumbo nucifera)属莲科莲属,是我国传统十大名花中唯一的水生花卉,具有重要的园林观赏价值和经济价值,既可观赏、药用又可食用。随着工农业废水的无节制排放,荷花的水生环境受到污染,Cu、Hg、Cr、Pb、Cd 等各类重金属含量超标,其中Cu 的过量累积在水体污染中占据了很大比例[1]。荷花在铜胁迫下生长状况受到影响[2],导致叶片失绿、植株矮小等[3],研究荷花抗铜胁迫的分子机制对提高荷花耐铜性有很大意义。WRKY转录因子在荷花应对铜胁迫中发挥着重要作用,因此对荷花WRKY 转录因子进行克隆和表达分析研究具有很大意义。【前人研究进展】WRKY 转录因子(TFs)是一个大的基因家族[4],自甘薯WRKY 基因的首次报告以来[5],来自广泛植物物种的大量WRKY基因已被特征化并被证明参与生长、发育、代谢和对环境线索的响应[6-10]。WRKY 蛋白通常包含1~2 个WRKY 结构域,这一段保守域序列为WRKYGQK加上一个C2H2 或C2HC 的长约60 个氨基酸的锌指基序的区域[11,12]。大量的研究证明,WRKY 转录因子在与植物防御相关的转录调控反应中有着重要的作用,通过调节重金属(铁、镉和铝)的螯合和转运以及减少二次氧化损伤,应对过量的重金属(铁、镉和铝)胁迫[13]。AtWRKY46 基因突变体显示出苹果酸分泌增加,根尖中铝的积累减少,从而提高了铝的抗性[14]。AtWRKY13 通过直接激活AtPDR8表达并减少镉积累来赋予镉耐受性[15]。AtWRKY12 通过谷胱甘肽依赖性植物螯合素合成途径负调控镉的耐受性[16]。【本研究切入点】荷花的水生环境重金属污染严重,铜是重金属污染的主要成分,关于荷花抗铜胁迫的研究较少;WRKY 转录因子广泛参与植物各类防御调控,荷花WRKY 基因的克隆及抗铜胁迫的研究鲜有报道。【拟解决的关键问题】本研究基于荷花铜胁迫转录组测序结果,克隆荷花NnWRKY22基因,对克隆出的氨基酸序列进行生物信息学分析以及在荷花不同组织的表达模式和铜胁迫处理下的表达量变化分析,以期为进一步探索荷花NnWRKY22的基因功能和该基因参与抗铜胁迫的机制提供理论支撑。
1 材料与方法
1.1 试验材料
供试荷花品种艳阳天购自河南荷韵花卉有限公司,栽植于河南农业大学第三生活区试验基地,取完全开放的荷花内轮花瓣、幼嫩根、新生嫩叶和茎液氮速冻后存于-80 ℃,用于基因不同组织表达模式分析。待荷花培养到长势基本一致时,用课题组黄志远[17]筛选出的 400 mg·kg-1CuSO4·5H2O对荷花进行0、7、14 d 的铜胁迫处理,3 个重复。取0、7、14 d 铜处理后的荷花叶片样品液氮速冻并于-80 ℃超低温冰箱保存,用于目的基因抗铜胁迫下的相对表达量分析。
1.2 研究方法
1.2.1 RNA 的提取和cDNA 的合成 于-80 ℃超低温冰箱取荷花艳阳天冷冻叶片液氮研磨,采用改良CTAB 法提取荷花叶片总RNA。用PrimeScript™ RT reagent Kit with gDNA Eraser 试剂盒(RR047A,Takara,大连)合成cDNA。
1.2.2 荷花NnWRKY22 基因的克隆 通过实验室荷花艳阳天抗铜基因转录组数据获得WRKY22基因序列,根据序列设计ORF 段全长引物NnWRKY22-F、NnWRKY22-R(表1)。采用擎科生物的1.1×T3 Super PCR Mix 对荷花艳阳天cDNA 进行PCR 扩增,设置程序:预变性98 ℃ 2 min;变性98 ℃ 10 s,退火58 ℃10 s,延伸72 ℃ 6 s,35 个循环;终延伸72 ℃ 2 min;4 ℃保温。将PCR 产物进行跑胶验证,验证正确的条带用天根试剂盒进行胶回收,连接 pMD18-T 载体,转化Top10 大肠杆菌,进行菌液验证,挑取阳性克隆送至上海生工测序比对。
1.2.3 荷花NnWRKY22 基因生物信息学分析 利用NCBI CDD(Conserved domain database)数据库对NnWRKY22 结构域进行分析,使用ProtParam 进行蛋白质特性分析,TMHMM 预测NnWRKY22 蛋白跨膜结构,Signal IP 预测信号肽结构,SOPMA 工具预测NnWRKY22 蛋白的二级结构,NetPhos 3.1 分析磷酸化位点,MEGAX 软件(Neighbor-Joining,Bootstrap 1000)进行系统进化分析和进化树构造。
1.2.4 荷花NnWRKY22 基因的表达模式分析 为了研究NnWRKY22 在荷花根、茎、叶、花中的表达模式,使用 Primer Premier 5 设计特异引物qRT-NnWRKY 22-F、qRT-NnWRKY22-R(表1)进行荧光定量PCR分析,选取18S rRNA(表1)为内参,用TB Green®Premix Ex Taq™ II(RR820A,Takara,大连)试剂盒对CuSO4·5H2O(400 mg·kg-1)处理0、7 和14 d 荷叶的cDNA 样本进行qRT-PCR 检测。
2 结果与分析
2.1 荷花NnWRKY22 基因的克隆
以荷花铜胁迫转录组数据测出的WRKY22 基因序列设计引物,荷花叶片的cDNA 为模板进行RT-PCR扩增,得到一条的573 bp 大小的清晰条带(图1)。结果表明成功克隆出了荷花NnWRKY22 基因,该基因序列含有一个高度保守的WRKY 结构域,共编码190 个氨基酸(图2)。

图1 NnWRKY22 基因PCR 扩增结果Fig. 1 PCR amplification of NnWRKY22 gene

图2 NnWRKY22 基因核苷酸序列及其推导的氨基酸序列Fig. 2 Nucleotide sequence and deduced amino acids of NnWRKY22
2.2 荷花NnWRKY22 生物信息学分析
对荷花NnWRKY22 基因进行生物信息学分析,结果显示该蛋白分子量、等电点分别为21.33 kDa 和9.03;不稳定系数、亲水性平均系数分别为71.93、0.69,推测为不稳定的亲水性蛋白。由工具分析可知该蛋白不存在跨膜结构以及信号肽结构;二级结构主要包括无规则卷曲和α-螺旋,其中无规则卷曲占比为70.00%;α-螺旋为17.89%;β-折叠占比3.16%。结构域分析表明,NnWRKY22 蛋白特定匹配在WRKY,属于WRKY 转录因子超家族(图3)。磷酸化位点预测该蛋白含有27 个磷酸修饰位点,包括丝氨酸(Serine)和苏氨酸(Threonine)位点各13 个,酪氨酸(Tyrosine)位点1 个(图4)。另外该蛋白的酸性氨基酸残基(Asp+Glu)和碱性氨基酸残基(Lys+Arg)数量分别为17 和21,脂肪族指数为62.16。

图3 NnWRKY22 蛋白保守结构域分析Fig. 3 The analysis of conserved domain for NnWRKY22 protein

图4 NnWRKY22 磷酸化位点预测Fig. 4 Predicted phosphorylation site of NnWRKY22
通过Blast 网站对荷花WRKY22 氨基酸序列进行在线比对,选取12 个物种的WRKY 氨基酸序列进行多重序列比对和进化树构建。进化树结果表明荷花(Nelumbo nucifera)、洛 矶 山 耧 斗 菜(Aquilegia coerulea)和博落回(Macleaya cordata)在同一分支上,水青树(Tetracentron sinense)和蓝果树(Nyssa sinebsis)聚为一支,其余8 个物种聚为一支(图5)。
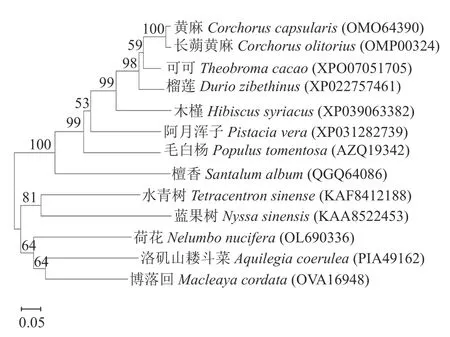
图5 NnWRKY22 与其他植物同源WRKY 蛋白的系统进化树Fig. 5 Phylogenetic tree on NnWRKY22 and WRKY proteins of other plants
2.3 荷花NnWRKY22 基因的表达分析
qRT-PCR 结果表明,在荷花品种艳阳天根、茎、叶和花中均能检测到NnWRKY22 基因的表达,但其表达量存在明显差异。NnWRKY22 基因在荷花的根中的相对表达量最高,在荷花的花中表达量最低,其中在根、茎和叶的表达量分别是在花中的16.5倍、3.3 倍和3 倍(图6)。
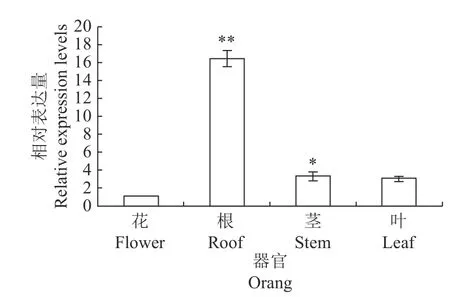
图6 NnWRKY22 在荷花不同组织中的相对表达量Fig. 6 Relative expressions of NnWRKY22 in lotus tissuesThe same as Fig.7.
分析400 mg·kg-1硫酸铜处理下NnWRKY22 基因表达量随时间的变化,结果表明处理7 d 时荷叶中NnWRKY22 的相对表达量显著上升并到达最高值,相比对照组上升了3.4 倍;处理14 d 时表达量相比处理7 d 下降了19.5%,总体呈现先上升后下降的趋势(P<0.01),在铜胁迫7 d 时NnWRKY22 基因的表达量到峰值,之后开始下降(图7)。

图7 铜胁迫下NnWRKY22 的相对表达量Fig. 7 Relative expressions of NnWRKY22 under copper stress
3 讨论与结论
WRKY 转录因子家族在植物应对逆境方面发挥着重要作用,它们在调节植物生长、植物发育以及生物和非生物应激反应中起着关键性作用[10,18-19]。水稻OsWRKY22 与核心转录因子ART1 共同作用于OsFRDL4表达和柠檬酸盐分泌的正调控,从而促进水稻耐铝性[20];番茄SlWRKY6在抗CdCl2、CuCl2、HgSO4 胁迫中发挥重要作用[21];水稻OsWRKY15 通过NO、ABA 等信号途径参与镉胁迫[22];WRKY46 作为转录抑制因子,在拟南芥铝胁迫条件下负性调节ALMT1 的表达[14]。以上结果表明,WRKY 转录因子在植物抗重金属胁迫方面发挥着重要作用,广泛参与了植物抗重金属胁迫的应答机制。
本研究从荷花品种艳阳天中克隆得到NnWRKY22基因,该基因序列ORF 段序列长度为573 bp,编码的氨基酸数量为190。通过序列比对和进化树分析得出,荷花(Nelumbo nucifera)与洛矶山耧斗菜(Aquilegia coerulea)和博落回(Macleaya cordata)的亲缘关系较近。荷花NnWRKY22 氨基酸序列含有一个高度保守的WRKY 结构域,表示NnWRKY22属于WRKY 转录因子超家族。蛋白特性分析表明荷花NnWRKY22 属于不稳定的亲水性蛋白,这与前人在番茄SlWRKY6和梅花PmWRKY2[23]得出的结论相同。大量研究表明,WRKY 在植物不同组织的表达具有特异性,杉木ClWRKY44 基因主要在杉木嫩叶中表达[24],菊花CmWRKY13[25]基因在根中表达量最高,枇杷EJWRKY27[26]在根中高表达。本研究中NnWRKY22 在荷花中的表达也具有组织特异性,在根中表达量最高,花中表达量最低。推测该基因主要通过荷花根部发挥NnWRKY22 基因功能,参与荷花抗铜胁迫。通过课题组前期对铜胁迫荷花品种艳阳天的转录组测序结果可知[17],NnWRKY22 是参与铜胁迫的关键转录因子,可能在抗铜胁迫中发挥重要作用。本研究中发现荷花中的NnWRKY22 基因在铜胁迫下被诱导表达,在高浓度铜处理7d 表达量到达峰值,说明NnWRKY22 参与了荷花抗铜胁迫的应答机制,在荷花抗铜过程中发挥着重要作用,为荷花抵抗铜胁迫提供了新的候选基因。

