甲醛与戊二醛固定剂对基于Ludox–QPS染色方法的研究结果对比
王苗勋 许媛



关键词:多样性;群落结构;微型底栖动物;纤毛虫;固定剂
0引言
微型底栖动物个体微小且为单细胞,在海洋微食物环中扮演着重要的角色.其虫体脆弱,在离心分离过程中极易破碎.因此,如何有效地将其从沉积物中分离、固定并染色,成为微型底栖动物生态学研究的技术瓶颈[1-3].徐奎栋等改进的密度梯度离心结合定量蛋白银染色法(LudoxDensityGradientCentrifugationCombinedwithQuantitativeProtargolStaining,Ludox–QPS)是研究微型底栖动物生态学的重要手段[4-5],并被纳入了《海洋微型底栖生物调查规范》[6]中.
样品固定是影响Ludox–QPS及后续统计分析的重要因素.理想的固定方法应尽可能少地引起细胞损失以及形态变化,能够真实地反映微型底栖动物的生活状况[7].固定方法不当,会导致部分物种丢失或形态破坏,不仅给鉴定造成困难,而且会导致对生物量的评估产生偏差,影响统计的准确性及对群落组成和多样性的分析[8-9].常见的固定剂类型有甲醛、戊二醛、鲁哥氏液(Lugol’s)和波恩液(Bouin’s)等,种类繁多,性能也存在很大的差异[10].类彦立等[4]和Xu等[11]比较了2%戊二醛、4%甲醛、10%Lugol’s液与5%Bouin’s液,认为酸性固定液(Lugol’s液与Bouin’s液)会引起Ludox胶体的凝结,降低固定液的固定效能,不适合Ludox–QPS研究[4,11],pH值为中性的甲醛溶液与戊二醛溶液恰好满足其条件.已有的《海洋微型底栖生物调查规范》建议使用终浓度为2%的戊二醛固定底栖纤毛虫样品[6],但由于戊二醛固定的样品存在长距离运输受限的问题,使得在大地理尺度上进行微型底栖动物的研究受到限制.而经甲醛固定的样品在满足一定条件下可以通过航空托运运输,因此可满足实验样品的远距离运输要求[12].
前人针对浮游类群的研究,发现固定剂类型及浓度会引起部分个体的损失及形态变化,进而影响对生物量的估计[13].Turley等[14]在研究中发现戊二醛固定的浮游生物的数目会随时间减少,并进一步证实了无论甲醛固定还是戊二醛固定均会引起细胞数量的损失.Choi等[15]发现戊二醛固定引起鞭毛虫虫体的收缩小于甲醛固定,而对于寡毛类纤毛虫而言,甲醛固定引起的收缩反而小于Lugol’s和戊二醛等固定剂.已有的文献[10,16-18]也提到,甲醛是相对于其他固定剂(如戊二醛)对细胞体积影响最小的.曾钰婷[19]对台湾地区近海经甲醛固定及室内培养的浮游纤毛虫结合定量蛋白银染色研究发现,甲醛固定不影响“属”级的鉴定,部分能够鉴定到“种”级.上述研究均源自浮游样品或室内培养的有限种的分析结果,而对于底栖类群的报道甚少.迄今,国内外针对固定剂类型对底栖类群影响的研究十分有限,仅有孟昭翠等[20]对采自黄海海域并经甲醛固定的底栖生物样品的研究,发现底栖鞭毛虫会随固定时间延长而造成一定数量的低估.
因此,为对比甲醛固定与戊二醛固定经Ludox–QPS染色后的微型底栖动物群落的研究结果是否具有可比性,本研究于2019年4月在上海南汇边滩采集了3种生境的微型底栖动物样品,并分别采用甲醛和戊二醛作为固定剂,后期进行Ludox–QPS染色实验并对比实验结果.这为以后采用何种固定剂进行微型底栖动物生态学研究及采用不同固定剂的研究结果是否具有可比性提供相应的研究依据.
1材料与方法
1.1 采样区域、方法及固定方式
本研究于2019年4月在上海市南汇边滩(30°51′39″N,121°55′06″E)选取光滩、海三棱藨草滩以及沙滩3种生境(图1),每种生境随机选取两个样点作为平行样.
使用直径约1.5cm的自制采样器,在每个样点随机采集6个表层平行芯样(0~2cm,约24mL),随机分成2组(每组3个芯样),一组使用终浓度1%的甲醛溶液固定,另一组使用终浓度2%的戊二醛溶液固定.
1.2 Ludox–QPS及物种鉴定
Ludox–QPS实验过程参照《海洋微型底栖生物调查规范》,依次对样品进行稀释降盐、密度梯度离心、真空抽滤、琼脂包埋、蛋白银染色、脱水与封片等过程,获得永久装片[6].
使用光学显微镜(BX53,OLYMPUS,日本)在200~1000倍下进行镜检,对目标生物测量长(L)和宽(D)[6].参照宋微波等[21]、Carey[1]和Lynn[22]等分类文献对纤毛虫进行鉴定,并根据各自特征进行类群划分.
1.3 纤毛虫生物量的计算
通过镜检测量纤毛虫个体的长(L)和宽(D),并根据虫体最接近的几何形状计算体积(V),通过转换系数对纤毛虫的生物量进行估算.一般每种纤毛虫随机选取20只个体(如果个体不足20只则全部计数)进行测量,最后取平均值[5,23].甲醛固定样品的转换系数为0.14pg/μm3,戊二醛固定样品的转化系数为0.20pg/μm3[5,24].
1.4 数据分析
利用Primer–E7.0软件对纤毛虫丰度数据进行平方根转换,并计算Bray–Curtis相似性矩阵,在DIVERSE模块中计算物种数(S)、个体数(N)、香农–维纳多样性指数(H')和均匀度指数(J').公式如下:
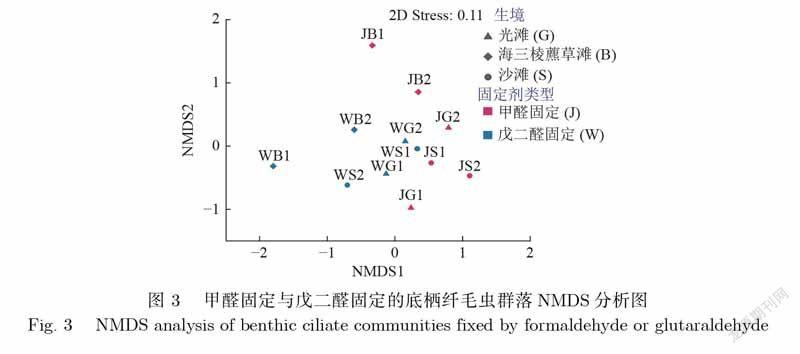
对底栖纤毛虫群落的物种组成、多样性参数及生物量数据在0.05水平上进行ANOSIM(AnalysisofSimilarities)双因素(生境类型和固定剂类型)交叉分析[25].并根据Bray–Curtis相似性矩阵进行NMDS(NonmetricMultidimensionalScaling)分析,以顯示不同固定剂、不同生境采集的底栖纤毛虫群落物种组成的相似性.
2结果
2.1 物种组成
本研究中共检获底栖纤毛虫26科33属39种,分别属于侧口类、前口类、小胸类、盾纤类、核残迹类、钩刺类、腹毛类、寡毛类、膜口类及管口类10个类群.其中,甲醛固定的样品中检获9类26种,戊二醛固定的检获10类26种(图2),刚毛刺叶虫(Kentrophyllumsetigerum,属于侧口类)为优势种.
2.2 群落结构
2.2.1ANOSIM双因子交叉分析
ANOSIM双因子(生境类型与固定剂类型)交叉分析结果表明:虽然不同生境(光滩、沙滩和海三棱藨草滩)中的底栖纤毛虫群落之间存在显著性差异(p<0.05,表1),但两种固定方式获得的底栖纤毛虫群落物种组成、多样性参数(物种数、个体数、均匀度和香农-维纳多样性指数)以及生物量均无显著性差异(p>0.05,表1).
2.2.2NMDS分析
NMDS分析结果(stress=0.11)显示,两种固定方式固定的群落结构之间区分不明显,海三棱藨草滩与其他生境(光滩和沙滩)之间的群落结构存在明显区分(图3).
2.3 底栖纤毛虫生物量
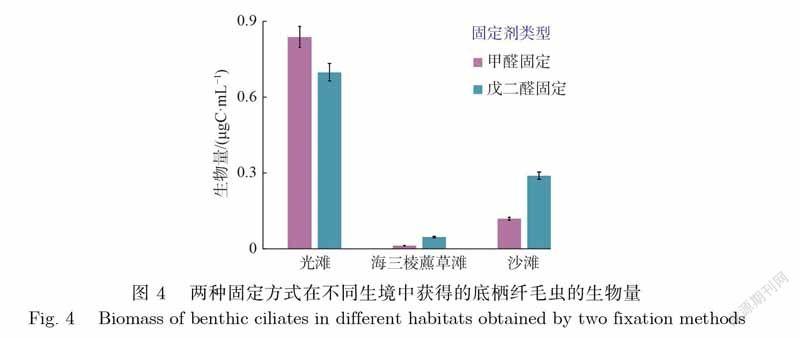
甲醛固定与戊二醛固定获得的平均生物量分别为(0.32±0.11)μgC/mL与(0.35±0.07)μgC/mL.两种固定方式获得的底栖纤毛虫生物量在不同生境(海三棱藨草滩、光滩和沙滩)中的分布状况趋同(图4),通过ANOSIM双因子交叉分析结果(表1)可知,底栖纤毛虫群落的生物量在不同生境间存在显著性差异(p<0.01),但在两种固定方式之间不存在显著性差异(p>0.05).
2.4 两种固定方式的Ludox–QPS染色效果
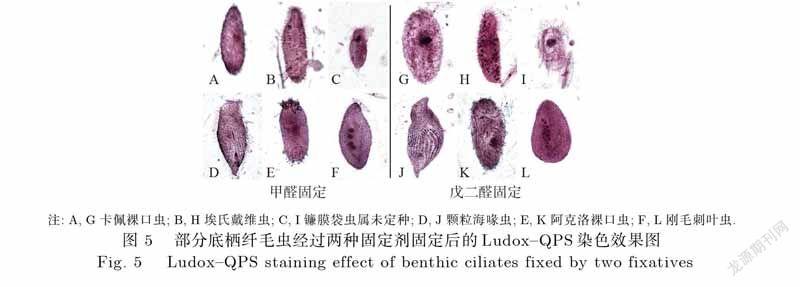
甲醛固定与戊二醛固定的样品经过Ludox–QPS染色后获得的纤毛虫染色图式如图5所示.两种方法获得的虫体形态均基本完整,无明显收缩;纤毛图式染色尚可;细胞内质着色均匀,且多数个体细胞核清晰可见.可根据其纤毛排列、口区位置及细胞核形状与数目等结构,将其鉴定到“属”级甚至“种”级的水平(图5).
3讨论
3.1 固定剂的性质
甲醛溶液与戊二醛溶液都是微型底栖生态学中常见的固定剂,两者在性能上存在较大差异[26-30].甲醛穿透能力较弱,对细胞内的超微结构保存效果不佳,仅能够满足普通光学显微镜观察的需求;而戊二醛对细胞核以及膜系统的保存能力优于甲醛,对细胞内的超微结构能够很好地保存,可满足分辨率更高的电镜观察[31].甲醛与戊二醛作为固定剂均会在一定程度上引起目标生物的形态发生变化[13,15],但也有学者认为,甲醛固定能够减少虫体的收缩程度,更能够客观地反映实际生物量状况[15].甲醛溶液与戊二醛溶液不会造成Ludox硅胶液凝结,均适合LudoxHS–40硅胶液对微型底栖动物进行提取[2],但采用戊二醛固定的样品还需在冷冻条件下保存.
3.2 两种固定方式对物种鉴定的影响
本研究采用甲醛固定与戊二醛固定两种方式结合Ludox–QPS染色获得的纤毛虫图式(图5),与前人研究中(均由戊二醛固定)采用Ludox–QPS染色获得的底栖纤毛虫图式效果一致[2,5,32],均可根据体表纤毛结构、口区结构等特征鉴定到“属”级或“种”级.前人对浮游类群纤毛虫利用甲醛或戊二醛固定,同样可以通过形态特征辨别至“属”和“种”级水平[33-34],可见两种固定方式对纤毛虫种类的辨别无明显影响.相关研究结果不仅能提供底栖纤毛虫形态方面的信息,还能计算生态学分析所需的丰度、丰富度、物种数等生物群落数据,数据可用于后续的ANOSIM分析和NMDS分析等过程,为开展微型底栖动物生态学研究提供便利.
3.3 不同固定方式获得的底栖纤毛虫群落结构对比
针对甲醛固定与戊二醛固定的采自3种生境的底栖纤毛虫群落,经过ANOSIM分析(表1),结果表明,其群落的物种组成、4种群落多样性参数(物种数、个体数、均匀度,香农–维纳多样性指数)以及生物量方面均差异不显著(p>0.05).NMDS分析(stress=0.11,介于0.1到0.2之间)同样表明,同一生境的两种固定剂固定的底栖纤毛虫群落的物种组成相似.与Xu等[35]在相同区域的研究比较,优势种(Kentrophyllumsetigerum)未发生改变,但丰度和多样性较低,其原因可能与样品的采集时间或采集强度有关.海三棱藨草滩、光滩和沙滩的多种环境因子存在明显的差异[35],是造成物种组成、均匀度、个体数和生物量间显著性差异(表1,p<0.05)的主要原因.前人在浮游样品的研究中认为,无论何种固定剂(甲醛或戊二醛)细胞数目随时间均会在一定程度上影响数据的呈现[36],在底栖样品中,孟昭翠等[20]研究发现,甲醛固定的微型底栖动物(鞭毛虫)样品保存4个月比保存1个月丰度降低47.4%,但短时间内影响有限.本研究在样品采集后4d内即完成Ludox–QPS染色,在一定程度上减少了保存时间对定量研究的影响.目前,尚无直接证据表明甲醛与戊二醛两种固定方式对研究结果产生差异,说明甲醛可作为微型底栖动物的固定剂用于固定Ludox–QPS实验所需的材料,并且可将其研究结果与戊二醛固定后的研究结果进行比较.
3.4 特殊类群的比较
本研究中膜口类(Maritujapelagica,1种,占1.32%,图2)仅出现在戊二醛固定的样品中,未出现在甲醛固定的样品中,该现象或许与固定剂的固定能力有关.然而,与马族航[32]对崇明东滩湿地的底栖纤毛虫群落和刘华雪等[37]对南海区域的微型动物群落的研究对比,前者以戊二醛(终浓度2%)为固定剂,后者以甲醛(终浓度2%)为固定剂,均能固定到大量的膜口类纤毛虫.本研究中前口类(占32.92%)、侧口类(占19.88%)和腹毛类(占13.35%)等类群占极大优势,与已有的研究结果基本吻合[26,32,35,38],膜口类在本次研究区域内丰度极低,仅占0.64%.因此,该现象可能是膜口类纤毛虫在本区域内丰度极低,仅被偶然采集到戊二醛固定的样品中,而与甲醛的固定能力无关.但也并不排除固定剂会对胞内结构存在一定程度的影响,这需要从细胞学角度进一步研究.
4结论
由上述实验结果可知,甲醛作为固定剂可结合Ludox–QPS染色開展微型底栖动物生态学研究,这将为在较大地理尺度上开展相关的研究提供便利.本研究表明,采用甲醛和戊二醛两种固定剂进行Ludox–QPS染色后的研究结果具有可比性.

