过氧化麦角甾醇衍生物对人三阴性乳腺癌细胞增殖、迁移和侵袭的影响
张宏宇 任文康 邹宇 韩迎龙 杨宏艳 卜明 都晓辉 林宇


关键词过氧化麦角甾醇衍生物;乳腺癌细胞;EP-3P;三阴性乳腺癌;迁移;侵袭;凋亡
全球最新癌症负担数据显示,2020 年全球乳腺癌新发病例高达226 万例,超过了肺癌的220 万例,已成为全球第一大癌症[1]。虽然随着化疗、内分泌治疗、靶向治疗等综合治疗手段的运用,癌症患者的病死率已大幅度下降,但我国仍约有7.82%的女性因乳腺癌复发或转移而死亡[2]。因此,探寻治疗乳腺癌的有效药物仍然是亟待解决的问题。
从天然产物中寻找抗肿瘤药物或抗肿瘤辅助药物,并对其结构进行改造或修饰,已成为国内外研究的重点内容之一。过氧化麦角甾醇(ergosterol peroxide,EP)是一种过氧化甾体类天然产物,广泛存在于多种真菌中[3-4]。已有大量文献报道,EP可通过细胞毒性作用抑制癌细胞生长[5-7]。研究发现,EP 作为一种重要的活性先导化合物,其特有的5α,8α-过氧桥是关键药效载体[8-10]。EP的C-3 位和C-17 位具有较大的结构修饰空间,如Li 等[11]、Han 等[12]分别在EP 的C-17 位引入吲哚醌取代基和酰肼侧链合成了新的化合物,并发现上述合成的化合物均可显著抑制癌细胞的增殖、诱导癌细胞凋亡;再如Bu 等[13]发现,在EP的C-3 位引入氨基甲酸酯极性基团对提升其抑制肿瘤细胞增殖的活性至关重要。
紫杉醇是一种公认的治疗乳腺癌的药物,其结构中的C-13 侧链与其抗肿瘤作用密切相关[14]。为进一步推进EP 结构衍生化研究,筛选具有更强抗肿瘤活性的新化合物,本课题组前期以EP作为先导化合物,通过在其C-3 位羟基引入紫杉醇的侧链(4S,5R)-3- 叔丁氧羰基-2,2-二甲基-4-苯基-1,3- 唑烷-5-甲酸,合成了全新的EP衍生物EP-3P(结构见图1)。本研究拟通过体外实验初步考察EP-3P 对人三阴性乳腺癌细胞MDA-MB-231 增殖、迁移和侵袭的影响,并探讨其可能的作用机制,以期为乳腺癌治疗相关药物的开发研究提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括:Axio observer A1 型倒置显微镜(德国Zeiss 公司),SAFIRE2 型多功能酶标仪(瑞士Tecan 公司),Power/PAC3000 型电泳仪、Chemi-Doc MP型凝胶成像仪、FACS Calibur 型流式细胞仪(美国Bio-Rad公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂包括:EP-3P(由齐齐哈尔医学院药物化学研究室提供,批号20211020,经高效液相色谱法和核磁共振法检测其纯度均在98%以上),L-15 培养基、胎牛血清(美国Hyclone 公司),重组胰蛋白酶消化液、二甲基亚砜(DMSO)、MTT细胞增殖与细胞毒性检测试剂盒(批号C0038)、二喹啉甲酸(BCA)蛋白浓度试剂盒(批号P0010)、RIPA裂解液(上海碧云天生物技术有限公司),Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒(美国Invitrogen 公司,批号1753025),细胞周期检测试剂盒(南京凯基生物科技发展有限公司,批号KGA512),Matrigel 基质胶(美国BD 公司,批号356234),鼠源B 淋巴细胞瘤2(B-cell lymphoma-2,Bcl-2)和兔源Bcl-2 相关X蛋白(Bcl-2 associated X protein,Bax)、細胞色素C(cytochrome C,Cyt-C)、胱天蛋白酶3(cysteinyl aspartate specific proteinase 3,caspase-3)、活化的caspase-3(cleaved-caspase-3)、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、MMP-9、甘油醛-3-磷酸脱氢酶(GAPDH)8 种单克隆抗体以及辣根过氧化物酶标记的山羊抗兔、山羊抗小鼠免疫球蛋白G(IgG)二抗(美国Cell Signaling Technology 公司),ECL发光试剂盒(北京康为世纪生物科技股份有限公司,批号CW0049),其余试剂均为分析纯,水为超纯水。
1.3 细胞
人三阴性乳腺癌细胞MDA-MB-231 购自中国科学院上海细胞库。
2 方法
2.1 细胞培养
将MDA-MB-231 细胞培养于含10%胎牛血清、1%双抗(100 U/mL 青霉素和100 μg/mL 链霉素)的L-15 培养基中,置于37 ℃、无CO2的培养箱中培养。本研究选用传代6~10代的细胞进行实验。
2.2 EP-3P对MDA-MB-231 细胞增殖的影响
采用MTT 法进行检测。取对数生长期的MDAMB-231 细胞,胰酶消化后用L-15 完全培养基稀释成2×104个/mL 的细胞悬液,将细胞悬液按100 μL/孔接种于96 孔板中。实验设置空白对照组(不加任何药物处理培养的细胞,即0 μmol/L)、EP-3P 不同浓度组(1.25、2.5、5、10、20、40 μmol/L,药物浓度根据前期预实验结果设置),每组平行设置3 个复孔;并设置空白调零孔(不加细胞,只加培养液)。分别在培养24、48、72 h 时,每孔加入0.5mg/mL 的MTT 溶液10 μL,培养箱中常规培养4 h 后弃去MTT,再每孔加入150 μL DMSO振荡30 min 溶解甲瓒结晶;然后采用多功能酶标仪测定各孔在490 nm波长处的光密度值,并计算细胞的增殖抑制率:增殖抑制率(%)=[1-(给药组光密度值-空白调零孔光密度值)/(空白对照组光密度值- 空白调零孔光密度值)]×100%。实验重复3 次。
2.3 EP-3P对MDA-MB-231 细胞迁移能力的影响
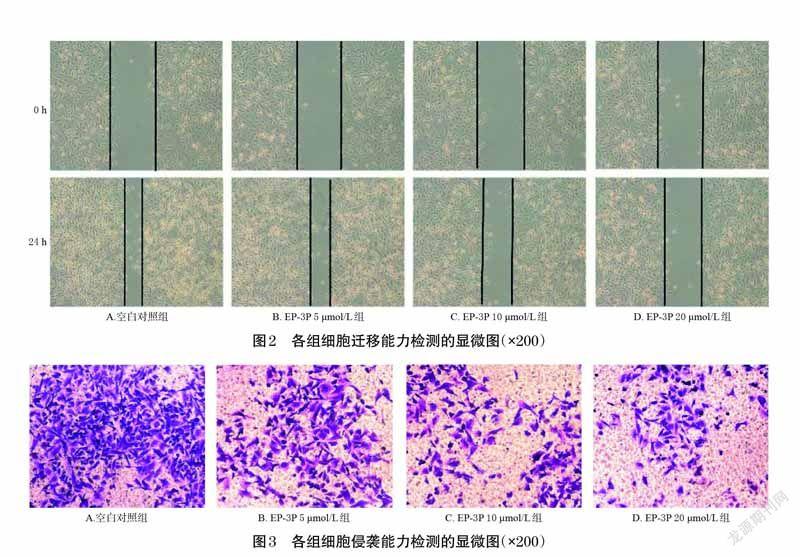
采用细胞划痕法进行检测。取对数生长期的MDA-MB-231 细胞,以1×105个/孔的细胞密度接种于6孔板中,常规培养过夜,然后采用无菌枪头在垂直于板的横轴方向划出等宽的直线划痕,用磷酸盐缓冲液(PBS)清洗细胞3 次。将细胞分为空白对照组(0 μmol/L)和EP-3P不同浓度组(5、10、20 μmol/L,浓度根据“2.2”项下MTT实验结果和本课题组前期预实验结果设置,下同),每组设置3 个复孔。分别在培养0、24 h 后,用倒置显微镜观察划痕愈合情况,并拍照。利用Image J V1.8.0 软件测定划痕面积,计算细胞的迁移愈合率:迁移愈合率(%)=(0 h 时划痕面积-24 h 时划痕面积)/0 h 时划痕面积×100%。实验重复3 次。
2.4 EP-3P对MDA-MB-231 细胞侵袭能力的影响
采用Transwell 小室法进行检测。将Matrigel 基质胶与无血清培养基按照体积比1 ∶8 混匀后,按50 μL/孔的量加入到Transwell 小室上层。将细胞侵袭小室置于培养箱中,将Matrigel 烘干,然后弃掉多余的培养基。取对数生长期的MDA-MB-231 细胞,制成1.5×105 个/mL的细胞悬液,分别给予0(空白对照组)、5、10、20 μmol/L的EP-3P(EP-3P不同浓度组)刺激,每个浓度组设置3 个平行组。然后分别取上述给药后的细胞悬液100 μL 加入到Transwell 小室上层,下层中加入含10%胎牛血清的培养基700 μL。将细胞侵袭小室置于培养箱中培养24 h,然后以4%多聚甲醛固定30 min,再用1%结晶紫染色30 min 后,于倒置显微镜下观察穿过基底膜的侵袭细胞。每个样本计数5 个视野,取平均值作为检测结果。实验重复3 次。
2.5 EP-3P对MDA-MB-231 细胞凋亡的影响
采用Annexin Ⅴ-FITC/PI 双染色法进行检测。取对数生长期的MDA-MB-231 细胞,常规制备细胞悬液后,将细胞以1×105个/孔的密度接种于6 孔板中,培养24 h后,按照“2.3”项下方法分组与给药。继续培养24 h 后,收集、洗涤细胞,先后加入Annexin Ⅴ-FITC、PI 试剂各5μL,混匀,于室温下避光反应15 min后,采用流式细胞仪检测细胞凋亡情况,并通过Flow jo 10 软件分析各组细胞的凋亡率。实验重复3次。
2.6 EP-3P对MDA-MB-231 细胞周期分布的影响
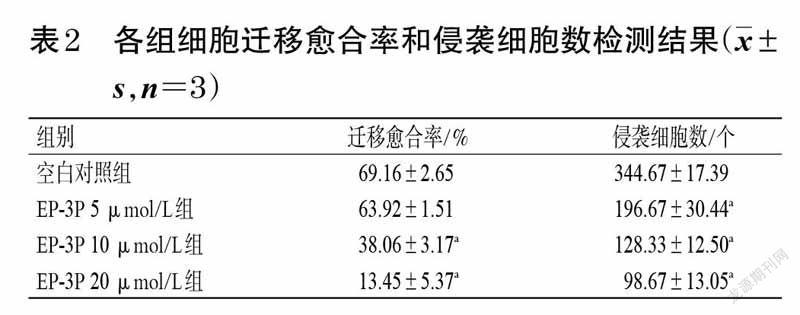
采用流式细胞术进行检测。取对数生長期的MDAMB-231 细胞,按照“2.5”项下方法接种、分组、给药、培养并收集。制备细胞密度为1×106个/mL的单细胞悬液,离心(2 000 r/min,5 min)去除上清,加入70%冷乙醇500 μL,4 ℃固定过夜;用预冷的PBS洗细胞3 遍,除去残留的乙醇;加入500 μL 提前配制好的PI/RNase A染色液(临用前PI 与RNase A染色液按9 ∶1 的体积比配制),37 ℃避光孵育30 min 进行染色,采用流式细胞仪检测,并通过Flow jo 10软件分析细胞周期分布。实验重复3次。
2.7 EP-3P对MDA-MB-231 细胞中凋亡和侵袭相关蛋白表达的影响
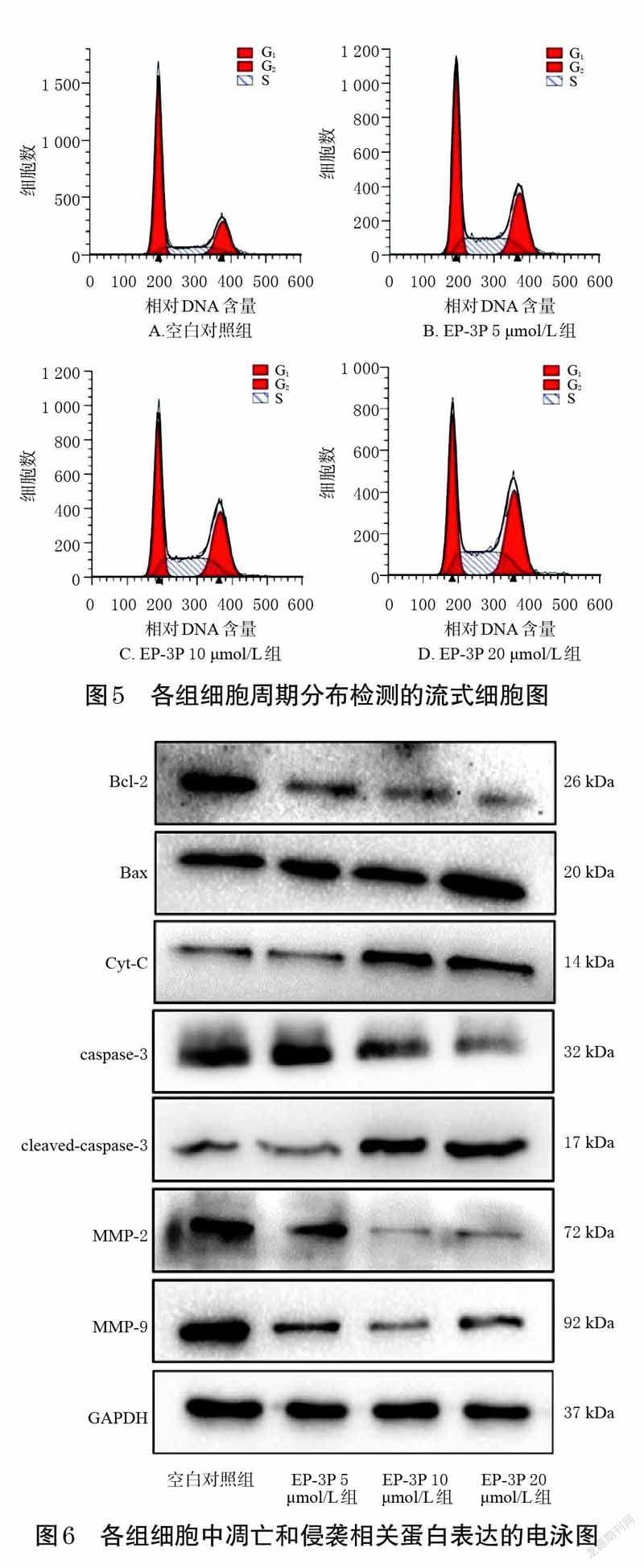
采用Western blot 法进行检测。取对数生长期的MDA-MB-231 细胞,制成单细胞悬液后,以8×105个/皿的细胞密度接种于直径为60 mm的细胞培养皿中,待细胞培养至贴壁后,将细胞分为空白对照组(0 μmol/L)和EP-3P 不同浓度组(5、10、20 μmol/L)。药物作用24 h后,每个培养皿加入PMSF 和RIPA 裂解液的混合液(PMSF 和RIPA裂解液的体积比为1 ∶100)500 μL,于冰上裂解细胞30 min,提取细胞中总蛋白,采用BCA法进行蛋白定量,并将蛋白高温变性。取变性后的蛋白样品30 μg,在80 V电压下进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,在300 mA恒流下将蛋白转移至聚偏二氟乙烯膜上,用5%的脱脂奶粉在室温下封闭2 h;加入内参蛋白GAPDH一抗(稀释比例1 ∶5 000)和目标蛋白Bcl-2、Bax、Cyt-C、caspase-3、cleaved-caspase-3、MMP-2、MMP-9 一抗(稀释比例均为1 ∶1 000),4 ℃孵育过夜;以TBST 缓冲液漂洗10 min×3 次,加入相应二抗(稀释比例均为1 ∶3 000),室温孵育2 h;以TBST缓冲液漂洗10 min×3 次,加ECL发光液,然后于凝胶成像仪中成像。用Image J V1.8.0 软件对蛋白条带进行分析,以目标蛋白条带灰度值与内参蛋白(GAPDH)条带灰度值的比值表示目标蛋白的表达水平。实验重复3次。
2.8 统计学方法
采用SPSS 19.0 软件对数据进行统计分析。计量资料采用x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 EP-3P对MDA-MB-231 细胞增殖的影响结果
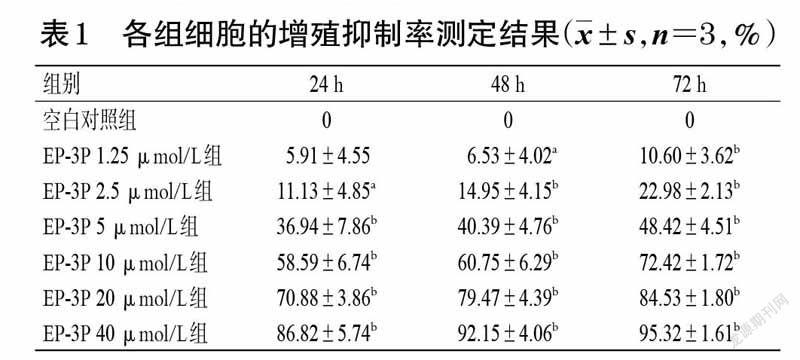
与空白对照组比较,不同浓度EP-3P 作用于MDA-MB-231 细胞24、48、72 h 后,细胞的增殖抑制率均不同程度地升高,并呈一定的浓度和时间依赖趋势。其中,除EP-3P 1.25 μmol/L组细胞在培养24 h 时的增殖抑制率外,其余各浓度EP-3P组细胞在药物作用24、48、72 h后的增殖抑制率均显著升高(P<0.05 或P<0.01)。各组细胞的增殖抑制率测定结果见表1。
3.2 EP-3P对MDA-MB-231 细胞迁移和侵袭能力的影响结果
与空白对照组比较,EP-3P 10、20 μmol/L 组细胞的迁移愈合率显著降低(P<0.01),EP-3P 5、10、20 μmol/L组穿过基底膜的侵袭细胞数显著减少(P<0.01),且均呈一定的浓度依赖趋势。结果见图2、图3和表2。
3.3 EP-3P对MDA-MB-231 细胞凋亡的影响结果
与空白对照组比较,EP-3P 5、10、20 μmol/L 组细胞的凋亡率显著升高(P<0.05),且呈一定的浓度依赖趋势。结果见图4、表3。
3.4 EP-3P对MDA-MB-231 细胞周期分布的影响结果
与空白对照组比较,EP-3P 5、10、20 μmol/L组G0/G1期细胞占比显著降低(P<0.05 或P<0.01),G2/M期细胞占比显著升高(P<0.05 或P<0.01),且呈一定的浓度依赖趋势。结果见图5、表3。
3.5 EP-3P对MDA-MB-231 细胞中凋亡和侵袭相关蛋白表达的影响结果
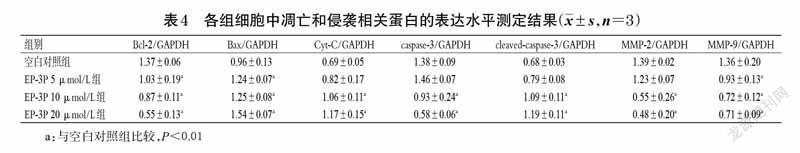
与空白对照组比较,EP-3P 5、10、20 μmol/L 组细胞中Bcl-2、MMP-9 蛋白的表达水平显著降低(P<0.01),而Bax 蛋白的表达水平显著升高(P<0.01);EP-3P 10、20 μmol/L 组细胞中caspase-3、MMP-2 蛋白的表达水平显著降低(P<0.01),而Cyt-C、cleaved-caspase-3 蛋白的表达水平显著升高(P<0.01)。结果见图6、表4。
4 讨论
EP 具有抗病毒、抗癌、抗真菌等药理作用[15-16]。近年来,EP的抗肿瘤作用也逐渐受到研究者的关注。研究发现,EP 可抑制17β-雌二醇诱导的乳腺癌细胞MCF-7的增殖活性[17]。El-Sherif 等[5]首次从埃及树脂灵芝菌丝体中分离得到EP,并发现其在体外可显著抑制乳腺癌细胞MCF-7 的增殖。据文献[18]报道,EP可抑制乳腺癌细胞SUM-149、MDA-MB-231 的增殖,诱导其凋亡,并可抑制细胞中蛋白激酶B、细胞周期蛋白D1 和原癌基因c-Myc 调控蛋白的表达,从而抑制细胞的迁移和侵袭。然而EP的抗肿瘤作用及机制尚不清楚。本课题组在前期药物筛选时发现,EP的衍生物EP-3P对MDA-MB-231细胞的半数抑制浓度(IC50)为(11.29±3.13)μmol/L,对正常人乳腺细胞CCD-1095Sk 的IC50 为(54.73±2.48)μmol/L;而EP 对MDA-MB-231 细胞的IC50 为(20.54±1.98)μmol/L。上述结果表明,EP-3P 对MDA- MB-231细胞增殖的抑制作用明显强于EP,且其对正常乳腺细胞的毒性作用较弱。本研究中MTT实验和细胞周期实验检测结果显示,EP-3P 作用后对MDA-MB-231 细胞的增殖有一定抑制作用,可将细胞周期阻滞于G2/M期,还可有效抑制细胞的迁移和侵袭,诱导细胞凋亡,并具有一定的浓度依赖趋势。
Bcl-2 家族是细胞凋亡研究中最重要的癌基因之一,其在线粒体介导的内源性凋亡通路中起着重要作用[19]。该家族中的Bcl-2 和Bax 蛋白分别具有抑制和促进细胞凋亡的作用,可通过调节线粒体膜的通透性来调控线粒体凋亡途径[20]。在正常状态下,Cyt-C 位于线粒体外膜,当外膜通透性增加时,Cyt-C 进入细胞质,引起caspase 级联放大反应,导致caspase-3 进入活化状态(即cleaved-caspase-3);活化的caspase-3 可裂解细胞内生物酶结构中的天冬氨酸残基肽键,使酶失活,从而导致细胞凋亡[21]。本研究结果显示,EP-3P作用于MDA-MB-231细胞后,可以诱导细胞中Bcl-2、caspase-3 蛋白表达下调和Bax、Cyt-C、cleaved-caspase-3 蛋白表达上调。该结果提示,EP-3P可能通过上调细胞中Bax 蛋白表达、下调细胞中Bcl-2 蛋白表达,介导线粒体的内源性途径来诱导MDA-MB-231細胞凋亡。
MMP-2 和MMP-9 是MMPs 家族的重要成员,可参与肿瘤细胞转移的调控。已有相关报道证实,MMP-2 和MMP-9 的高表达可能与乳腺癌的高转移潜能有关[22-23]。本研究发现,EP-3P 可以有效抑制MDA-MB-231 细胞中MMP-2 和MMP-9 的蛋白表达,表明EP-3P 可能是通过抑制MMP-2 和MMP-9 表达从而影响MDA-MB-231 细胞的迁移和侵袭。
综上所述,EP-3P 可通过线粒体介导的内源性caspase途径抑制乳腺癌细胞MDA-MB-231 的增殖、迁移和侵袭,并可诱导细胞发生凋亡。本研究结果为后续研究EP-3P 抗乳腺癌作用机制提供了一定参考,但本研究仅采用单一的乳腺癌细胞系进行了实验,有关EP-3P 对其他肿瘤细胞及其抗乳腺癌的相关机制有待进一步探讨。同时,衍生物EP-3P 抑制乳腺癌细胞转移和凋亡的作用是否优于其先导化合物EP,尚需进一步验证。

