Fe-Mn二元氧化物强化活性铝硅酸盐矿物对Tl(Ⅰ)的去除及其机制
邹友琴,李 群,李卓悦,刘耀驰,李勇丽,章 萍
1.南昌大学资源环境与化学工程学院,南昌 330031 2.鄱阳湖生态与生物资源利用教育部重点实验室(南昌大学),南昌 330031 3.中南大学化学化工学院,长沙 410083
0 引言
铊(Tl)属于剧毒的稀有重金属,对哺乳动物具有高毒性,对人体的毒性远高于Hg、Cd、Pb等重金属,是世界公认的13种优先控制的金属污染物之一[1]。铊主要通过金属冶炼、化石燃料燃烧和水泥生产等工业活动或含铊矿石风化释放到环境中[2-3]。在水体中,Tl(Ⅰ)和Tl(Ⅲ)是铊主要存在形式。Tl(Ⅰ)在水环境中更常见,其比Tl(Ⅲ)有更高的迁移性,因此,Tl(Ⅰ)对水体危害更大,去除难度也更大[4-5]。
目前去除铊的主要方法有吸附法[6]、化学氧化和沉淀法[7]、离子交换法[8]和微生物法[9]等。基于吸附法处理重金属废水具有高效、经济、易操作的特点,研发吸附快速、环境友好的吸附材料成为该领域的关注热点。Fe-Mn二元氧化物(Fe-Mn binary oxide,FMO)在孔隙结构与比表面积方面的优势,使得其具备很强的吸附能力[10],但FMO颗粒易团聚,机械强度差,须将其固定在基体材料上[11-12]。矿物基吸附剂既能有效固化重金属,又对环境友好,不易造成二次污染[13]。铝硅酸盐矿物与土壤中黏土矿物的结构和组成相似,在去除水中重金属方面表现出离子交换、多孔、离子络合、静电吸附等,以及很容易获得且价格低廉等优点,已引起人们的关注[12,14-15]。Liu等[16-17]前期曾用铝硅酸盐制备活性铝硅酸盐矿物(active aluminosilicate mineral,AAM)吸附剂处理Pb(Ⅱ)和Cd(Ⅱ),取得较好效果,最大吸附量分别达到了263.16和303.03 mg/g,但将二者复合去除水中铊的研究鲜见报道[18]。
本研究采用共沉淀法将FMO固定于铝硅酸盐矿物基体,制备FMO复合活性铝硅酸盐矿物(Fe-Mn binary oxide composite active aluminosilicate mineral,FMAAM)吸附剂,研究其对水中Tl(Ⅰ) 吸附过程及去除机理,以期实现高效、经济、环境友好的除铊目的。
1 材料与方法
1.1 实验材料
钾长石来源于中国吉林省通化市。铊标准溶液(TlNO3)购于国家有色金属及电子材料分析测试中心,石灰石(CaCO3)、硫酸钠(Na2SO4)、高锰酸钾(KMnO4)和七水硫酸亚铁(FeSO4·7H2O)、硝酸(HNO3)、氢氧化钠(NaOH)购于国药集团化学试剂有限公司。除硝酸为优级纯外,其他所用试剂均为分析纯。铊储备标准溶液(Tl(Ⅰ)1 000 mg/L)采用稀硝酸(浓硝酸与去离子水体积比为1∶99)或去离子水与铊标准试剂配制。实验用水均为去离子水。用HNO3溶液和NaOH溶液(均配制为0.1 mol/L)调节pH值。
1.2 FMO复合活性铝硅酸盐材料制备
首先将钾长石、石灰石(CaCO3)、硫酸钠(Na2SO4)按质量比15∶15∶1混合,粉碎至100目以下,置于1 200 ℃的马弗炉内焙烧1 h,制得活性铝硅酸盐矿物材料,冷却后将其粉碎至100目以下备用;然后称取该材料4 g置于烧杯中,加入KMnO4溶液(100 mL, 0.018 mol/L)后用磁力搅拌(650 r/min);再缓慢加入FeSO4·7H2O溶液(100 mL, 0.056 mol/L),使溶液最终pH维持在12左右;之后连续搅拌悬浮液2 h,将得到的悬浮液沉淀过夜,洗涤3~4次后再过滤,在105 ℃条件下烘干4 h;最后将其压碎,过100目制得备用FMO复合活性铝硅酸盐材料。
1.3 检测和表征
使用石墨炉原子吸收分光光度计(TAS-990)测定水中Tl质量浓度。利用高灵敏度Zeta电位及粒度分析仪(Omni, 美国)测定吸附剂的pHpzc(零电位),采用精密酸度计(上海雷磁PHS-3C 型)测定pH值。使用扫描电子显微镜结合能量色散X射线光谱仪(SEM-EDX, SIGMA 500/VP, Zeiss, 德国)分析吸附剂表面的形态特征和元素组成。用比表面与孔隙度分析仪(BET,ASAP 2020 PLUS,美国)测定材料的比表面积、总孔体积和粒径。采用傅里叶变换红外光谱仪(FTIR,Nexus 870, 美国)对材料吸附Tl(Ⅰ)前后的官能团进行分析。用X射线光电子分光镜(XPS,Escalab 250Xi, 美国)分析材料吸附Tl(Ⅰ)前后的组分半定量和价态,其中C1s峰(284.8 eV)作为内标校准峰。
1.4 吸附实验
1.4.1 吸附因素影响
在吸附实验中,Tl初始质量浓度为10 mg/L,探究吸附剂用量(0.25~3.00 g/L)、溶液初始pH(3~9)和离子浓度(0~1.00 mol/L)等影响,若没有特殊说明,则所有实验在一个恒温水浴振荡器(170 r/min)内进行,温度保持在298 K,反应时间为720 min。反应完全后,用0.45 μm滤膜过滤,测滤液Tl的质量浓度。吸附实验均重复3次。
吸附剂用量对Tl的吸附量(qe)计算公式为
(1)
式中:C0和Ce分别为铊溶液初始质量浓度和平衡质量浓度(mg/L);V为原液体积(L);m为投加的吸附剂的质量(g)。
1.4.2 吸附动力学
溶液pH为7,吸附剂用量为1.00 g/L。不同反应时间段内(0~720 min)取一定量的样品,用0.45 μm滤膜过滤。采用拟一阶动力学(pesudo first order,PFO)和拟二阶动力学(pesudo second order,PSO)模型进行线性拟合。动力学方程为:
ln(qe-qt)=lnqe-K1t;
(2)
(3)
式中:qt为时间t对应的Tl的吸附量(mg/g);K1和K2分别为拟一阶(min-1)和拟二阶模型参数(g/(mg·min));t为反应时间(min)。
吸附剂的吸附过程包括外扩散(被吸附物质从原始溶液通过固液边界膜扩散到吸附剂表面)、内扩散(被吸附物质扩散到吸附剂内部孔隙)和活性位点的吸附。本研究采用颗粒内扩散(intra particle diffusion,IPD)模型来评价Tl(Ⅰ)吸附过程。IPD方程式为
qt=KIt0.5+I。
(4)
式中:KI为颗粒内扩散速率系数(mg·g-1·min-1/2);I为与边界层厚度有关的常数(mg/g)。
1.4.3 等温吸附
溶液pH为7,吸附剂用量为1.00 g/L,Tl溶液初始质量浓度为10~120 mg/L,温度分别设定为293,303,313 K。采用Langmuir(式(5))和Freundlich(式(6))模型描述等温吸附:
(5)
(6)
式中:qmax为拟合得到的最大吸附量(mg/g);KL为Langmiur常数(L/mg);KF为Freundlich常数((mg/g)(L/mg)(1/n)) ,其中1/n为异质性因子。
1.4.4 吸附热力学
吸附热力学参数计算公式如下:
(7)
ΔG0=-RTlnKd;
(8)
(9)
式中:Kd为吸附的分配系数;ΔG0、ΔH0和ΔS0分别为吉布斯自由能(kJ/mol)、焓(kJ/mol)和熵(kJ/mol);R为气体常数(8.314 J·mol-1·K-1);T为吸附温度(K)。ΔH0和ΔS0可以通过lnKd对1/T作图的斜率和截距计算得到。
2 结果与讨论
2.1 形态特征和元素组成
AAM和FMAAM的微观结构见图1,AAM表面略光滑(图1a),而FMAAM表面较粗糙并伴有致密的颗粒物(图1b),这是由加载在AAM表面以及裂缝中的FMO造成的。图2为FMAAM吸附Tl(Ⅰ)前、后的X射线能谱(EDX)及原子分数测试结果,分析表明:吸附前FMAAM中存在O,Al,Si,K,Ca,Mn和Fe元素(图2c),其中Fe与Mn的原子分数比接近3∶1,这与之前的报道[10]一致,也证明了FMO负载成功;吸附后Tl的原子分数为0.41%(图2d),证明Tl(Ⅰ)已被FMAAM成功吸附,与吸附前对比,吸附Tl(Ⅰ)后,K元素的原子分数降低,这是由于K+与Tl+之间发生了离子交换。
图3a中氮吸附和解吸等温线为凹状、无拐点,说明FMAAM的氮吸附和解吸等温线为国际理论与应用化学会(IUPAC)定义的Ⅲ型等温线。本研究对FMAAM的比表面积(SBET)、平均孔径和总孔体积进行测试,结果表明,FMAAM的SBET(36.830 m2/g)明显高于AAM(0.165 m2/g),且相差200倍以上(表1)。这是由于FMO负载在AAM上,显著增加了吸附剂的比表面积,同时也为Tl(Ⅰ)提供了更多的结合位点。FMAAM的孔径分布如图3b所示,平均孔径为202.48 nm。

图1 AAM(a)和 FMAAM(b)的扫描电镜图像

图2 FMAAM(a, c)和FMAAM-Tl(b, d)的X射线能谱图
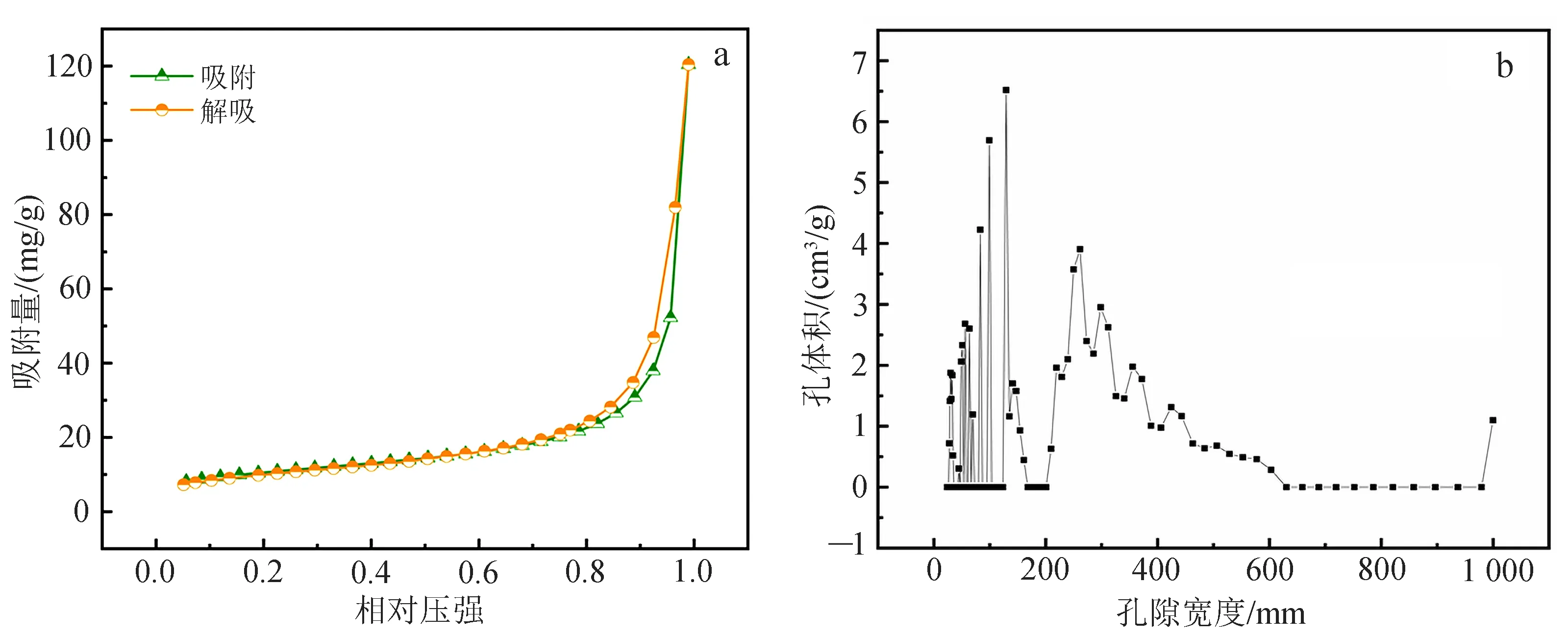
图3 FMAAM的氮吸附和解吸等温线(a)和孔径分布(b)

表1 FMAAM和AAM的物理特性
2.2 吸附因素影响
2.2.1 吸附剂用量
吸附剂用量可显著影响反应体系中结合位点的数量,从而影响吸附质的去除性能[19]。从图4可知:随着吸附剂用量的增加,FMAAM对Tl(Ⅰ)的去除率随之而增加,由79.2%增加至98.2%(溶液初始pH为7),而对Tl(Ⅰ)的吸附量则随之逐渐减小。这是由于FMAAM上的结合位点作用的效果,有限的结合位点限制了低吸附剂用量的FMAAM对Tl(Ⅰ)的去除率,随着吸附剂用量的增加,能与Tl(Ⅰ)结合的位点也增加,因此对Tl(Ⅰ)的去除率增加[20];当Tl(Ⅰ)初始质量浓度一定,随着结合位点的增加,未被Tl(Ⅰ)占用的结合位点数量也增加,因此对Tl(Ⅰ)吸附量降低。FMAAM吸附剂用量为1.0 g/L时,对Tl(Ⅰ)的去除率达到92.0%以上,吸附剂用量为3.0 g/L时,对Tl(Ⅰ)的去除率达到98.0%以上。若将Tl(Ⅰ)的去除率与实验成本结合,综合考虑,可选择FMAAM吸附剂用量为1.0 g/L作为后续的吸附实验。

图4 吸附剂用量对Tl(Ⅰ)吸附的影响
2.2.2 溶液初始pH
水溶液的pH会影响吸附剂与吸附质之间的静电相互作用[11],因此研究溶液pH对除铊效果的影响尤为重要。FMAAM对Tl(Ⅰ)的去除率以及吸附量随pH的变化如图5a所示。当吸附剂用量为1.00 g/L,pH为3~9时,FMAAM对Tl(Ⅰ)的去除率都高于89.0%,且在pH为7时,达到最高去除率(92.6%);这说明溶液的pH对FMAAM吸附Tl(Ⅰ)效果的影响较为微弱。pH≤7时,随溶液pH的增加,Tl(Ⅰ)的去除率和吸附量也随之增加。结合Zeta电位(图5b)分析,在溶液pH高于FMAAM的零电位2.69时,FMAAM表面聚集着大量的负电荷,会与溶液中的Tl离子之间产生静电吸引[21];同时,FMAAM中的Mn-OH和Fe-OH基团发生脱质子作用并与Tl(Ⅰ)络合[10],这有利于FMAAM对Tl(Ⅰ)的吸附。考虑到Tl(Ⅰ)的去除效果,选择pH=7作为后续的吸附实验的pH值。

图5 FMAAM去除Tl(Ⅰ)的初始pH依赖性(a)和 FMAAM的Zeta电位(b)
2.2.3 离子浓度
Na+广泛存在于天然水和工业废水中[22],与Tl(Ⅰ)离子争夺吸附剂上的结合位点[23]。图6中:在低离子浓度(<0.01 mol/L)下,去除率在90.0%以上,说明Na+的存在对FMAAM吸附Tl(Ⅰ)影响不大;这是由于FMAAM上有足够的结合位点提供给Tl(Ⅰ)。当Na+浓度为1.00 mol/L时,去除率不高于50.0%,可见FMAAM对Tl(Ⅰ)的吸附受到明显抑制;这是由于大量的Na+和Tl(Ⅰ)竞相争夺铁锰氧化物上的结合位点,导致Tl(Ⅰ)的去除率显著降低[10]。而两者竞争结合位点可能是它们具有相似的化学性质,如离子半径和电负性[24]。总体来说,随着离子浓度的增加,FMAAM对Tl(Ⅰ)的去除率逐渐降低。

图6 离子浓度对Tl(Ⅰ)吸附的影响
2.2.4 Tl(Ⅰ)吸附动力学
吸附动力学是评价吸附剂吸附特性的重要指标[25-27]。图7a显示,整个吸附过程的前30 min吸附非常快速,随后,吸附效率增加变慢,在120 min时几乎达到吸附平衡。这是由于FMAAM在吸附初期可以为Tl(Ⅰ)提供大量的结合位点[20],因此FMAAM对Tl(Ⅰ)的吸附相对较快。但随着吸附反应的进行,Tl(Ⅰ)的质量浓度和FMAAM上的结合位点分别降低和减少。最终,FMAAM上的结合位点达到吸附饱和状态,即吸附平衡。与PFO模型(图7b)相比,PSO模型(图7c)可以很好地拟合Tl(Ⅰ)吸附过程,且相关系数较高(r2=1.000,表2);说明化学吸附是Tl(Ⅰ)吸附过程中的主要反应,且PSO模型计算的Tl(Ⅰ)平衡吸附容量与实验数据接近。
IPD模型(图7d)用于对吸附过程进行拟合,进一步探讨吸附动力学机理,为研究Tl(Ⅰ)的去除率和评价其速率控制步骤提供了另一种思路[20]。本研究将FMAAM对Tl(Ⅰ)的吸附过程分为膜扩散、颗粒内扩散、吸附/解吸平衡3个步骤。IPD模型拟合参数见表3,粒内扩散速率系数大小为KI, 1>KI, 2>KI, 3。膜扩散阶段可归因于Tl(Ⅰ)迅速占据了FMAAM上容易获得的表面结合位点,

a. 吸附动力学;b. PFO模型;c. PSO模型;d. 颗粒内扩散模型。

表2 FMAAM的Tl(Ⅰ)吸附动力学模型拟合参数

表3 FMAAM吸附Tl(Ⅰ)的IPD模型拟合参数
FMAAM与Tl(Ⅰ)之间发生静电吸附。在颗粒内扩散和吸附/解吸平衡阶段,扩散速率下降,吸附缓慢达到饱和。由于大量的Tl(Ⅰ)被吸附在FMAAM的外表面,提供吸附作用的结合位点减少,而被吸附的Tl(Ⅰ)进一步进入孔隙内部,最终导致扩散阻力增加[15]。有研究[11,28]表明,线性曲线不通过原点,那么颗粒内扩散过程并不是控制Tl(Ⅰ)吸附限速的过程,而这可能涉及化学反应。显然,本研究得出的结论相同。
2.2.5 吸附等温线和吸附热力学
等温线的变化有助于预测吸附剂与吸附质之间的相互作用以及吸附层的性质[28-30]。采用吸附等温线研究FMAAM在不同温度下对不同质量浓度的Tl(Ⅰ)(0~70 mg/L)的吸附能力(图8)。等温吸附参数如表4所示,Langmuir等温模型(图8a,r2>0.900)的拟合优于Freundlich等温模型(图8b,r2<0.900),这说明FMAAM的吸附过程主要是单分子层吸附,且FMAAM表面存在Tl(Ⅰ)的均相结合位点[31]。以分离因子RL(RL=1/(1+KL)C0)评价吸附反应是否易于发生[32],FMAAM的RL(0.076~0.086)值在0~1范围内,表明吸附反应易于发生[28]。在不同温度下,FMAAM对Tl(Ⅰ)吸附的异质性因子(1/n)中的n取值介于2 ~ 3之间,说明FMAAM对Tl(Ⅰ)的吸附是简单易行而快速的[26]。FMAAM的Langmuir等温参数表明,吸附温度293、303、313 K下吸附剂对Tl(Ⅰ)的最大吸附量分别为61.50,61.09,64.64 mg/g(表4),明显高于同温度条件下的活性炭(10.53 mg/g)[33]、锯末(13.18 mg/g)[34]和纳米Al2O3(5.78 mg/g)[35](表5),说明FMAAM可作为去除水溶液中Tl(Ⅰ)的一种替代品。

a. Langmuir模型;b. Freundlich模型。
吸附热力学参数见表6。在所有测试温度下:ΔG0均为负值,表明FMAAM对Tl(Ⅰ)的吸附过程是自发的,同时,温度升高使ΔG0降低,说明温度升

表4 FMAAM去除Tl(Ⅰ)的Langmuir和Freundlich等温模型参数
高有利于吸附过程;ΔH0为正值,说明FMAAM吸附Tl(Ⅰ)的过程是吸热的过程;ΔS0为正值,表明吸附过程中吸附剂与液体界面的随机性增大。

表5 不同吸附剂对Tl的吸附量

表6 FMAAM吸附Tl(Ⅰ)的热力学参数
2.3 FMAAM吸附Tl(Ⅰ)机理分析
FMAAM吸附前后表面官能团的傅里叶变换红外光谱(FTIR)谱图(400~4 000 cm-1)如图9所示。在3 426 cm-1处的宽频带吸附峰与吸附水分子的弯曲振动和-OH基团的伸缩振动相符[36]。FMAAM吸附Tl(Ⅰ)后,3 426 cm-1处的峰有所减弱,这可能是由于Fe-OH或Mn-OH与Tl(Ⅰ)发生络合[10]。1 646 cm-1处的峰值对应-OH的弯曲振动。FMAAM吸附Tl(Ⅰ)前后,在998和875 cm-1附近均存在Si-O的伸缩振动和Al-O-H的弯曲振动,说明吸附材料由Si、Al、O等元素组成,材料吸附后基体结构未发生破坏。539 cm-1处的峰值是FMAAM-Tl中Si-O-Al或O-M(金属)拉伸的弯曲振动[36,37]。465 cm-1处的峰是化学反应生成的Fe-O-Mn基团[10]。
图10a为FMAAM和FMAAM-Tl的全谱图,且吸附前后都存在Fe、Mn、Si、Al、Ca、O等基本元素。如图10b所示,FMAAM的Fe 2p具有双峰Fe 2p1/2和Fe 2p3/2,结合能分别为724.9和711.3 eV。此外,Fe 2p的2个自旋轨道能级之间的能量差为13.6 eV[10],同时,Fe 2p有2个卫星峰,这是Fe(Ⅲ)表现的特征[38]。Mn 2p的2个峰分别为Mn 2p1/2和Mn 2p3/2,对应的结合能分别为653.7和642.1 eV(图10c)并且双峰之间的卫星峰不明显,这是Mn(Ⅳ)所表现的特征[10]。因此,FMAAM中的Fe和Mn的价态分别为三价态和四价态。当FMAAM吸附Tl(Ⅰ)之后,Fe 2p峰的质心基本保持不变,而Mn 2p3/2峰与吸附前相比,其质心略微向

图9 FMAAM和FMAAM-Tl的FTIR光谱

a. FMAAM和FMAAM-Tl的全谱图;b. FMAAM的Fe 2p;c. FMAAM的Mn 2p。
低结合能处偏移,这表明在吸附Tl(Ⅰ)后,Fe的化学价态保持不变,然而部分四价Mn发生还原[10],由此推断Tl(Ⅰ)氧化为Tl(Ⅲ)并以Tl2O3状态沉淀于FMO复合活性铝硅酸盐矿物上。
3 结论
1)利用Fe-Mn二元氧化物和活性铝硅酸盐矿物合成了FMAAM吸附剂,并将其应用于水溶液中Tl(Ⅰ)的去除,在较宽的pH范围(3~9)内表现出了良好的效果。
2)温度为293 K时,FMAAM对Tl(Ⅰ)的最大吸附量达到61.50 mg/g。但是,竞争离子对吸附有较大影响,当Na+浓度大于1.00 mol/L时,对Tl(Ⅰ)的去除率低于50.0%。
3)FMAAM吸附Tl(Ⅰ)的过程可由拟二阶动力模型和颗粒内扩散模型较好拟合;与Freundlich模型相比,Langmuir模型能较好地拟合吸附体系的等温吸附。经分析和表征,FMAAM对Tl(Ⅰ)在水溶液中的吸附机理涉及吸附剂表面-OH基团和K+的离子交换、Fe-OH或Mn-OH和Tl(Ⅰ)的络合,及Tl(Ⅰ)的氧化沉淀。

