松香淀粉酯的酶催化制备及其对原花青素的负载研究
史永桂, 林日辉, 焦思宇, 林春燕, 陆晓娜, 杨麦秋
(广西多糖材料与改性重点实验室;广西林产化学与工程重点实验室;广西民族大学化学化工学院,南宁 530006)
原花青素是一类具有多种生物活性的多酚化合物的总称,其具有无毒、高生物的利用和抗氧化性特点,在人体内有较强的体内活性因子,因此被广泛应用于药品、食品、化妆品等领域[1]。Feldman 等[2]研究发现,蔓越莓原花青素可以抑制白色念珠菌在体外培养的口腔上皮细胞上的活力,可以有效阻止口腔上皮细胞的炎症发生。Yamakoshi[3]通过对大鼠口服葡萄籽的提取物原花青素进行急性毒剂量和慢性毒剂量实验,结果表明两种情况下均无毒副作用,为原花青素在体内给药提供了可靠的参考。Sato[4]对大鼠口服100 mg/d的原花青素,持续喂食3周后,发现大鼠的心脏在缺血-再灌注的收缩恢复功能提高,心肌梗死范围明显减少。可见原花青素在医药的应用方面具有较高的潜在价值,但原花青素本身不稳定性,药效作用也极易受到剂量、体内释放速度以及体内环境等因素影响,药效不佳。郭宝慧等[5]研究了原花青素的抗氧化活性与剂量呈现效应关系,当原花青素超过一定的浓度时,抗氧化性将随着浓度的升高而降低。阎娥等[6]发现蚕豆壳提取的原花青素,对羟自由基(OH)的清除能力随浓度变化很大,结果表明当提取物的浓度高于0.01 mg/mL时,OH的清除率开始降低。Jacqueline[7]发现在不同的pH下,原花青素的抗氧化性有明显的差别,在胃的酸性条件下原花青素聚合物容易分解。高冠勇等[8]对花生红衣原花青素的稳定性研究发现PC在光照条件下会发生氧化,失去抗氧化的性质。为了充分发掘原花青素的药用价值,需要开发新的制剂技术,包埋和负载缓释成为了原花青素的研究方向,天然材料的生物相容性,使其成为药物负载缓释的研究热点。
淀粉作为一种天然的高分子材料,在药品、食品、化妆品和燃料生产方面有广泛的应用[9,10]。Sai[11]用辛烯基琥珀酸酐对淀粉进行疏水改性并通过渗析包埋法制成OSA淀粉纳米球,对芦丁进行负载进行了体外释放研究,结果表明改性后的OSA可有效将芦丁负载并能良好的体外持续释放。Zhu等[12]用可溶性淀粉和环氧氯丙烷合成环氧氯丙烷淀粉微球(ECM),以精氨酸为模型药物,研究了ECM的载药量和体外释放性能,结果表明ECM的载药量可达31 mg/g,可在体外持续25 h释放精氨酸。此外一些研究也表明改性淀粉对负载的药物具有保护功能。刘占军等[13]对淀粉接枝聚甲基丙烯酸甲酯并制备成纳米粒,与虾青素混合制备成虾青素纳米粒,研究了虾青素纳米粒在不同的温度、pH、不同的光照条件下虾青素的稳定性,结果表明,在不同的条件下虾青素的纳米粒的保留率都有所提高,其中光照条件下的保留率相对丙酮溶液提高了58.1%。
松香基团具有强疏水性能,研究表明原木薯淀粉和松香在脂肪酶的催化下可酯化制备具有一定疏水性能的松香淀粉酯[14]。淀粉颗粒表面的羟基被部分取代,增加了淀粉表面的疏水性,提高了对疏水性物质亲和力。巫佳[15]通过RAS对苯酚和多环芳香烃苯并芘进行吸附研究,发现RAS 能够较好地分散在水溶液中,能较好地吸附疏水性的多苯环结构物质,是一种良好的生物降解材料的吸附剂。因此,采用松香酸对淀粉进行疏水改性,研究其在水溶液中的稳定性和对水溶性差的药物负载能力,为改性淀粉作为药物载体提供参考。
1 材料与方法
1.1 材料与试剂
原木薯淀粉,食品级;松香,AR级;原花青素,脂肪酶:BR。
1.2 仪器与设备
TG1650-WS 型台式高速离心机;SUPRA 55 Sapphire 型场发射扫描电子显微镜;A vance600MHz型核磁共振;85-2型数显恒温磁力搅拌器。
1.3 方法
1.3.1 不同取代度RAS的制备
参考杨慧等[14]的方法制备RAS,并加以改进。称量3 g烘干的原木薯淀粉和12 g松香于锥形瓶中,加入50mL的氯仿作为溶剂,在培养箱中震荡5 min,使松香完全溶解。移取脂肪酶、水、乙醇各200 μL的加入反应混合物中,于55 ℃,180 r/min的震荡培养箱中,反应若干小时。反应结束后,取出抽滤,收集滤饼,用无水乙醇清洗4次。产物放入60 ℃鼓风干燥箱过夜至恒重,即得松香淀粉酯。
1.3.2 酯化淀粉取代度测定
根据Lin[16]的方法适当改进,采用酸碱滴定法测定酯化淀粉的取代度。分别称取2 g酯化淀粉和原木薯淀粉,放入150 mL的锥形瓶中并加入50 mL的0.1 mol/L的氢氧化钠溶液,在磁力搅拌器上55 ℃皂化3 h。将皂化后的溶液冷却至室温,加入0.5 mol/L的盐酸溶液8.5 mL搅拌均匀,滴加2~3滴酚酞作为指示剂再用0.025 mol/L的盐酸进行滴定至终点。取代度计算公式为:
(1)
(2)
式中:W为松香基团的质量分数;C为滴定盐酸的标准浓度0.025 mol/L;V1为原木薯淀粉滴定消耗盐酸的体积/L;V2为样品淀粉滴定消耗盐酸的体积/L;m为样品的质量/g;285为松香基团的平均相对分子质量。DS为淀粉分子上每个葡萄糖单元上的羟基平均被取代的数量;162为淀粉分子上葡萄糖单元平均分子量。
酯化反应时间分别为3、6、9 h,代入公式计算得出取代度,得到制备的RAS的取代度分别为0.002 44、0.008 11、0.016 5。
1.3.3 原木薯淀粉和RAS扫描电镜分析
取一定量的原木薯淀粉和不同取代度的RAS均匀的撒到双面导电胶上,轻轻吹去多余的浮样,置于真空镀膜仪下喷镀钯金,制成电镜观察样品,扫描电镜下用500倍和5000倍拍照观察。
1.3.4 原木薯淀粉和RAS的1H NMR分析
取少量干燥的原木薯淀粉和不同取代度的RAS,以DMSO-D6为溶剂,利用Avance 400 MHz核磁共振波谱仪检测1H NMR波谱图[17]。
1.3.5 原花青素标曲的制备
以水为溶剂,配置不同浓度梯度的原花青素溶液,用紫外分光光度计测量280 nm处吸光度。以原花青素浓度为横坐标X(mg/mL),吸光度为纵坐标Y。得到原花青素的标准曲线为Y=12.925X-0.007 3,相关系数为R2=0.999 5。
1.3.6 原木薯淀粉和不同RAS对PC的吸附
按照吴朝霞[18]吸附方法并做适当调整,称取0.1 g的原木薯淀粉和酯化淀粉作为吸附剂放入2 mL的离心管中,加入1 mL的原花青素溶液,将离心管放在血液混凝器进行避光吸附操作,以不加淀粉的原花青素溶液作为对照。
将吸附反应完成后的混合液用高速离心机8 000 r/min离心5 min,移取上清液50 μL,加入10 mL的棕色比色管中,加入10 mL的蒸馏水稀释200倍,摇匀在紫外分光光度计下测量吸光度,原花青素的吸附量计算见式(3)。
(3)
式中:q为吸附量/mg/g;C1为原花青素溶液质量浓度/mg/mL;C2为吸附后的原花青素溶液质量浓度/mg/mL;V为原花青素溶液体积/mL;200为稀释倍数;m为用于吸附原花青素的样品干质量/g。
1.3.7 酯化淀粉吸附原花青素的单因素实验
分别以原木薯淀粉和不同取代度RAS对PC吸附量为指标,考察在不同的吸附时间、浓度、温度的影响。
1.3.7.1 不同的吸附浓度对吸附量的影响
称取0.1 g的不同取代度的RAS和原木薯淀粉为吸附剂,放入2mL的离心管中,分别加入1 mL浓度为3、6、9 mg/mL的原花青素溶液,在室温(25 ℃)下,于血液混凝器上避光吸附60 min,研究不同浓度对吸附量的影响。
1.3.7.2 不同的吸附时间对吸附量的影响
称取0.1 g的不同取代度的RAS和原木薯淀粉为吸附剂,放入2 mL的离心管中,加入 1 mL浓度为9 mg/mL的原花青素溶液,于血液混凝器上在室温(25 ℃)下避光进行吸附,吸附时间分别为15、30、45、60 min,研究吸附时间对吸附量的影响[18]。
1.3.7.3 不同吸附温度对吸附量的影响
参考原花青素对温度的稳定性研究结果,原花青素在80 ℃下才会分解,因此温度梯度不能过高。称取0.1 g的不同取代度的RAS和原木薯淀粉为吸附剂,放入2 mL的离心管中,分别在25、40、50、60 ℃的震荡培养箱中避光吸附,时间为60 min,研究吸附温度对吸附量的影响。
1.4 稳定性实验
将吸附后的淀粉与PC的混合液放入血液混凝器上,室温下避光静置1、2、4、8 d,以PC溶液作为对照,测定记录混合液和PC溶液的吸光值变化。
1.5 数据分析
实验如无特殊说明,均进行3次重复, Excel 2010对数据统计,采用Photoshop对图片排版,利用Origin2018软件进行绘图和分析。
2 结果与分析
2.1 原木薯淀粉与RAS的电镜图
由图1知在电镜分析下原木薯淀粉颗粒保持圆形和椭圆形,不同取代度的RAS仍能保持与原木薯淀粉的颗粒形貌,表明酯化反应不会破坏原木薯淀粉的颗粒形状,这与已有的结果相似。原木薯淀粉表面和边缘光滑, RAS表面则较为粗糙,表明松香酸成功在原木薯淀粉表面发生了酯化,产生了酯化斑点[19]。淀粉颗粒较大,结晶度高,酯化反应只发生在淀粉的表面。随着取代度的提高,可观察到淀粉表面酯化斑点增多,斑点也较大。可能的原因是,淀粉某一位点与松香酸发生反应后,该位点上的松香酸基团与溶液中的松香酸相亲性增大,使得在淀粉表面的该位点局部连续产生酯化反应,形成酯化聚集颗粒。

图1 RAS和原木薯淀粉电镜图
2.2 淀粉样品的1H NMR分析
NMR通过不同的化学取代基团在NMR中的特征峰的不同来判断物质的结构。淀粉分子上的羟基在酯化反应中被取代,RAS上的葡萄糖单元质子的共振会发生变化。由图2可知与原木薯淀粉相比,RAS的1H NMR谱图在1.125和1.225产生新的氢原子吸收峰,这是松香酸上的甲基和亚甲基上的氢质子产生的吸收峰[20],峰强度随DS增大而增强,表明松香酸基团接枝在淀粉上随DS增大而增多。
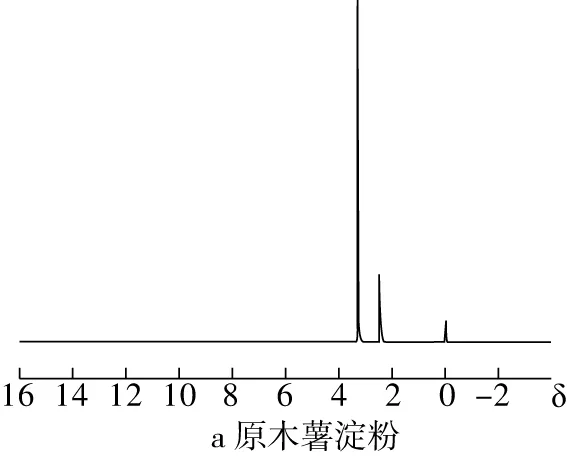
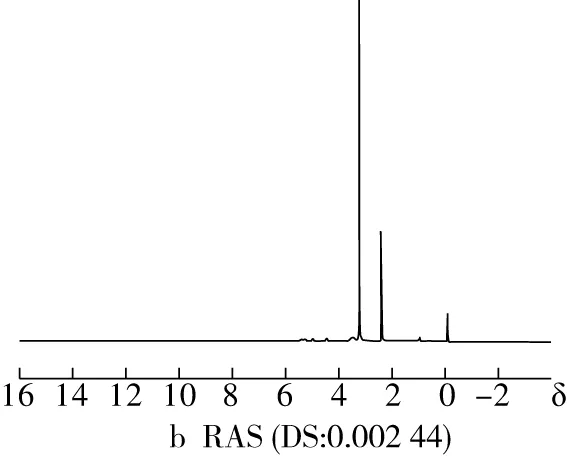
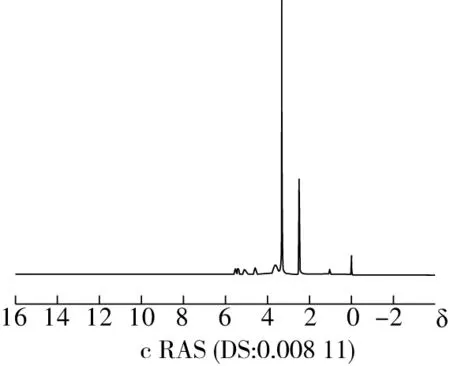

图2 RAS和原木薯淀粉的1H NMR图
2.3 不同吸附浓度对吸附量的影响
PC的初始浓度在RAS和原木薯淀粉对吸附有着重要影响。由表1可知,在25 ℃,吸附时间为60 min时,随着PC的浓度增大,原木薯淀粉和RAS表面对PC分子的相互作用力增强,从而增加了吸附的量。RAS的疏水性,使得RAS颗粒在PC溶液中能更好地接触吸附质。但取代度为0.002 44的吸附量略低于原木薯淀粉,因酯化反应取代了淀粉上的羟基,使得淀粉颗粒和PC之间形成的氢键作用力减弱,减少了吸附量,表明该吸附是范德华力和分子间的氢键的共同作用的结果[21]。
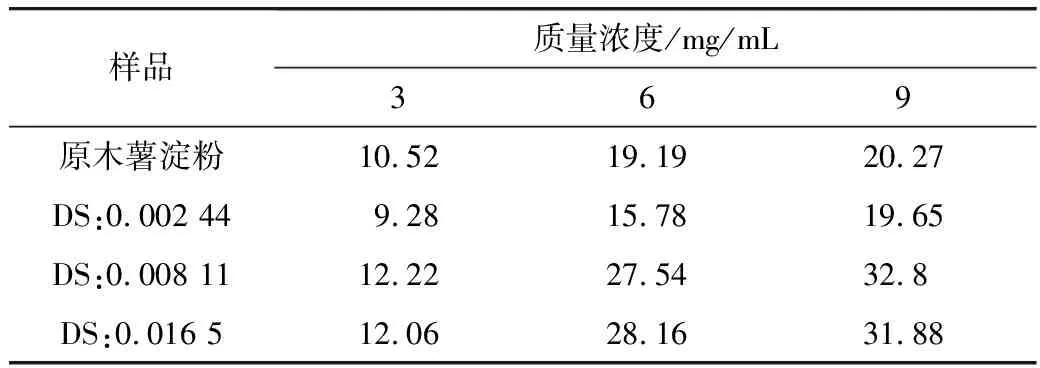
表1 不同质量浓度PC对吸附量的影响/mg/g
由表2可知,在25 ℃,吸附时间为60 min,当PC质量浓度为9 mg/mL时,DS为0.00811的RAS相对原木薯淀粉的吸附量提高百分比最高。表明改性后的原木薯淀粉能有效提高对PC的吸附量,且随PC浓度增加,RAS对PC的吸附能力相对原木薯淀粉也随之提高。

表2 不同PC质量浓度下RAS相对原木薯淀粉吸附量提高的百分比/%
2.4 不同吸附时间对吸附量的影响
由图4可知,RAS和原木薯淀粉对PC的吸附速度较快,DS为0.008 11和DS为0.016 5的RAS 在30 min已基本达到吸附的饱和量,但原木薯淀粉和DS为0.002 44在45 min达到吸附饱和量,这与已有的研究结果相近。DS较高的RAS相对原木薯淀粉在短时间内可达到饱和吸附量,可能与RAS在水中的颗粒分散性较好有关。在吸附时间45 min,原花青素质量浓度为9 mg/mL,原木薯淀粉的饱和吸附量为20.19 mg/g,酯化取代度为0.002 44、0.008 11、0.016 5的淀粉,饱和吸附量分别为19.41、31.88、32.19 mg/g。
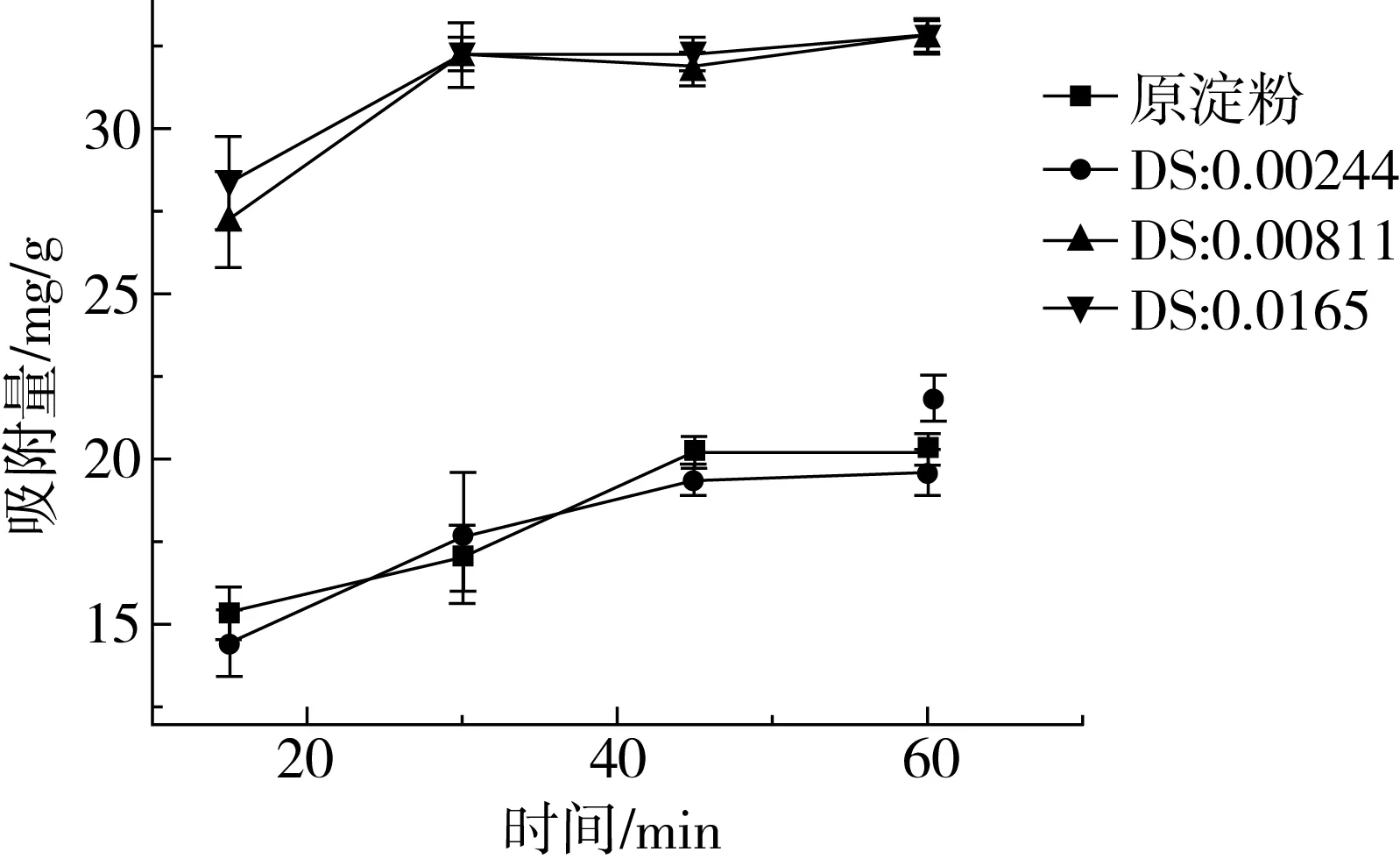
图3 吸附时间对原花青素的吸附量影响
DS为0.0165的RAS在吸附时间为30 min时相对原木薯淀粉的吸附能力最高。RAS相对原木薯淀粉对PC的吸附速度随时间先提高再降低,原木薯淀粉颗粒在水中易聚集形成颗粒聚集物,吸附剂的比表面积减小,吸附速率降低。表明吸附过程物理吸附占主导作用,吸附质主要集中在淀粉颗粒表面,RAS在30 min内RAS对PC的亲和力较原木薯淀粉高,能更快对PC完成吸附。
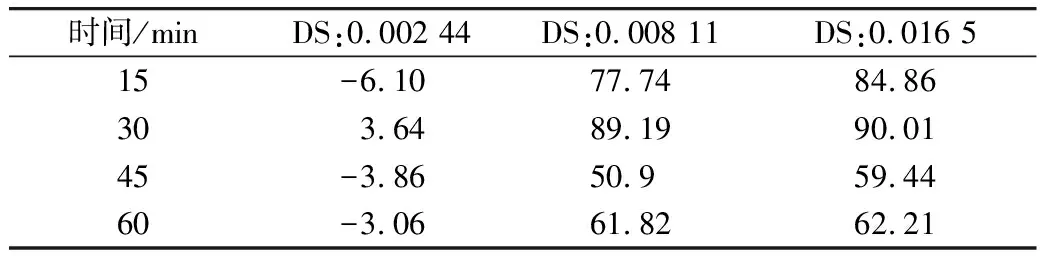
表3 不同吸附时间下RAS相对原木薯淀粉吸附量提高的比例/%
2.5 不同温度对原花青素的吸附量的影响
由图2可知,原木薯淀粉和RAS对PC的吸附随温度的升高而增加,物理吸附主要与吸附质分子与吸附剂相接触完成吸附过程。温度提高,使原花青素的分子运动速率增加,从而增加了PC与淀粉表面官能团接触的几率,增加了吸附量。在60 ℃时原木薯淀粉的吸附量是39.15 mg/g、酯化取代度为0.002 44、0.008 11、0.016 5的淀粉,吸附量分别为37.45、44.72、40.39 mg/g。这与在PC浓度为30 mg/g下,微孔淀粉的吸附量结果相近,表明RAS可在较低的PC浓度下,达到较高的吸附量。
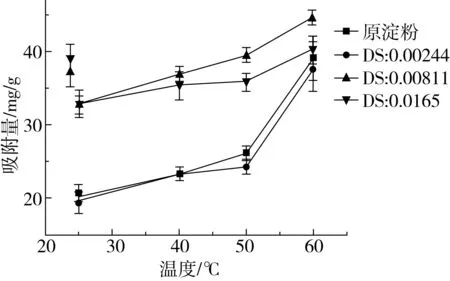
图4 吸附温度对原花青素吸附量的影响
通过表4可知,随着温度的升高,RAS相对原木薯淀粉对PC的吸附速度降低,原木薯淀粉在温度上升后,聚集的原木薯淀粉颗粒在溶剂中分散开来,使得原木薯淀粉的吸附能力增加,对PC的吸附速率增加。RAS由于疏水性,减少了淀粉颗粒之间的聚集,相同温度下在水中的分散性较原木薯淀粉较好。
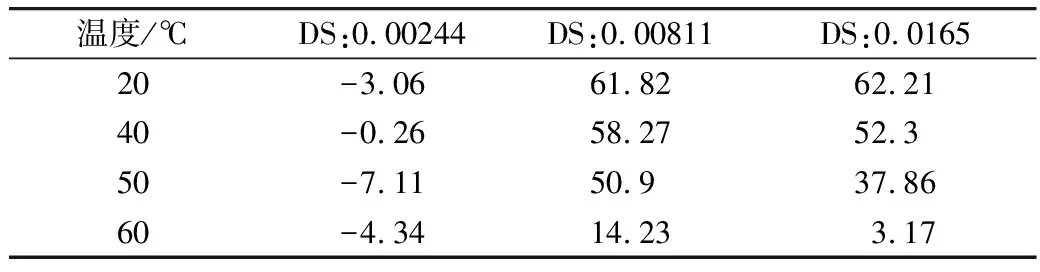
表4 不同吸附温度下RAS相对原木薯淀粉吸附量提高的百分比/%
2.6 原花青素稳定性实验
原花青素在水溶液中不稳定,易发生可逆反应,使显色物质的含量降低,即使是在室内闭光的条件下仍会发生降解生成副产物,使PC溶液的颜色逐渐变浅,吸光值降低[22]。记录吸光值的变化可以计算PC保留率。由图5知,24 h内淀粉吸附的溶液中PC的保存率在90%以上,高于PC溶液的保留率,表明经过淀粉吸附后溶液具有一定的稳定性,淀粉吸附后的溶液在24 h内对PC具有较好的保存作用,为淀粉在负载药物方面提供参考。

图5 PC保留率随时间的变化
3 结论
本实验通过脂肪酶在两相体系中催化合成了RAS,与原木薯淀粉相比, RAS表面的疏水性增加,提高了对疏水性药物的亲和力,有利于对疏水性药物的负载。提高温度和PC浓度,均可提高原木薯淀粉和RAS对PC的负载量; DS为0.008 11和0.016 5的RAS可明显提高对PC的负载量且可较快达到吸附平衡,常温下RAS最高负载量可达32.19 mg/g,相对原木薯淀粉最高可提高90.01%;淀粉吸附后的溶液在24 h内对PC的保存率在90%以上,具有明显的保持药物的稳定性。但RAS对PC的负载还有待研究,在药物缓释和模拟肠胃液稳定性方面的实验还有待展开。

