巴戟天中有效成分在Caco-2细胞模型中的吸收转运△
张超,华悦,李喆,史辑
辽宁中医药大学 药学院,辽宁 大连 116600
巴戟天是茜草科植物巴戟天Morinda officinalisHow.的干燥根,味甘、辛,性微温,归肾、肝经,是我国著名的“四大南药”之一。其主要作用是补肾阳、强筋骨、祛风湿,常用于阳痿遗精、宫冷不孕、少腹冷痛、筋骨萎软等证[1]。《中华人民共和国药典》2020 年版巴戟天含量测定项选用耐斯糖为定量指标成分[1]。巴戟天还含有以水晶兰苷、去乙酰车叶草苷酸为代表的环烯醚萜类成分,具有抗衰老、抗肿瘤、抗骨质疏松等多方面的药理作用[2-6]。
中药大多经口服吸收,小肠为口服给药的主要吸收部位,吸收效果易受到药物浓度、跨膜转运方式、转运蛋白等多种因素影响。由于人结肠癌细胞Caco-2 与人体小肠上皮细胞有相似的形态、细胞极性及连接方式,且拥有小肠上皮细胞中的碱性磷酸酶、P-糖蛋白(P-gp)、糖类、谷氨酰转肽酶、维生素等代谢酶及转运体,因此Caco-2 细胞单层模型被广泛应用于药物在肠道中的吸收、转运、代谢的体外研究[7-10]。因此,本实验采用Caco-2 细胞单层模型对巴戟天中水晶兰苷、去乙酰车叶草苷酸和耐斯糖3 个特征性成分的肠吸收特性进行研究,明确其吸收转运机制,以期为巴戟天有效成分的进一步开发提供参考。
1 材料
1.1 细胞
Caco-2细胞购自中国科学院上海细胞库。
1.2 试药
DMEM 高糖培养基、无酚红DMEM 高糖培养基、非必需氨基酸、胰蛋白酶、Hank′s 平衡盐溶液(HBSS)均购自美国Gibco 公司;胎牛血清(FBS,美国PAN 公司);青-链霉素双抗(美国Hyclone 公司);磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、苯酚红均购自北京索莱宝科技有限公司;CCK-8 细胞活力检测试剂盒、碱性磷酸酶(AKP)试剂盒均购自南京建成生物科技有限公司;水晶兰苷(批号:O0605AS,纯度≥98.0%)、去乙酰车叶草苷酸(批号:J0329AS,纯度≥98.0%)、盐酸普萘洛尔(批号:318-98-9,纯度>98%)均购自大连美仑生物技术有限公司;耐斯糖(批号:292-64121,纯度≥99.0%,日本Wako 公司);盐酸维拉帕米(批号:S420204,纯度>99%,美国Selleck Chemicals公司);甲醇、乙腈等试剂均为分析纯;水为超纯水。
1.3 仪器
H-Class/Xevo TQD 型三重四级杆液相色谱-质谱联用仪(配有Masslynx 4.1色谱工作站)、ACQUITY UPLC 型超高效液相色谱仪、Ulyimate UHPLC AQC18色谱柱(50 mm×2.1 mm,1.8 μm)、ACQUITY UPLC BEH Amide 色谱柱(100 mm×2.1 mm,1.7µm)均购于美国Waters 公司;AE240 型十万分之一电子分析天平(瑞士梅特勒-托利多公司);XW-80A型涡旋混合器(上海青浦沪西仪器厂);Multiskan MK3 型酶标仪(美国赛默飞世尔科技有限公司);YXQ-LS-75S11 型立式压力蒸汽灭菌器(上海博讯科学仪器有限公司);DCMC510 型倒置显微镜(日本奥林巴斯公司);MCO-15AC 型CO2培养箱(日本三洋公司);DW-86W100 型卧式超低温保存箱(青岛海尔医疗设备股份有限公司);Millecell-ERS 型跨膜细胞电阻仪(美国Millipore 公司);SHA-C 型恒温振荡器(常州国华电器有限公司)。
2 方法
2.1 Caco-2细胞单层模型制备
Caco-2 细胞接种于25 cm2细胞培养瓶中,采用DMEM 完全培养基(DMEM 高糖培养基41.5 mL 加入青-链霉素双抗0.5 mL、非必需氨基酸0.5 mL、FBS 7.5 mL),于37 ℃、5%CO2的细胞培养箱中培养。取第6~10代Caco-2细胞制成悬液,控制细胞密度为5×103个/mL,接种于24 孔Transwell 中,于肠腔(AP)侧加入细胞悬液0.5 mL,于基底(BL)侧加入完全培养液1.5 mL,在CO2培养箱中培养,前10 d 隔天换液,10 d 后每天换液,培养至21 d待用。
2.2 Caco-2细胞单层模型验证
2.2.1 细胞形态学验证 将细胞以2.1 项下相同密度接种于24 孔板中,培养21 d,于光学显微镜下拍照,观察细胞形态[11]。
2.2.2 跨膜电阻(TEER)考察 细胞接种于Transwell小室中后,于第0、3、6、9、12、15、18、21 天分别测定TEER,待TEER>300 Ω·cm–2时,说明此单层细胞模型已致密、完整[12-13]。
2.2.3 酚红透过率考察 酚红是一种水溶性小分子物质,不易被Caco-2 细胞代谢及过膜转运,因此选取酚红作为泄露标志物进行考察。于接种后第3、6、9、12、15、18、21 天分别测定细胞中酚红透过率。弃去细胞原有培养基,加入预热至37 ℃的无酚红完全培养基,放置于CO2培养箱中平衡30 min,弃去培 养基,于AP 侧加入含酚 红5 μg·mL–1的HBSS 0.5 mL,BL 侧加入HBSS 1.5 mL,培养3 h。3 h后于BL侧取培养基0.3 mL,在波长为560 nm 处测定吸光度(A),按照公式(1)计算BL 侧酚红透过量,并按照公式(2)计算表观渗透系数(Papp)[14]。

(1)式中Q为透过药物的总质量(μg);VBL为BL 侧培养基总体积(1.5 mL);ABL为BL 侧培养基吸光度;A空白组为空白HBSS 的吸光度;A0为酚红初始浓度吸光度;C0为药物初始质量浓度(μg·mL–1)。
(2)式中dQ/dt为dt时间段中透过的药物质量(μg·s–1);S为单层细胞表面积(cm2),本实验中为0.3 cm2。
2.2.4 AKP 活性考察 AKP 是小肠进行消化活动时的必需酶,其主要集中于Transwell AP 侧,且其含量随细胞的分化而增加。分别取Transwell 中培养了7、14、21 d的细胞,吸弃旧培养基,用已预热至37 ℃的HBSS 冲洗2~3 次,在AP 侧加入HBSS 0.5 mL,BL侧加入HBSS 1.5 mL,置于培养箱中孵育20 min,取AP 侧和BL 侧培养基,离心(70×g,5 min),取上清液用试剂盒测定AKP 活性,操作参照说明书。
2.3 化合物给药质量浓度筛选
精密称取水晶兰苷5.062 mg、去乙酰车叶草苷酸20.003 mg、耐斯糖100.225 mg,分别用HBSS溶解并进行稀释,配制成含水晶兰苷5.062、2.531、1.266、0.633、0.316、0.158 mg·mL–1,去乙酰车叶草苷酸20.003、10.001、5.000、2.500、1.250、0.625 mg·mL–1,耐斯糖100.225、50.113、25.056、12.528、6.264、3.132 mg·mL–1的溶液。
将消化后的Caco-2细胞以1×105个/cm2接种于96孔板中,每孔100 μL,培养24 h。弃去上清液,各加入完全培养基90 μL 和各质量浓度的药物10 μL,每个质量浓度设3个复孔,同时设立3个对照孔(不加药)和3 个空白孔(无细胞)。培养24 h 后,各孔加入CCK-8溶液10 μL,培养1 h,在450 nm 下用酶标仪测定A,按照公式(3)计算细胞存活率。

2.4 化合物给药pH筛选
经2.3项下质量浓度筛选,采用HBSS分别配制水晶兰苷(0.127 2 mg·mL–1)、去乙酰车叶草苷酸(0.064 8 mg·mL–1)、耐斯糖(1.250 2 mg·mL–1)溶液,均采用HCl 和NaOH 调节pH 为5.8、6.8、7.4,按2.3项下方法测定A,计算细胞存活率。
2.5 转运实验
2.5.1 化合物不同质量浓度对转运的影响 用HBSS 稀释各化合物达到所需质量浓度,与完全培养基1∶9 混合得样品溶液,终质量浓度分别为水晶兰苷0.127 2、0.063 6、0.031 8 mg·mL–1,去乙酰车叶草苷酸0.064 8、0.032 4、0.016 2 mg·mL–1,耐斯糖1.250 2、0.625 1、0.312 5 mg·mL–1;取符合转运条件的Caco-2 细胞单层模型,用HBSS 清洗3 次,于AP 侧加入HBSS 0.5 mL,BL 侧加入HBSS 1.5 mL,于CO2培养箱中平衡30 min,弃去HBSS进行实验。AP-BL 实验时,于AP 侧加入样品溶液0.5 mL,于BL 侧加入HBSS 1.5 mL。BL-AP 实验时,向AP 侧加入HBSS 0.5 mL,向BL 侧加入样品溶液1.5 mL。将小室置于37 ℃恒温水浴振荡器中,于90 min 吸取接受端样品,AP 侧取0.3 mL,BL 侧取0.6 mL,备用,每个样品设置3个复孔。
同时设立P-gp 抑制剂盐酸维拉帕米对照组,两侧的转运溶媒都加入盐酸维拉帕米,使其终浓度为1×10–4mol·L–1,计算90 min后药物的累积透过量和Papp,操作同上。
2.5.2 化合物不同作用时间对转运的影响 用HBSS 稀释各化合物,加入Caco-2 细胞单层模型,操作同2.5.1 项下。将小室置于37 ℃恒温水浴振荡器中,分别于30、60、90、120、150、180 min吸取接受端样品,AP 侧取0.3 mL,BL 侧取0.6 mL,备用,每个样品设置3个平行复孔。
2.6 含量测定
2.6.1 供试品溶液制备 精密吸取跨膜转运液,于4 ℃离心(10 142×g,10 min),取上清液过0.22 μm微孔滤膜,即得。
2.6.2 对照品溶液制备 用HBSS 配制含水晶兰苷5.090 mg·mL–1、去乙酰车叶草苷酸6.475 mg·mL–1、耐斯糖3.170 mg·mL–1的对照品溶液,备用。
2.6.3 色谱与质谱条件 水晶兰苷、去乙酰车叶草苷酸色谱条件:Ulyimate UHPLC AQ-C18色谱柱(50 mm×2.1 mm,1.8 μm);流动相为甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱(0~8 min,2%~15%A);检测波长为235 nm;流速为0.3 mL·min–1;进样体积为2µL;柱温为25 ℃。
耐斯糖色谱及质谱条件:ACQUITY UPLC BEH Amide 色谱柱(100 mm×2.1 mm,1.7 µm);流动相为0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱(0~13 min,35%~45%A);流速为0.3 mL·min–1;进样体积为1µL。采用电喷雾离子源(ESI),负离子模式扫描;离子扫描范围为m/z50~1000;毛细管电离电压为3.0 kV;源温度为150 ℃;脱溶剂温度为500 ℃;脱溶剂气流速为1000 L·h–1;锥孔气流速为50 L·h–1;多反应监测模式(MRM);锥孔电压为100 V;碰撞能量为42 eV,母离子与子离子分别为m/z665.095 8、89.025 1。
2.6.4 线性范围考察 用HBSS 稀释各对照品溶液,得到水晶兰苷质量浓度为0.127、0.636、1.273、3.818、5.090 mg·mL–1,去乙酰车叶草苷酸质量浓度为0.064 8、0.324 0、0.648 0、1.295 0、3.238 0、6.475 0 mg·mL–1,耐斯糖质量浓度为0.159、0.793、1.585、2.378、3.170 mg·mL–1的系列对照品溶液,按2.6.3 项下色谱、质谱条件测定,以各成分质量浓度为横坐标(X)、峰面积为纵坐标(Y)进行回归,计算各成分的回归方程和线性范围。
2.6.5 专属性考察 比较各成分及HBSS 色谱图,确认各成分之间是否存在干扰、HBSS 有无杂质干扰、HBSS对各成分是否存在干扰。
2.6.6 精密度试验 精密吸取各对照品溶液,按2.6.3项下色谱条件,于1 d 内分别进样5 次,再将其于5 d 中每日进样1 次,计算水晶兰苷、去乙酰车叶草苷酸、耐斯糖峰面积的RSD。
2.6.7 稳定性试验 精密吸取同一供试品溶液,照2.6.3项下方法,于0、2、4、6、8、10、12 h 进样,计算水晶兰苷、去乙酰车叶草苷酸、耐斯糖峰面积的RSD。
2.6.8 重复性试验 精密吸取同一小室BL 侧溶液6次,每次100 μL,按2.6.1项下方法制成供试品溶液,进样,计算水晶兰苷、去乙酰车叶草苷酸、耐斯糖含量的RSD。
2.6.9 加样回收率试验 精密吸取同一小室BL 侧溶液6 次,每次0.1 mL,按照比例(对照品加入量-样品中含量1∶1)加入混合对照品溶液,照2.6.1项下方法制备供试品溶液,分别测定。计算水晶兰苷、去乙酰车叶草苷酸、耐斯糖的平均加样回收率及RSD。
2.6.10 透过量测定 采用Papp作为评价指标,测定各化合物透过量。
3 结果
3.1 Caco-2细胞单层模型验证
3.1.1 细胞形态学考察 于倒置显微镜下观察培养了21 d 的Caco-2 细胞,发现细胞整体呈铺路石样形态,细胞之间紧密连接(图1)。

图1 培养21 d后Transwell中Caco-2细胞形态
3.1.2 TEER 考察 在培养21 d 内,Caco-2 细胞TEER 变化趋势为先上升然后小幅度下降,最后保持平稳,第21 天,Caco-2 细胞TEER 为(418.8±10.1)Ω·cm–2,说明单层细胞模型制备成功(图2)。
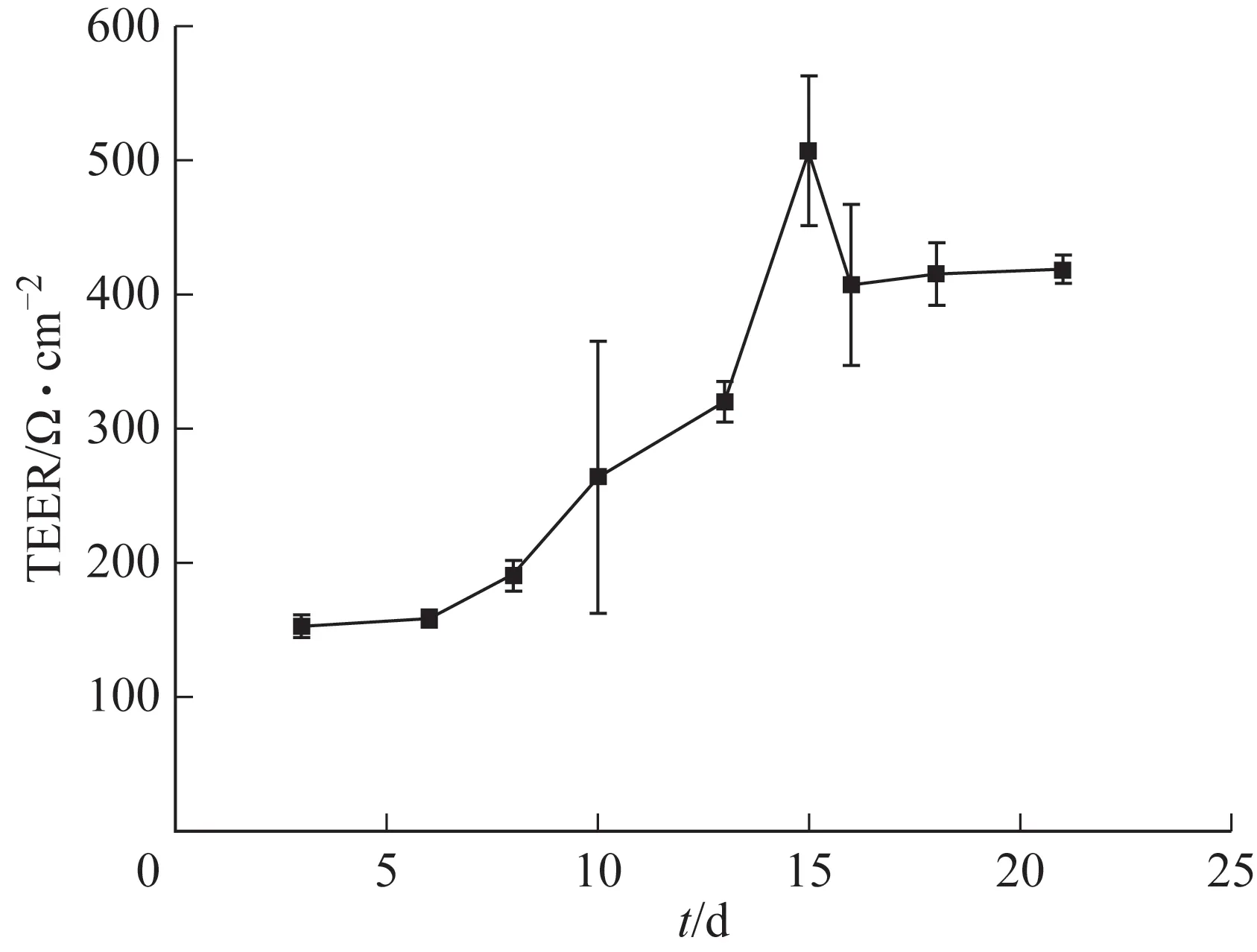
图2 Transwell中Caco-2细胞TEER变化(,n=3)
3.1.3 酚红透过率考察 结果见表1,发现第18 天开始,Caco-2细胞中酚红的Papp低于转运实验规定的1×10–6cm·s–1,说明单细胞层完整性符合转运实验要求[15]。

表1 Caco-2细胞单层模型的酚红Papp(n=3)
3.1.4 碱性磷酸酶活性考察 培养7、14、21 d Transwell 两侧培养基中AKP 活性见表2。第14、21 天,AP 侧AKP 活性分别是BL 侧的3.4、6.4 倍,表明在AP 侧已发生了明显、稳定的极化现象,Caco-2细胞单层模型制备成功[16]。
表2 Caco-2细胞单层模型AKP活性(,n=3)

表2 Caco-2细胞单层模型AKP活性(,n=3)
注:与BL侧比较,**P<0.01;1金氏单位=7.14 U·L–1。
3.2 不同质量浓度化合物对Caco-2细胞活性的影响
结果表明,水晶兰苷质量浓度≤0.126 6 mg·mL–1、去乙酰车叶草苷酸质量浓度≤0.062 5 mg·mL–1时,Caco-2 细胞存活率>98%,可在此质量浓度范围内进行实验;在各质量浓度耐斯糖作用下,Caco-2 细胞存活率均大于98%,且质量浓度越小细胞存活率越高(表3),故选取0.312 5 mg·mL–1作为其最小质量浓度进行实验。

表3 不同质量浓度化合物作用下Caco-2细胞存活率(n=3)
3.3 不同pH化合物对Caco-2细胞活性的影响
在pH为7.4时,3种成分对Caco-2 细胞活性影响均最小(表4),因此选择pH 7.4进行后续实验。

表4 不同pH化合物作用下Caco-2细胞存活率(n=3)
3.4 方法学考察结果
巴戟天中3 个化合物的回归方程及线性范围见表5。比较HBSS,水晶兰苷、去乙酰车叶草苷酸、耐斯糖对照品溶液和经细胞膜透过后各化合物色谱图。结果表明,HBSS 无杂质干扰,HBSS 对各成分无干扰(图3~4)。
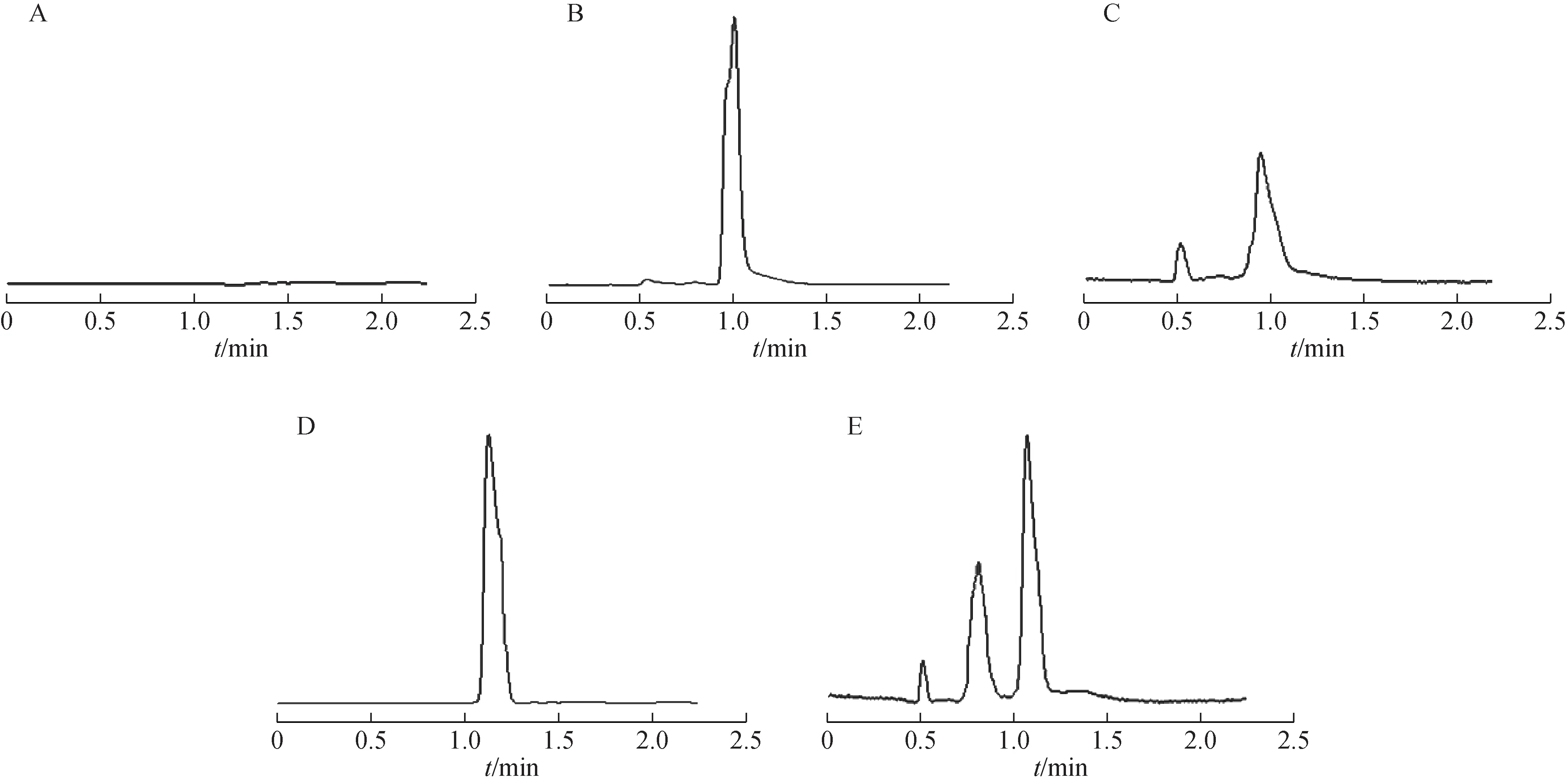
图3 HBSS、水晶兰苷与去乙酰车叶草苷酸对照品溶液及经细胞单层模型透过后各化合物HPLC图

表5 巴戟天中3个化合物的回归方程及线性范围
精密度试验结果表明,水晶兰苷、去乙酰车叶草苷酸、耐斯糖日内精密度的RSD 分别为1.71%、1.88%、1.97%,日间精密度RSD 分别为1.74%、1.70%、1.91%,表明方法精密度良好。重复性试验结果表明,水晶兰苷、去乙酰车叶草苷酸和耐斯糖含量RSD 的分别为1.12%、1.60%、1.05%,表明该方法重复性较好。稳定性结果表明,水晶兰苷、去乙酰车叶草苷酸、耐斯糖峰面积RSD分别为1.80%、1.90%、1.78%,说明仪器在此实验条件下12 h内稳定。加样回收率试验结果表明,水晶兰苷、去乙酰车叶草苷酸和耐斯糖的平均加样回收率分别为98.09%、101.14%、100.49%,RSD 分别为0.97%、1.54%、1.59%,见表6。

表6 巴戟天中3个化合物的加样回收率试验结果
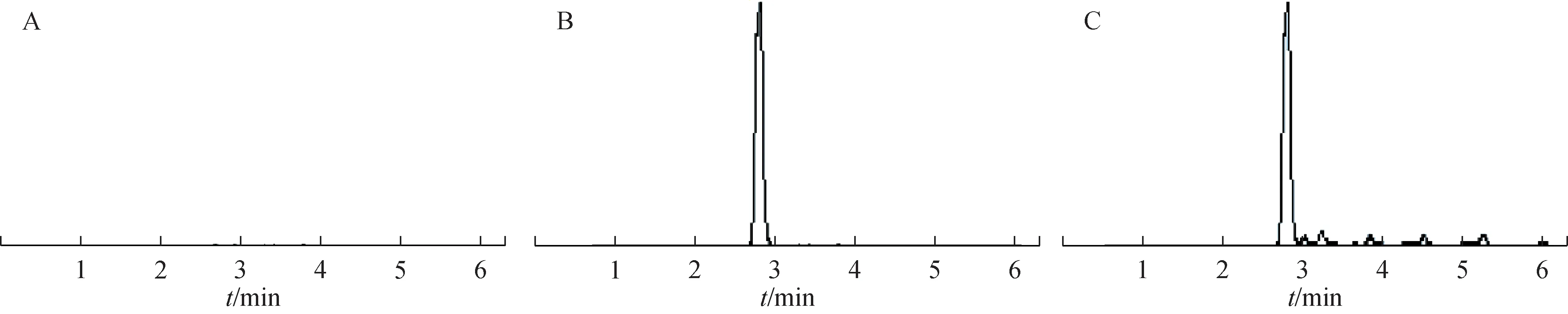
图4 HBSS、耐斯糖对照品溶液及经细胞单层模型透过后耐斯糖HPLC图
3.5 跨膜转运实验
3.5.1 化合物不同质量浓度对转运的影响 90 min内,3 个质量浓度水晶兰苷、去乙酰车叶草苷酸和耐斯糖的Papp均大于1×10–5cm·s–1,说明三者体内吸收均良好。相比于高渗透性对照药盐酸普萘洛尔[Papp为(0.423 0±0.056 9)×10–4cm·s–1)],三者均为高渗透性化合物。在90 min 时间内,PappAP-BL与PappBL-AP 的比值均接近1,说明这3 个成分在转运此过程中无方向性。加入P-gp 抑制剂维拉帕米后Papp变化不大,说明水晶兰苷、去乙酰车叶草苷酸和耐斯糖的小肠吸收不需要载体,其吸收机制可能是被动吸收(表7)。
表7 水晶兰苷、去乙酰车叶草苷酸和耐斯糖在Caco-2细胞单层模型中的Papp(,n=6)

表7 水晶兰苷、去乙酰车叶草苷酸和耐斯糖在Caco-2细胞单层模型中的Papp(,n=6)
注:PappV为加入维拉帕米后的Papp。
3.5.2 化合物作用不同时间对转运的影响 如图5所示,随着时间的延长,3 个化合物双侧Papp均呈增加趋势,且低质量浓度组双侧Papp明显大于中、高质量浓度组,说明三者的小肠吸收可能存在自身质量浓度抑制现象。

图5 不同质量浓度水晶兰苷、去乙酰车叶草苷酸和耐斯糖的Papp随时间变化情况(,n=6)
4 讨论
本实验中筛选化合物质量浓度时发现,即使最大质量浓度的耐斯糖也未对Caco-2 细胞活性造成影响,这可能是由于此细胞营养液中需要大量糖分供给,耐斯糖作为营养物质不会对细胞活性产生影响。在水晶兰苷的液相色谱图中无其他物质的明显色谱峰出现,而在去乙酰车叶草苷酸的液相色谱图中可见少量水晶兰苷的色谱峰,可见在跨膜转运过程中可能有少量的去乙酰车叶草苷酸转化成水晶兰苷,推测去乙酰车叶草苷酸可能存在首过代谢。
在Caco-2 细胞单层模型中,通常认为吸收完全的药物Papp高(>1×10–6cm·s–1),吸收不完全的药物Papp低(0.1×10–6~1.0×10–6cm·s–1)[17]。本实验中水晶兰苷、去乙酰车叶草苷酸和耐斯糖3 个成分的Papp均大于10–5cm·s–1,说明这3 个成分在小肠内的吸收均良好。可以通过计算药物在小室双侧Papp的比值判断药物的吸收机制[18-19],在加入维拉帕米后,若得到几乎不变的Papp,则说明药物为被动吸收机制。本研究考察了水晶兰苷、去乙酰车叶草苷酸和耐斯糖质量浓度、时间、pH与P-gp抑制剂维拉帕米在水晶兰苷、去乙酰车叶草苷酸和耐斯糖吸收转运况的影响,在90 min内,不同质量浓度的化合物双侧Papp比值均接近1,且加入维拉帕米后不同质量浓度药液Papp差异无统计学意义,进一步证实这3 个成分在小肠内主要以被动转运为主。

